
Полная версия
Парадоксы эволюции. Как наличие ресурсов и отсутствие внешних угроз приводит к самоуничтожению вида и что мы можем с этим сделать
Дополнительным объяснением может быть как раз то, что митохондрии – не столько «маленькие энергетические станции» клетки, а ключевые фигуранты практически всего клеточного метаболизма, в том числе узкоспециализированного для определенных клеток и тканей, а также коммутаторы обмена информацией как внутри клетки, так и вовне, включая коммуникации с другими симбионтами организма, такими, какими когда-то были их предки. В конце концов вполне можно представить (БОН: глава VII), что это не архейная клетка милостиво соблаговолить изволила впустить митохондриальных предков в свой богатый внутренний мир за «мзду малую» ради взаимовыгодного сожительства-симбиоза (бывает ли когда сожительство равно взаимовыгодным?), но предки митохондрий сами пришли и взяли свое по «праву сильного». И до сих пор их наследники, несмотря на свою малость и невзрачность, держат ключевые пути метаболизма и коммуникаций всей единой клетки и всего единого организма в своих руках.
В работе митохондрий задействовано около 3000 генов из порядка 22 000 генов человека. Из них чуть больше 100 генов (3 %) кодируют белки ЭТЦ. И только 13 из них, обеспечивающих самую быструю реакцию, остались в самой митохондрии. Остальные 97 % митохондриальных белков, преимущественно ферментов, обеспечивают во всех клетках окисление белков, жиров и углеводов, метаболизм холестерина, эстрогенов и тестостерона, дифференцировку и специализацию клеток, а в уже специализированных клетках – выполнение ключевых операций их узкого функционала.
Например, в эндокринных клетках – выработку большинства нейротрансмиттеров, в клетках печени – реакции детоксикации, в предшественниках эритроцитов – синтез гема. Даже функциональность иммунных клеток, например цитотоксических Т-лимфоцитов, определяется их уровнем митохондриальной белковой трансляции, где митохондрии оказываются ранее недооцененными гомеостатическими регуляторами их цитотоксичности (Lisci M. et al., 2021). Перечень функций белков, работающих в митохондриях, пусть и закодированных в генах ядерных хромосом, этим перечнем, разумеется, далеко не ограничивается.
Непреклонная воля
Дикий прапор из фильма «ДМБ», если бы проводил экскурсию молодым солдатам-молекулам по многочисленным криптам-закоулкам митохондрии, показал бы как минимум четыре места «откуда, ребятки, наша митохондрия диктует свою непреклонную волю остальному клеточному сообществу».
1. Белок цитохром С – одна из небольших, но важных шестеренок ЭТЦ. Однако при выпадении из цепи она становится «черной меткой» для всей клетки: активирует каскад ферментов-каспаз, заканчивающийся организованной (запрограммированной) смертью всей клетки – апоптозом (Liu X. et al., 1996).
2. Промежутки между основными белковым комплексами ЭТЦ. Отсюда, как снопы искр из-под вагонных тележек, выскакивают активные формы кислорода (АФК: например перекись водорода, супероксид-анион, гидроксил). Через окисление тиоловых групп в промежуточных белках они активируют факторы транскрипции ключевых групп генов, определяющих функциональный статус всей клетки (Chandel N.S. et al., 1998).
3. Фермент 5’АМФ-активируемая протеинкиназа (AMP-activated protein kinase, AMPK) – регулятор энергетического статуса клетки. Контролирует слияние митохондрий в длинные рабочие нити-спагетти при высокой потребности клетки в энергии и распад на мелкие зернышки-орзо (в терминах итальянской пасты, рис. 8), при переходе клетки в экономный режим существования (Herzig Sand Shaw R. J., 2018).
4. Митохондриальная ДНК (мтДНК). Когда находится внутри митохондрии, выполняет естественную функцию хранилища последних митохондриальных генов. Но при попадании в цитозоль у некоторых иммунных (миелоидных) клеток запускает особую последовательность молекулярных взаимодействий, так называемый ДНК-чувствительный cGAS – STING сигнальный путь. Этот путь отлично работает при разрушении, например, чужеродной ДНК вирусов. Но в случае мтДНК иммунная клетка идет дальше и переходит в состояние готовности немедленно начать воспалительную реакцию даже в отсутствии вредоносного вируса-патогена. Одновременно запускает формирование сложных многобелковых воспалительных комплексов – инфламмасом (West A. P. and Shadel G. S., 2017).
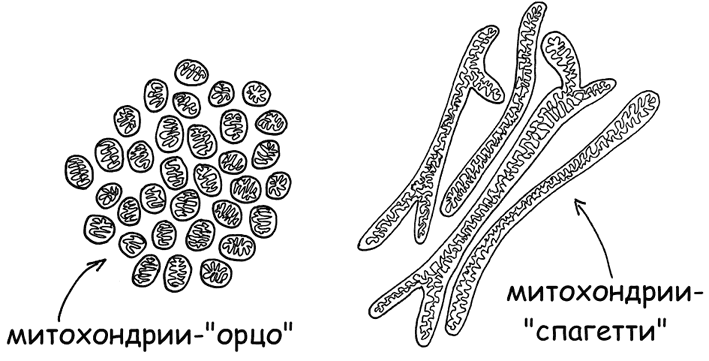
Рис. 8. Митохондрии в форме орзо и спагетти
Инмакулада Мартинез-Рейз и Навдип Чандел (Inmaculada Martinez-Reyes and Navdeep Chandel, 2020) из Медицинской Школы Северо-Западного Университета в Чикаго считают, что эти четыре механизма власти митохондрий можно дополнить еще и пятым, через который также определяется жизнь и судьба, но уже не столько самой клетки, а всего организма. Этот пятый механизм непосредственно влияет на иммунную систему, включая его возможности защититься от инфекций и опухолевого перерождения. Сердцем этого механизма является уже упоминавшийся цикл Кребса, или цикл трикарбоновых кислот (у которых основной «скелет» составляют три атома углерода). Это своего рода центральная карусель во всеобщем метаболическом парке развлечений любой сложной клетки располагается именно в митохондриях. На ней без остановок катаются девять непрестанно взаимопревращающихся трикарбоновых кислот. Эту карусель вращают непрерывно заскакивающие на нее пируват и ацетил-коэнзим А, и соскакивающие с нее восстановительные эквиваленты. Соскочив, они несут свои атомы водорода, как игровые бонусы, прямиком в кассу ЭТЦ, чтобы обменять на универсальную и доступную всем энергетическую валюту АТФ. Но катающиеся на карусели органические кислоты тоже могут иногда соскакивать с карусели и начать разруливать сложные проблемы в парке обмена веществ и во всем организме.
Так, лимонная кислота может выйти из митохондрии через свою особую дверь – декарбоксилатный антипортер А1 25-го семейства переносчиков растворенных веществ SLC25A1 (хорошо, что ей при выходе не нужно называть весь этот пароль). Оказавшись в цитозоле или ядре, она с помощью специального фермента ACLY превращается в ацетил-коэнзим А (митохондриальный ацетил-коэнзим А из самой митохондрии, увы, просто так не выпускают – он должен непрерывно «вращать карусель»).
В ядре ацетил-коэнзим А может ацетилировать хроматин. Это вообще-то его основная задача – ацетилировать все, что нужно (то есть прикреплять к другим молекулам остаток уксусной кислоты – ацетата). Но ацетилирование хроматина – белкового комплекса из гистонов, вокруг которого закручена вся ядерная ДНК, – имеет далеко идущие последствия. Это одна из форм изменения так называемой эпигенетической наследственности, то есть способа включения и выключения определенных генов, не связанного с изменением собственно нуклеотидной последовательности ДНК (другая форма, например метилирование самой ДНК). Так как большинство генов регуляторные, то частичное ацетилирование хроматина изменяет профиль экспрессии генов – часть генов тормозится, часть, наоборот, активируется в зависимости от наличия и уровня множества других специальных факторов транскрипции (запуска генов).
В любом случае даже небольшое изменение содержание ацетил-коэнзима А в ядре ведет к значительной перестройке работы всей генетической программы клетки (Sivanand S., Viney I., Wellen K. E., 2018), преимущественно в сторону ускорения реакций роста и размножения (анаболизма и пролиферации). Такая полная и быстрая перестройка через ацетилирование хроматина исключительно важна для согласованной работы ключевых клеток иммунной системы – макрофагов, Т-лимфоцитов. В них, с учетом всей поступившей информации (информационного контекста, БОН: глава XII) – в первую очередь о возможности бактериального присутствия (по уровню липополисахарида, ЛПС), о предпочтительности активного, воспалительного типа реагирования (по уровню провоспалительных факторов транскрипции STAT и нуклеарного фактора каппа NF-κB) – повышается уровень ACLY, лимонная кислота из митохондрий мобилизируется в ядро и цитоплазму, где превращается в ацетил-коэнзим А, ядерный хроматин ацетилируется и запускается программа ускоренного размножения и выработки молекул воспаления, включая АФК, оксид азота и простагландины макрофагами (Infantino V. et al., 2013), γ-интерферона Т-лимфоцитами (Peng M. et al., 2016).
Модуляторы иммунитета и опухолевого роста
Подобный путь поддержки роста и размножения активно работает и во многих опухолевых клетках. Искусственное торможение фермента ACLY в опухолевых клетках может задерживать их рост (Hatzivassiliou G. et al., 2005), но, к сожалению, в плане практического применения этот способ пока трудноосуществим. Также с возможностью опухолевого перерождения клетки связано накопление в ядре и цитоплазме двух других кислот с митохондриальной трикарбоновой карусели – фумаровой и янтарной (фумарата и сукцината). Как правило, это вызывается неблагоприятными мутациями в генах обслуживающих их ферментов-дегидрогеназ. Появление и накопление этих кислот в ядре вызывает гиперметилирование ДНК и хроматина. А поскольку это формы эпигенетического изменения наследственности, то в клетке также изменяется и реализация генетической программы в сторону опухолевого типа метаболизма (Niemann S. and Muller U., 2000; Sciacovelli M. et al., 2016). Вообще, признав митохондрии краеугольным камнем эволюции сложной жизни, неким гарантом энергетической и информационной целостности сложных многоклеточных организмов, нетрудно представить, что они несут определенную ответственность и за распад этой целостности в случае злокачественных опухолей. Рассмотрению этого вопроса будет посвящен основной раздел предпоследней главы этой книги.
В нормальных физиологических условиях метаболиты цикла Кребса функционируют как модуляторы иммунитета. Янтарная кислота скорее поддерживает развитие воспаления (Tannahill G. et al., 2013; Littlewood-Evans A. et a.l, 2016), хотя на макрофаги, особенно в некоторых тканях, например жировой, янтарная кислота действует противовоспалительно (Keiran N. et al., 2019) Торможение воспаления фумаровой кислотой, особенно в слегка измененной, но физиологической форме диметилфумаровой кислоты еще более выражено (O’Neill L. A., Kishton R. J. and Rathmell J., 2016). Вообще, близкие родственники (производные) трикарбоновых кислот с митохондриальной карусели, как правило, еще более активны. Так, итаконовая (метилен-янтарная) кислота обладает очень выраженными иммуномодулирующими и антибактериальными свойствами. Своим действием она уравновешивает провоспалительные эффекты янтарной кислоты, а также способна «перекрывать кран» с углеводами организма для многих бактерий-паразитов. Также крайне разносторонними эффектами на иммунную систему обладает трикарбоновая альфа-кетоглутаровая кислота (α-КГ). Она влияет и на эпигенетику клетки: не расставляет, как ацетил-коэнзим А, ацетиловые метки на хроматине, а убирает метиловые метки, расставленные, например, S-аденозилметионином. В особенности активна производная от α-КГ – 2-гидроксиглутаровая кислота. Она способна ключевым образом влиять на дифференцировку иммунных Т-клеток с помощью аналогичных эпигенетических механизмов (Xu T. et al., 2017). И, пожалуй, самое главное, что большинство из названных факторов конструируют специфический эпигенетический ландшафт неадаптивных иммунных клеток при формировании «тренированного иммунитета» (БОН: глава XII).
Располагая таким внушительным арсеналом определяющих воздействий на состояние всей клетки и даже влияя на функциональный статус всей совокупности клеток – всего организма, митохондрион не может быть простым пассивным топливным элементом клетки; очевидно, что именно он ведущий игрок в сложной внутриклеточной игре, определяющий функциональный потенциал и в целом судьбу как «своей» клетки, так и, во многом, всего организма. Но является ли он лишь одним из ведущих игроков, разделяя дуумвират или триумвират, например с ядром и/или хлоропластами (в растительной клетке), или обладает безусловным лидерством, подчиняя остальных своим интересам? Ответ может лежать у самых оснований жизни и эволюции, на зыбкой границе термодинамики, квантовой физики и физической химии.
Библиографический список
1. Димер Д., Джокич Т., ван Кранендонк М. (2017). Источники жизни. ВМН № 10, с. 14–20.
2. Диброва Д. В., Гальперин М. Ю., Кунин Е. В., Мулкиджанян А. Я. (2015). Древние системы натрий-калиевого гомеостаза клетки как предшественники мембранной биоэнергетики. Биохимия, 80, с. 590–611.
3. Козлова М. И., Бушмакин И. М., Беляева Ю. Д., Шалаева Д. Н., Диброва Д. В., Черепанов Д. А., Мулкиджанян А. Я. (2020). Экспансия «натриевого мира» сквозь эволюционное время и таксономическое пространство. Биохимия, 85, с. 1788–1815.
4. Guo W., Kinghorn A. B., Zhang Y., Li Q., Poonam A. D., Tanner J. A., Shum H. C. (2021). Non-associative phase separation in an evaporating droplet as a model for prebiotic compartmentalization. Nat Commun 12, 3194.
5. Mulkidjanian A. Y., Bychkov A. Y., Dibrova D. V., Galperin M. Y., Koonin E. V. (2012). Origin of first cells at terrestrial, anoxic geothermal fields. Proc Natl Acad Sci USA. Apr 3; 109(14): E821-30.
6. Skilhagen S. E. (2011). Osmotic power; status, opportunities and future plans. Osmotic power seminar, Tokyo, November 8th, 2011.
7. Brogioli D. (2009). Extracting renewable energy from a salinity difference using a capacitor. Physical review letters, 103 5, 058501.
8. Ye M., Pasta M., Xie X., Dubrawski K., Xu J., Liu C., Cui Y., Criddle C. (2019). Charge-Free Mixing Entropy Battery Enabled by Low-Cost Electrode Materials. ACS Omega, 4, 11785–11790.
9. Papayannopoulos V. (2018). Neutrophil extracellular traps in immunity and disease. Nature Reviews Immunology 18, 134–147.
10. Sharma P., Garg N., Sharma A., Capalash N., Singh R. (2019). Nucleases of bacterial pathogens as virulence factors, therapeutic targets and diagnostic markers. Int J of Medical Microbiology, Vol. 309, Issue 8, 151354.
11. Artés J., Li Y., Qi J., Anantram L. P., Hihath J (2015). Conformational gating of DNA conductance. Nat Commun 6, 8870.
12. Rothemund P. W. K. (2006). Folding DNA to create nanoscale shapes and patterns. Nature 440, 297–302.
13. Xu J., Chmela V., Green N., Russel D.A., Janicki M. L., Gora R. W., Szabla R. A., Bond A. D., Sutherland J. D. (2020). Selective prebiotic formation of RNA pyrimidine and DNA purine nucleosides. Nature 582, 60–66.
14. Extance A. (2020). The First Gene on Earth May Have Been a Hybrid. Scientific American, Vol. 323, issue 3.
15. Murayama K., Okita H., Kuriki T., Asanuma H. (2021). Nonenzymatic polymerase-like template-directed synthesis of acyclic L-threoninol nucleic acid. Nat Commun 12, 804.
16. Flynn R. A., Pedram K., Malaker S. A., Batista P. J., Smith B. A. H., Johnson A. G., George B. M., Majzoub K., Villalta P. W., Carette J. E., Bertozzi C. R. (2021). Small RNAs are modified with N-glycans and displayed on the surface of living cells. Cell. 8:S0092-8674(21)00503-1.
17. Mast C. B., Osterman N., Braun D. (2010). Disequilibrium First: The Origin of Life. Journal of Cosmology, Vol. 10, 3305–3314.
18. Mast C. B., Schink S., Gerland U., Braun D. (2013). Escalation of polymerization in a thermal trap. PNAS 110 (20).
19. Attal R., Schwartz L. (2021). Thermally driven fission of protocells. Biophys J. 21; 120 (18): 3937–3959.
20. Lane N. (2015). The Vital Question: Why is Life the Way It Is? Profile Books Ltd, Great Britain.
21. Lisci M., Barton P. R., Randzavola L. O., Ma C. Y., Marchingo J. M., Cantrell D. A., Paupe V., Prudent J., Stinchcombe J. C., Griffiths G. M. (2021). Mitochondrial translation is required for sustained killing by cytotoxic T cells. Science. 15; 374 (6565): eabe9977.
22. Liu X., Kim C. N., Yang J., Jemmerson R., Wang X. (1996). Induction of apoptotic program in cell-free extracts: requirement for dATP and cytochrome c. Cell 86, 147–157.
23. Chandel N. S., Maltepe E., Goldwasser E., Mathieu C. E., Simon M. C., Schumacker P. T. (1998). Mitochondrial reactive oxygen species trigger hypoxia induced transcription. Proc. Natl Acad. Sci. USA 95, 11715–11720.
24. Herzig S., ShawR. J. (2018). AMPK: guardian of metabolism and mitochondrial homeostasis. Nat. Rev. Mol. Cell Biol. 19, 121–135.
25. West A. P., Shadel G. S. (2017). Mitochondrial DNA in innate immune responses and inflammatory pathology. Nat. Rev. Immunol. 17, 363–375.
26. Martinez-Reyes I., Chandel N.S. (2020). Mitochondrial TCA cycle metabolites control physiology and disease. Nat Comm, 11: 102.
27. Sivanand S., Viney I., Wellen K. E. (2018). Spatiotemporal control of acetyl-CoA metabolism in chromatin regulation. Trends Biochem. Sci. 43, 61–74.
28. Infantino V., Iacobazzi V., Palmieri F., Menga A. (2013). ATP-citrate lyase is essential for macrophage inflammatory response. Biochem. Biophys. Res. Commun. 440, 105–111.
29. Peng M., Yin N, Chhangawala S., Xu K., Leslie C. S., Li M. O. (2016). Aerobic glycolysis promotes T helper 1 cell differentiation through an epigenetic mechanism. Science 354, 481–484.
30. Hatzivassiliou G., Zhao F., Bauer D. E., Andreadis C., Shaw A. N., Dhanak D., Hingorani S. R., Tuveson D. A., Thompson C. B. (2005). ATP citrate lyase inhibition can suppress tumorcellgrowth. Cancer Cell 8, 311–321.
31. Niemann S., Muller U. (2000). Mutations in SDHC cause autosomal dominant paraganglioma, type 3. Nat. Genet. 26, 268–270.
32. Sciacovelli M., Gonçalves E., Johnson T. I., Zecchini V. R., da Costa A. S., Gaude E., Drubbel A. V., Theobald S. J., Abbo S. R., Tran M. G., Rajeeve V., Cardaci S., Foster S., Yun H., Cutillas P., Warren A., Gnanapragasam V., Gottlieb E., Franze K., Huntly B., Maher E. R., Maxwell P. H., Saez-Rodriguez J., Frezza C. (2016). Fumarate is an epigenetic modifier that elicits epithelial to-mesenchymal transition. Nature 537, 544–547.
33. Tannahill G.M., Curtis A.M., Adamik J., Palsson-McDermott E. M., McGettrick A. F., Goel G., Frezza C., Bernard N.J., Kelly B., Foley N. H., Zheng L., Gardet A., Tong Z., Jany S. S., Corr S. C., Haneklaus M… Caffrey B. E., Pierce K., Walmsley S., Beasley F. C., Cummins E., Nizet V., Whyte M., Taylor C. T., Lin H., Masters S. L., Gottlieb E., Kelly V. P., Clish C., Auron P. E., Xavier R. J., O’Neill L. A. (2013). Succinate is an inflammatory signal that induces IL-1 beta through HIF-1alpha. Nature 496, 238–242.
34. Littlewood-Evans A., Sarret S., Apfel V., Loesle P., Dawson J., Zhang J., Muller A., Tigani B., Kneuer R., Patel S., Valeaux S., Gommermann N., Rubic-Schneider T., Junt T., Carballido J. M. (2016). GPR91 senses extracellular succinate released from inflammatory macrophages and exacerbates rheumatoid arthritis. J. Exp. Med. 213, 1655–1662.
35. Keiran N., Ceperuelo-Mallafré V., Calvo E., Hernández-Alvarez M.I., Ejarque M., Núñez-Roa C., Horrillo D., Maymó-Masip E., Rodríguez M. M., Fradera R., de la Rosa J. V., Jorba R., Megia A., Zorzano A., Medina-Gómez G., Serena C., Castrillo A., Vendrell J., Fernández-Veledo S. (2019). SUCNR1 controls an anti-inflammatory program in macrophages to regulate the metabolic response to obesity. Nat Immunol.; 20 (5): 581–592.
36 O’Neill L. A., Kishton R. J., Rathmell J. (2016). Aguide to immunometabolism for immunologists. Nat. Rev. Immunol. 16, 553–565.
37. XuT., Stewart K. M., Wang X., Liu K., Xie M., Ryu J. K., Li K., Ma T., Wang H., Ni L., Zhu S., Cao N., Zhu D., Zhang Y., Akassoglou K., Dong C., Driggers E. M., Ding S. (2017). Metabolic control of TH17 and induced Treg cell balance by an epigenetic mechanism. Nature 548, 228–233.
Глава III. Энтропийные пули из будущего
Нолан: «Катится колобок дальше, а на встречу ему…»
Зритель: «Лиса?»
Нолан: «А на встречу ему колобок»
cjellicle svlad (@gorgongor) September 4, 2020
Из обсуждения фильма «Довод», К. Нолан, 2020Квантовый взгляд
Алистер Нанн, Джефри Гай и Джимми Белл в своем всеобъемлющем анализе эволюционной функции митохондрий «заквантовали» известную фразу замечательного советского и американского генетика Феодосия Добржанского (без которой не обходится ни одна приличная книга по биологическому научпопу) «Ничего в биологии не имеет смысла, кроме как в свете эволюции и квантовой физики» (Nunn A. et al., 2016; Dobzhansky T., 1973). В этом уже квантовом или энергетическом свете, который нам дают митохондрии, есть смысл рассмотреть эволюцию живого еще один (и не последний) раз.
Дарвиновская эволюция и естественный отбор самореплицирующихся молекул в химическом смысле вне зависимости от конкретных механизмов (включая предложенные в предыдущей главе) начались, безусловно, задолго до начала распознанной биологической жизни (Pross A., 2012). В терминах термодинамики жизнь часто обозначается как диссипативная (то есть открытая неравновесная, рассеивающая энергию) структура, движимая градиентом энергии, который увеличивает энтропию окружающей среды. Отдельная живая клетка в термодинамическом смысле может быть описана как полуоткрытая система, позволяющая упорядоченной энергии входить в себя, а энтропии в виде отходов – покидать.
Эрвин Шредингер, один из основоположников квантовой физики, в своих физико-биологических лекциях 1944 года высказал следующую идею о соотношении энтропии и жизни: «Живой организм непрерывно увеличивает свою энтропию, или, иначе, производит положительную энтропию и, таким образом, приближается к опасному состоянию максимальной энтропии, представляющему собой смерть. Он может избежать этого состояния, то есть оставаться живым, только постоянно извлекая из окружающей его среды отрицательную энтропию. Отрицательная энтропия – это то, чем организм питается. Или, чтобы выразить это менее парадоксально, существенно в метаболизме то, что организму удается освобождаться от всей той энтропии, которую он вынужден производить, пока жив» (Schroedinger E., 1944). Всеобщий источник отрицательной энтропии (негэнтропии) Шредингера – по сути «порядка», то есть упорядоченной энергии – энергия Большого Взрыва, застывшая в атомных ядрах и высвобождающаяся в ядерных топках бесчисленных звезд нашей Вселенной. Грандиозная разница потенциалов между этими «топками» и невообразимым холодом окружающего их космоса формирует упорядоченные потоки энергии. Сейчас мельчайшая доля упорядоченной энергии нашего Солнца непосредственно поглощается земными фототрофными организмами, что служит основанием гигантской пищевой пирамиды, составляющей земную биосферу. Самые первые протоорганизмы, скорее всего, не могли использовать эту энергию непосредственно – появление такой возможности и стало первым камешком в невероятной лавине глобального усложнения жизни – но могли использовать крохи упорядоченной энергии в виде разности химических потенциалов и температур. В глобальном видении от момента Большого Взрыва, когда упорядоченность во Вселенной была бесконечно высокой, а сложность – бесконечно малой, общая упорядоченность стремится к убыванию, энтропия, соответственно, – к росту, но и локальная сложность, тем не менее – также к увеличению. Здесь нет никакого противоречия. Рассматривая живых существ в отдельности, можно бы посчитать, что «в них» энтропия падает, причем за счет разгоняемого ими непропорционального роста энтропии «вне их». Проблема в том, что неравновесные системы, какими являются живые существа и их сообщества, практически невозможно рассматривать как изолированные термодинамические системы и четко различить, что находится «в них», а что уже «вовне», несмотря на существование, казалось бы, объективных физических границ. Предполагая, что совокупная масса биосферы Земли уже достигла если не своего максимума, то, по крайней мере, плато своего роста, можно предположить и далее, что биосфера в целом, в конце концов, в большом масштабе времени, способна ускорять рост энтропии, особенно если брать в расчет общее направление деятельности той ее части, которая считает себя разумной.
Для калибровки и представления об уровне энтропии сложного организма в общем контексте физического мира можно привести пример расчетов Льва Блюменфельда (1977): вся информация, заключенная в человеке (содержащаяся в ДНК, белках, сознании, памяти и пр.) в энтропийных единицах соответствует энтропии испарения половины литра воды.
Энтропия, термодинамика и «разумность» жизни
При росте клетки ей становится все труднее поддерживать внутреннюю упорядоченность в силу кратного увеличения собственного объема, и клеточное деление становится решением, позволяющим уменьшившимся дочерним клеткам далее снова повышать свою внутреннюю упорядоченность. В этом смысле даже умножение генетического материала можно считать движимым базовыми термодинамическими эффектами (БОН: глава V). Термодинамические квантовые эффекты в клетках определяются их способностью обрабатывать и реагировать на информационные и энергетические потоки, что может быть названо их «разумностью». Такое явление, как умеренный стресс, или гормезис, способный оказывать влияние на гомеостаз и ведущий к благоприятной адаптации к стрессу, повышению сопротивляемости, может лежать в основе эволюции «разумности» (intelligence) (Nunn A., 2014). В какой-то степени любая форма жизни демонстрирует «разумность» как неизбежное следствие эволюции в условиях изменяющейся окружающей среды. Обратной стороной этого феномена может стать то, что жизнь и ее «разумность» не смогут эволюционировать в полностью благоприятной среде, и отсутствие гормезиса будет приводить к медленному отклонению организма от оптимального функционирования.






