
Полная версия
Персонализированная медицина нового поколения: клональная реконституция гемопоэза и CHIP-основанная
Перспектива 1. Информированные, наделенные полномочиями, заинтересованные и ответственные граждане: а) все данные, связанные со здоровьем, контролируются лично гражданином; б) ввод данных о здоровье и доступ к ним поддерживаются и контролируются лично гражданином; c) имеются легкодоступные, надежные и понятные источники медицинской информации, то есть проверенные и утвержденные приложения или интернет-инструменты.
Перспектива 2. Информированные, наделенные полномочиями, заинтересованные и ответственные поставщики персонализированных медицинских услуг: а) безопасные технологии лечения для каждого пациента, поддерживаемые подходящими решениями в области информационных и коммуникационных технологий (ИКТ), станут обычным делом в клинике; b) индивидуальное лечение пациентов с множественными заболеваниями, не ответивших на лечение, пожилых людей и других уязвимых групп с минимизацией побочных эффектов будет являться рутинным, требующим принятия клинических решений междисциплинарными командами и разработки новых медицинских профессий для поддержки персонализированного здравоохранения; c) в обучении медицинских работников будут учитываться междисциплинарные аспекты персонализированной медицины, такие как использование ИКТ и вопросы политики/регулирования, включая равенство и этику, для доступа и адекватного использования всей информации. г) Клиницисты и исследователи будут тесно сотрудничать для поддержки быстрой разработки и внедрения персонализированных клинических решений.
Перспектива 3. Системы здравоохранения, обеспечивающие персонализированные и оптимизированные меры по укреплению здоровья, профилактике, диагностике и лечению на благо граждан и пациентов, обеспечат страховое покрытие, и это станет реальностью: a) gерсонализированные медицинские услуги будут оптимизированы с точки зрения эффективности и справедливости; b) справедливое и разумное распределение ресурсов в рамках систем здравоохранения будет соответствовать общественным ценностям; c) будет обеспечен безопасный поток данных о здоровье и связанных с ним сведений от граждан и систем здравоохранения к регулирующим органам и исследователям в том числе.
Перспектива 4. Доступность и оптимальное использование информации, связанной со здоровьем, для оптимизации лечения, ухода, профилактики и исследований станет нормой. a) электронные медицинские карты (EHR) будут использоваться поставщиками медицинских услуг и исследователями для более эффективного здравоохранения; b) гармонизированные решения для обеспечения конфиденциальности, безопасности и защиты данных будут использоваться прозрачным образом на протяжении всего процесса управления медицинскими данными; c) оптимизированное лечение и профилактика приносят пользу гражданам при минимальных затратах и рисках.
Перспектива 5. Экономическая ценность здравоохранения будет обеспечена за счет создания медицины следующего поколения: а) разумный баланс между инвестициями, прибылью и общей выгодой для граждан станет реальностью персональной медицины; б) будут внедрены инновационные и соответствующие бизнес-концепции и модели для управления проектами; c) решения для телемедицины и мобильные приложения будут способствовать управлению проектами и иметь экономическую ценность; d) будут создаваться новые рабочие места в системах здравоохранения, включая профессии, связанные с данными, такие как «Информационные специалисты».
Но так видят решение проблемы борьбы с неинфекционными болезнями цивилизации ведущие западные специалисты! А что в Российской Федерации с этой проблемой? Проведенный анализ ситуации в стране в области состояния, развития и продвижения предиктивной, превентивной и персонализированной медицины показал, что в настоящее время наша страна катастрофически отстает от большинства экономически высокоразвитых стран Евросоюза, Великобритании, США, Японии, Южной Кореи и Китая, где этому направлению национального здравоохранения отдан основной приоритет в экономическом развитии государства и обеспечен приоритет государственного финансирования. В нашей стране вообще не существует специализированного отечественного оборудования для полногеномных, транскриптомных, протеомных и метоболомных исследований клеток и тканей животных и человека, что является уже не проблемой медицины, а проблемой национальной безопасности страны. Все реактивы для генетических, транскриптомных, метаболомных, протеомных исследований производятся за рубежом. Клеточные коллекции, международные банки данных клеток и тканей, банки данных опухолевых клеток являются зарубежными, и российским ученым к ним ограничен или запрещен допуск. Российская наука технологически отстает от производителей продуктов, товаров и услуг ведущих стран мира почти на два десятилетия и является не производителями высоких технологий научного развития, а лишь потребителями и покупателями высокотехнологичной зарубежной продукции и товаров специализированной медицины. Еще в 2000 году бывший президент США Барак Обама, подводя итоги глобального проекта «Геном человека», объявил, что еще ни один из проектов государства (США) не был так прибылен, как данный проект персонализированной геномной медицины, и каждый доллар США, вложенный в этот проект, принес прибыль в 100 долларов. Он отметил, что такой прибыли не получают даже колумбийские наркокартели и торговцы оружием и это направление в экономике страны надо активно развивать и поддерживать. Финансовые аналитики всего мира пришли к парадоксальному заключению, что именно персонализированная медицина в экономике любой высокоразвитой страны способна конкурировать по прибыльности с доходностью нефтегазового сектора экономики и современной фармацевтической индустрией. Последним примером может служить регистрация в управлении по контролю качества пищевых продуктов и лекарственных средств (FDA) США генотерапевтического клеточного препарата «Спинраза», себестоимость которого обходится производителю (швейцарская фармкомпания «Новартис») не более 10 000 евро при его отпускной цене пациенту (Российскому государству) в 1,5—1,7 млн долларов США. Производители объясняют столь высокую стоимость цены отпускной продукции расходами, связанными с поисковыми генно-инженерными исследованиями, что на самом деле не соответствует действительности и представляет собой обычный маркетинговый ход.
К сожалению, в Российской Федерации не существует национального рынка продуктов и услуг предиктивной, превентивной и персонализированной медицины. Приказом Министерства здравоохранения РФ от 24 апреля 2018 года №186 «Об утверждении Концепции предиктивной, превентивной и персонализированной медицины» была презентирована концепция инновационного развития нашей страны в данном направлении и сообщено, что она согласована с основными положениями Стратегии научно-технологического развития Российской Федерации, утвержденной Указом Президента Российской Федерации от 1 декабря 2016 года №642 «О Стратегии научно-технологического развития Российской Федерации», государственной программы Российской Федерации «Развитие здравоохранения», утвержденной постановлением Правительства Российской Федерации от 26 декабря 2017 года №1640 «Об утверждении государственной программы Российской Федерации „Развитие здравоохранения“ и государственной программы Российской Федерации „Развитие фармацевтической и медицинской промышленности“ на 2013—2020 годы», утвержденной постановлением Правительства Российской Федерации от 15 апреля 2014 года №305 «Об утверждении государственной программы Российской Федерации „Развитие фармацевтической и медицинской промышленности“ на 2013—2020 годы», Стратегии развития медицинской науки в Российской Федерации на период до 2025 года, утвержденной распоряжением Правительства Российской Федерации от 28 декабря 2012 года №2580-р. Другими словами, Приказ Министерства здравоохранения России от 24 апреля 2018 года №186 официально легитимизировал работу в области предиктивной, превентивной и персонализированной медицины. Более того, в данном концептуальном руководящем документе Минздрава еще раз подчеркивается, что в Российской Федерации применение индивидуальных клеточных продуктов для персонализированной медицины, классифицируемых как аутологичные БМКП, регулируется Федеральным законом от 23 июня 2017 года №180-ФЗ «О биомедицинских клеточных продуктах», а обращение генотерапевтических лекарственных препаратов регулируется Федеральным законом от 12 апреля 2010 года №61-ФЗ «Об обращении лекарственных средств», что создает необходимую законодательную базу для обращения таких продуктов (препаратов) и условия для развития персонализированной медицины в части применения индивидуализированных продуктов для лечения заболеваний и коррекции состояний.
За пять лет реального существования данной Концепции предиктивной, превентивной и персонализированной медицины, утвержденной Минздравом России от 24 апреля 2018 года №186, за восемь лет действия Федерального закона от 23 июня 2017 года №180-ФЗ и более тринадцати лет наличия Федерального закона от 12 апреля 2010 года №61-ФЗ существенного прогресса в этой архиважной отрасли российского здравоохранения так и не получено. Наличие всех необходимых руководящих документов не позволило осуществиться технологическому прорыву в отечественной медицине. Так, в стране с 2016 года не зарегистрировано и не произведено ни одного БМКП и высокотехнологичного лекарственного средства для персонализированной медицины. К. А. Кошечкиным с соавт. (2021) была изучена доступность генотерапевтических препаратов в Российской Федерации на основании сведений о разрешении медицинского применения лекарственных средств этой группы. Были использованы данные литературных источников и сведения об этих препаратах, одобренных FDA, EMA и Минздравом России. В целом FDA было зарегистрировано 13 препаратов, или 46% от общего числа одобренных для медицинского применения в мире, два из них уже отозваны с рынка, а по двум проводятся дополнительные клинические исследования. В Европе EMA были одобрены для медицинского применения 16 препаратов (57%), четыре из них уже отозваны. Большинство препаратов сначала проходили одобрение FDA, а затем, в среднем через год, были разрешены на рынке Европы. Всего четыре препарата были одобрены на рынке Европы и на момент запроса данных не получили разрешения от FDA. Лишь один препарат, разрешенный в США, не имеет регистрации в Европе. В Российской Федерации разрешены два лекарственных генотерапевтических препарата: Neovasculgen (2011 год) и Spinraza (2019 год). Это 7% от общего числа всех генотерапевтических препаратов, присутствующих на мировом рынке, и при этом только один из них произведен в Российской Федерации. Таким образом, за 13 лет только один из отечественных генотерапевтических препаратов Neovasculgen российского производства ОАО «Институт стволовых клеток человека» произведен в России и представлен на рынке.
Причины отсутствия на российском рынке инновационных препаратов для предиктивной, превентивной и персонализированной медицины до безобразия банальны и просты: 1. Принимая Федеральный закон №180-ФЗ от 2016 года, авторы и разработчики Федерального закона «узаконили» производство, хранение и оборот БМКП под западные индустриальные стандарты, то есть производство продуктов предиктивной, превентивной и персонализированной медицины должно было соответствовать GMP- и GCP-стандартам Евросоюза и США, а не России. 2. Поскольку в стране вдруг не оказалось в реалиях ни одного такого GMP—производства, то появилась потребность написания целого свода необходимых подзаконных актов, поясняющих и разъясняющих положения новых российских стандартов производства, регламентируемых данным законом. 3. Высокотехнологичные лекарственные препараты (ВТЛП) были предложены в концепции развития здравоохранения стран ЕврАзЭС как реальная альтернатива «выхода из тупика» технологической невозможности многолетнего производства БМКП в России и с тем, чтобы снивелировать грубые методологические ошибки специалистов и разработчиков Федерального закона №180-ФЗ от 2016 года, которые исключили техническую возможность применения в клинике неманипулированных клеточных препаратов, не прошедших культивирование. Главной методологической ошибкой написания данного закона было то, что Министерство здравоохранения России поручило разработать и написать данный «медицинский закон» специалистам-биологам Института биологии развития РАН, которые по большей части отказались внести изменения и правки врачей-клиницистов в окончательную версию данного закона. Сегодня вообще нет полной ясности у разработчиков и будущих производителей продуктов и медицинских организаций, планирующих оказание медицинских услуг в области предиктивной, превентивной и персонализированной медицины, что же надо регистрировать – ВТЛП или БМКП. 4. Еще большая неясность с регистрацией генотерапевтических препаратов в Российской Федерации! Регистрация генотерапевтического препарата Neovasculgen в 2011 году стала возможна только благодаря мощнейшей лоббистской поддержке данной коммерческой организации Государственной корпорацией «РОСНАНО», так как это был ее проект. Сегодня возможность зарегистрировать ГТП в Российской Федерации большинству разработчиков и производителей представляется практически нереальной из-за необоснованных требований Минздрава к производителям данных продуктов. В стране быстрее будет зарегистрирован зарубежный БМКП или ГТП, чем препарат российских разработчиков. 5. Большая часть разработчиков за собственные средства провела весь комплекс доклинических исследований БМКП, но базы GMP-производства для получения в стране практически нет: только две организации сумели получить лицензии в Минздраве на производство БМКП, и они отказываются работать с другими разработчиками или неимоверно высоко поднимают цены на разработку технологических регламентов и необходимых технических документов для предоставления в Министерство здравоохранения России. 6. Организация клинических испытаний новых отечественных БМКП, ВТЛП и ГТЛП для предиктивной, превентивной и персонализированной медицины стоит не менее 300 млн рублей на один препарат при одной нозологии, которые найти разработчикам малых предприятий не под силу, кредитование под такие суммы у банков требует гарантий, которые большинство участников рынка предоставить не могут, а крупные фармацевтические компании, заинтересованные в наших продуктах и способные оплатить подобные расходы, ушли с нашего рынка на неопределенное время. Необходимо устранить все эти причины и обеспечить страну товарами, услугами и необходимым оборудованием для обеспечения потребностей персонализированной медицины.
Глава 2. Клональный гемопоэз – фундаментальная причина возникновения и прогрессирования большинства болезней цивилизации и старения
Что такое термин «гемопоэз», хорошо известно врачам и биологам. Гемопоэз (от др.-греч. αἷμα – кровь и ποίησις – выработка, образование, от ποιεῖν – творить), кроветворение – это процесс образования, развития и созревания клеток крови: лейкоцитов, эритроцитов, тромбоцитов у позвоночных («Википедия», 2024). Под этим термином также понимается весь комплекс органов и тканей системы кроветворения человека и млекопитающих. Классифицируют эмбриональный (внутриутробный) гемопоэз и постэмбриональный гемопоэз. Но в этой главе мы хотели бы обсудить проблему клонального гемопоэза, так как считаем его фундаментальной причиной возникновения и прогрессирования основных болезней цивилизации (БЦ) и главным элементом патогенеза этих болезней (Брюховецкий А. С., Шурдов М. А., 2023). Клональный гемопоэз (КГ) характеризуется наличием популяции клеток крови, происходящих из мутировавших мультипотентных стволовых клеток/клеток-предшественников, которые получили преимущество в аномальном росте (Cacic A. M., Schulz F. I., Germing U. et al., 2023). Это определение КГ, данное исследователями из Дрезденского университета, очень емкое и системное и отражает суть процесса. Как утверждают в журнале Blood в своем научном обзоре по клональному гемопоэзу G. A. Challen and М. A. Goodell (2022), недавнее открытие распространенности клонального кроветворения (КГ) изменило представление врачей-гематологов и онкологов о гемопоэтических стволовых клетках (ГСК). На протяжении десятилетий было признано, что у нас есть множество ГСК, большинство из которых являются излишними и даны нам про запас, на всякий случай. Как правило, ГСК находятся в состоянии покоя, редко делятся, но иногда активируются для дифференцировки. Оценки общего количества ГСК в костном мозге человека варьируются от ∼10 000 (Catlin S. N., Guttorp P., Abkowitz J. L., 2005; Xu J., Wang Y., Guttorp P., Abkowitz J. L., 2018) до ∼200 000 (Lee-Six H., Øbro N. F., Shepherd M. S. et al., 2018; Watson C. J., Papula A. L., Poon GYP et al., 2020). На протяжении всей жизни все соматические клетки непрерывно накапливают мутации, и ГСК не являются исключением, приобретая около 10 мутаций в год (1—2 на клеточное деление; рисунок 1) (Welch J. S., Ley T. J., Link D. C. et al., 2012). Таким образом, к зрелому возрасту (приблизительно 20 лет) большинство наших ГСК будут содержать две кодирующие мутации и 200 некодирующих мутаций (которые также могут влиять на функцию). Если у нас есть 100 000 ГСК, этот 20-летний ребенок накопит порядка 200 000 кодирующих мутаций в примерно 20 000 генов, разбросанных по всему пулу стволовых клеток, что делает все ГСК немного разными. Количество поражений на ген продолжает линейно увеличиваться с возрастом (Welch J. S., Ley T. J., Link D. C. et al., 2012).
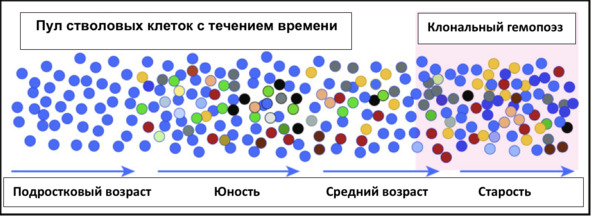
Рис. 1. Схема развития клонального гемопоэза (КГ). При рождении пул ГСК относительно однороден. Со временем соматические мутации
накапливаются со скоростью примерно 10 в год, так что все ГСК немного отличаются у юношества (ранних взрослых). Эти различия проявляются в недостатках и преимуществах для выживания и участия в производстве периферической крови, в результате чего некоторые ГСК «побеждают» с возрастом (эритроциты справа). В то время как расширенные клоны
могут быть обнаружены в среднем возрасте с помощью чувствительных методов секвенирования. В настоящее время принято определение, когда клон достигает доли 4% клеток, измеренных в периферической крови.
Это соответствует частоте вариантного аллеля (VAF) 2%, когда варианты
(мутации) являются гетерозиготными
(Цит. по: Challen G. A. and Goodell M. A., 2020)
Хотя точное количество ГСК у взрослых до сих пор неясно (Xu J., Wang Y., Guttorp P., Abkowitz J. L., 2018), каждый ген получит несколько «попаданий» в течение жизни (в зависимости от размера гена и состава кодонов) (Watson C. J., Papula A. L., Poon GYP et al., 2020), а общее количество кодирующих мутаций распространяется по всей стволовой клетке. Количество мутаций поразительно (потенциально порядка 1 млн к 70 годам). В обзоре S. Jaiswal (2020) показано, что количество мутаций к 70 годам составляет от 350 000 до 1,4 млн нуклеотидных замен.
Эти мутации делают каждую ГСК уникальным «бегуном» с немного отличающимися характеристиками, которые могут помочь или снизить его шансы на победу с течением времени. Считается, что КГ развивается с возрастом в течение очень длительного периода времени, аналогично марафонскому забегу. Подобные ассоциации пришли по поводу КГ к G. A. Challen and M. A. Goodell (2020), которые для иллюстрации и лучшего понимания проводят аналогию КГ на примере марафона. «В марафоне, который начинается с изначально хорошо подобранных бегунов, небольшое преимущество в выносливости может окупиться, в то время как бегун, который тратит большое количество энергии на ранней стадии, может не продержаться долго. Точно так же бегуны, получившие травмы, выбывают из игры. В долгой гонке в игру могут вступить многие второстепенные факторы, включая психологию, погоду и местность. Шанс всегда играет определенную роль, и, наконец, вероятность победы также зависит от количества соревнующихся бегунов». Сочетание общего количества накопленных мутаций в нашей большой продолжительности жизни и исходного размера пула ГСК объясняет неизбежность КГ, которую можно наблюдать с помощью глубокого секвенирования даже в относительно молодом возрасте (Young A. L., Challen G. A., Birmann B. M., Druley T. E., 2012). Хотя флуктуация активности клонов стволовых клеток была оценена давно, в целом вклад стволовых клеток в выработку крови считался довольно стабильным при отсутствии явных заболеваний, таких как лейкемия или недостаточность костного мозга. По сути, КГ является результатом конкуренции долгоживущих стволовых клеток (СК) в костном мозге (КМ). Когда мы экстраполируем эти концепции на КГ, мы задаемся вопросом: как стволовая клетка может «победить»?
G. A. Challen and М. A. Goodell (2022) основное внимание уделили предполагаемым механизмам, которые приводят к КГ, особенно в контексте биологии стволовых клеток, на основе нашего текущего понимания функции некоторых генов, связанных с КГ. Они убеждены, что главная роль в механизмах формирования КГ принадлежит приобретенным дополнительным соматическим мутациям генов. Большинство приобретенных мутаций не имеют значения, а многие даже вредны для функции ГСК, что приводит к их гибели. Редкие мутации, дающие какие-либо преимущества ГСК, со временем увеличат его вероятность доминирования над конкурентами; однако только определенные виды преимуществ со временем проявятся в виде более крупного «клона» ГСК (рисунок 2). Наиболее мощными мутациями будут те, которые приводят к повышенному самообновлению ГСК, создавая больше ГСК, а не сбалансированную дифференцировку. Действительно, в обзоре 150 генов, в котором изучалось влияние нокаута гена (KГ) у мышей, большинство оказывало вредное влияние на функцию ГСК, в то время как некоторые приводили к экспансии ГСК (Rossi L., Lin K. K., Boles N. C. et al., 2012). Интересно, что три из этих генов (DNMT3A, TET2 и Cbl), как позже было показано, периодически мутируют и формируют КГ. Поскольку требуется время для накопления достаточного количества мутаций, а затем для того, чтобы эти мутации показали биологическую экспансию у людей, КГ редко встречается в возрасте до 70 лет, если использовать классическое определение, когда пороговым значением является больше 2% клона VAF в крови. Эти пороги и их клиническая значимость обсуждаются далее в других главах монографии.
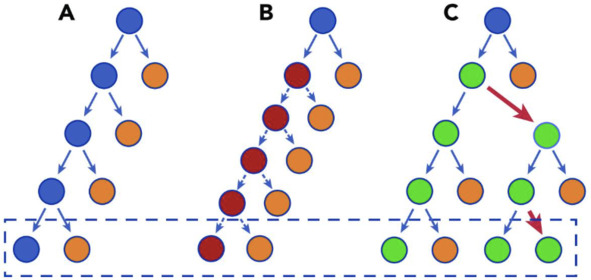
Рис. 2. Модель делений ГСК, которые могут привести к клональному
гемопоэзу. (А) Существует баланс между регенерацией стволовых клеток (синий) и дифференцированных клеток (оранжевый). Эта схема не обязательно подразумевает асимметричное деление, но изображает чистый
результат (пунктирная рамка). (В) Стволовая клетка делится быстрее, но каждое решение имеет тот же чистый результат, что и на панели А.
Следовательно, сеть после большого количества клеточных делений
не увеличивает пул стволовых клеток и не превосходит нормальные ГСК. (С) ГСК имеет небольшой уклон в сторону самообновления. Каждые несколько делений (красные стрелки) он создает дисбаланс, так что
со временем в результате образуется больше стволовых клеток.
Скорость, с которой это приводит к действительно предвзятым выводам, будет зависеть от частоты несбалансированных решений. Для большинства генов КГ это, вероятно, изначально очень тонкая предвзятость,
объясняющая очень долгий период времени, в течение которого КГ
становится очевидным (Цит. по: Challen G. A.and Goodell M. A., 2020)
Существует ограниченное количество генов, мутация которых увеличивает самообновление ГСК и проявляется в виде КГ (Рисунок 3). Необходимо было секвенировать достаточное количество людей преклонного возраста, чтобы исчерпывающе идентифицировать все потенциальные гены (Watson C. J., Papula A. L., Poon GYPet al., 2020), но основные игроки, безусловно, были идентифицированы.
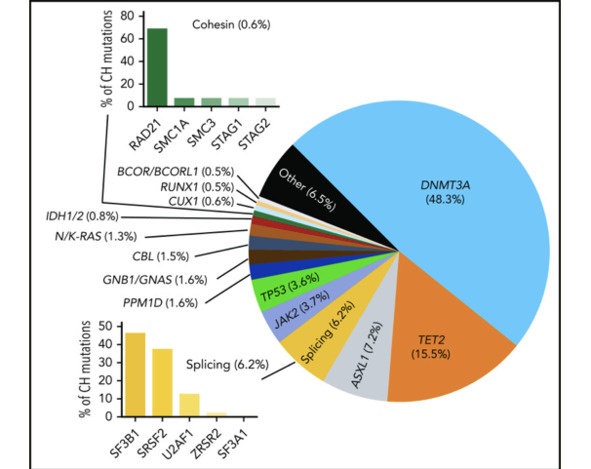
Рис. 3. Наиболее часто мутирующие гены клональности и доля
распространенных мутаций клонального гемопоэза (КГ) у людей, которые можно идентифицировать как драйвер. Они варьируются от исследования к исследованию, но указаны общие пропорции (Цит. по: Challen G. A. and Goodell M. A., 2020)
Типы генов, которые рекуррентно мутируют при КГ, в целом делятся на три основных класса: эпигенетические регуляторы, факторы сплайсинга и гены ответа на повреждение ДНК (DDR), с более редким вкладом членов cohesin, сигнальных молекул и гемопоэтических факторов транскрипции.
Мышиные модели оказались полезными, чтобы начать анализ роли, которую играют мутации в этих генах. Генетические манипуляции со многими из этих генов приводят к повышению приспособленности и самообновлению ГСК. В соответствии с концепцией, что небольшие преимущества важны в феномене, который развивается в течение десятилетий, преимущество, обеспечиваемое этими мутациями, часто неуловимо, что приводит к незначительным изменениям в молекулярной и клеточной функции, что затрудняет механистическое объяснение того, как эти мутации работают.

