
Полная версия
Персонализированная медицина нового поколения: клональная реконституция гемопоэза и CHIP-основанная
Обобщая вышеизложенные соображения, американские исследователи Grant A. Challen and Margaret A. Goodell (2020) пришли к выводу, что в контексте биологии стволовых клеток и на основе нашего текущего понимания функции некоторых генов, связанных с КГ, нужно понимать то, что, хотя большинство мутаций не оказывают никакого влияния, некоторые из них приводят к тонким функциональным различиям, которые в конечном итоге проявляются в различном поведении стволовых клеток. При большом пуле стволовых клеток и многих десятилетиях конкуренции некоторые из этих различий дают преимущества в определенных условиях. Примерно 20 генов периодически обнаруживаются как мутированные при КГ, что указывает на то, что они дают некоторое преимущество. Влияние этих мутаций начали анализировать на молекулярном уровне путем моделирования на клеточных линиях и на мышах. Мутации в эпигенетических регуляторах, таких как DNMT3A и TET2, дают преимущество, усиливая самообновление стволовых клеток и клеток-предшественников и ингибируя их дифференцировку. Мутации в других генах, участвующих в реакции на повреждение ДНК, могут просто повысить выживаемость клеток.
На рисунке 4 представлены основные стратегии победы, которые используют ГСК для доминирования над другими ГСК костного мозга в организме. Один из путей доминирования ГСК – это стратегия их самообновления, молекулярно-биологической основой которой являются мутации в гене DNMT3A. Другой подход к доминированию среди других клонов кроветворения носит название «стратегии выживания» и обусловлен мутациями в гене ТЕТ2.
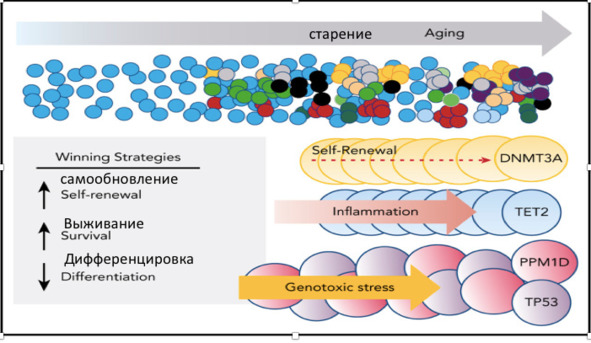
Рис. 4. Стратегии победы ГСК для формирования доминирования
определенных клонов кроветворных стволовых клеток
(Цит. по: Challen G. A. and M.A. Goodell М. А., 2020)
Наличие мутаций гена DNMT3A, кодирующего фермент ДНК-метилтрансферазу de novo, определяет ответственность за установление новых паттернов метилирования ДНК во время развития. Эти мутации свидетельствуют о нарушении принятия решений о судьбе стволовых клеток. Клетки крови, несущие мутации в гене DNMT3А, способны вызывать более сильный иммунный ответ как против нормальных тканей хозяина, так и против опухоли. Мутации в эпигенетических регуляторах, таких как DNMT3A и TET2, дают преимущество, усиливая самообновление стволовых клеток и клеток-предшественников и ингибируя их дифференцировку. Мутации в эпигенетических регуляторах доминируют в ландшафте КГ, при этом около 50% всех мутаций КГ являются вариантами DNMT3A. Большинство мутаций DNMT3A при КГ являются гетерозиготными и, вероятно, приводят к потере функции белка по разным механизмам. Мутации DNMT3A при КГ распространяются по всей длине гена, при этом миссенс-мутации группируются в известных структурных и функциональных доменах. Важно отметить, что спектр вариантов DNMT3A при КГ отличается от наблюдаемого в миелоидных новообразованиях, поскольку он заметно менее обогащен остатком горячей точки R882. Уровень активности DNMT3A, остающийся после мутации, фактически «дозировка» DNMT3A, будет коррелировать со скоростью размножения мутантных клонов. Клональный гемопоэз, ассоциированный с мутациями в этом гене, резко увеличивает риск сердечно-сосудистых заболеваний. Мутации TET2 в гемопоэтических стволовых клетках способствуют самообновлению ГСК, давая им конкурентное преимущество в плане экспансии по сравнению с другими клонами.
Другой подход к доминированию в кроветворении носит название «Стратегии выживания». Эта стратегия направлена на дифференцировку ГСК в результате генотоксического стресса. Эта стратегия обусловлена мутациями в гене ТР53. Соматические мутации в TP53 являются центральными эффекторами реакции на повреждение ДНК, вызванной незащищенными концами теломер. Они повышают вероятность того, что истощение теломер в популяции ГСК отбирает клетки с генетической способностью избегать путей старения без необходимости репарации лежащих в основе дефектов удлинения теломер. Соматические мутации ТР53 опосредуют миелоидную трансформацию при СШД. В исследовании SDS Registry наличие, количество и распространенность аллелей соматического гена TP53 и мутации в нем не были предикторами неминуемого риска лейкемии у пациентов с СШД. Вместо этого прогрессирование мутантных по TP53 клонов было опосредовано развитием биаллельных изменений в локусе TP53, делецией, потерей гетерозиготности с нейтральной копией или второй точечной мутацией. В функциональных экспериментах было показано, что инактивация TP53 повышает конкурентоспособность SBDS-дефицитных клеток за счет инактивации путей старения без коррекции лежащих в основе SDS рибосом и дефектов трансляции. В соответствии с этими генетическими наблюдениями человека потеря TP53 может разъединить рибосомный стресс, вызванный дефицитом SBDS, от активации путей клеточного старения, что приводит к частичному восстановлению фенотипа СШД. Инактивация TP53 ограничивает клеточные последствия неэффективности трансляции и дефектной длины теломер, соответственно указывая на то, что активация пути p53 ограничивает относительную приспособленность и опосредует устранение «неудачников». Таким образом, инактивация TP53 в одиночных клонах ГСК может превратить «проигравших» в «победителей», что согласуется с наблюдаемым рецидивом соматических мутаций TP53 при КГ и миелоидных новообразованиях, возникающих при SDS и нарушениях биологии теломер.
Революция в области анализа отдельных клеток выявила гетерогенность популяций определенных типов клеток, и все чаще признается, что клональная экспансия отдельных клеток лежит в основе ряда заболеваний, помимо рака, включая сосудистые патологии, цирроз и нейродегенерацию (Brunner et al., 2019; Chappell et al., 2016; Dobnikar et al., 2018; Jacobsen et al., 2017; Misra et al., 2018; Sheikh et al., 2015; Tay et al., 2017). Например, множественные предшественники гладкомышечных клеток (ГМК) дают начало нормальной артериальной стенке во время развития, но несколько избранных предшественников внутри стенки участвуют в формировании атеросклеротических бляшек (Chappell et al., 2016; Greif et al., 2012; Jacobsen et al.., 2017; Misra et al., 2018). Кроме того, при возрастном клональном кроветворении с неопределенным потенциалом (от англ. clonal haematopoiesis of indeterminate potential или сокращенно – CHIP) стволовые клетки, несущие соматические мутации, дают доминантные варианты лейкоцитов, а CHIP ассоциируется с повышенным риском серьезных заболеваний, связанных с атеросклерозом, инфарктом миокарда и ишемическим инсультом (Jaiswal S. and Libby, 2020; Jaswal S. et al., 2017).
Клональный гемопоэз неопределенного потенциала (CHIP) уже некоторое время привлекает внимание медицинского сообщества. Как утверждают A. M. Cacic, F. I. Schulz, U. Germing et al. (2023), этот феномен, обнаруженный около десяти лет назад, связывает возрастные изменения кроветворения не только с более поздним развитием гематологических злокачественных новообразований, но и с повышенным риском ранних сердечно-сосудистых заболеваний и некоторых других заболеваний. CHIP выявляется в крови и характеризуется клонально расширенными соматическими мутациями в генах, связанных с раком, предрасполагающих к развитию гематологических новообразований, таких как миелодиспластический синдром (МДС) и острый миелолейкоз (ОМЛ). Связанные с CHIP мутации часто затрагивают гены восстановления повреждений ДНК и нередко отмечаются после предшествующей цитотоксической терапии рака. Генетическая предрасположенность, по-видимому, является фактором, способствующим этому. Стало неожиданностью, что CHIP значительно повышает риск инфаркта миокарда и инсульта, а также способствует развитию сердечной недостаточности и легочной гипертензии.
Недавние исследования на людях указывают на подобное прогрессирующее накопление мутантных соматических клонов в эпителиальных клетках различных органов при нормальном старении (Martincorena et al., 2018; Martincorena et al., 2015; Moore et al., 2020; Yoshida et al., 2020). Исследования в основном были сосредоточены на автономных клеточных механизмах, лежащих в основе клональной экспансии, а неклеточная автономная регуляция недостаточно хорошо изучена, особенно при старении и возрастзависимых болезнях цивилизации. Примечательно, что недавнее неоднозначное биоинформатическое исследование ставит под сомнение точку зрения о том, что увеличение соматических мутаций с возрастом лежит в основе повышенной заболеваемости раком в более позднем возрасте, и вместо этого утверждает, что снижение иммунной системы имеет первостепенное значение (Palmer et al., 2018).
Y. Ran, Z. Gu, Y. Lyu et al. (2022) исследовали феномен неклеточной автономной регуляции клональности при старении, определяя роль старых гемопоэтических клеток в модулировании рекрутирования и клональной экспансии клеток-предшественников (КП) гладкомышечных клеток (ГМК) в атеросклеротической бляшке. Они показали, что воспалительные клетки, особенно макрофаги, и КП ГМК играют ключевую роль в атерогенезе. Редкие предшественники ГМК из средней оболочки вносят свой вклад в клетки, которые заселяют зарождающуюся бляшку и клонально расширяются, приводя к ∼30—70% клеточности развитой бляшки с клетками, формирующими защитный фиброзный колпачок или переходящими в дестабилизирующие судьбы бляшки (Basatemur et al., 2019; Chappell et al., 2016; Jacobsen et al., 2017; Misra et al., 2018; Shankman et al., 2015; Wirka et al., 2019). Интегрины представляют собой гетеродимерные белки, которые связывают внеклеточные и внутриклеточные компартменты, а трансплантат костного мозга (BM), лишенный гена, кодирующего интегрин β3 (Itgb3), у мышей с атеропронами, индуцирует множественные предшественники SMC для проникновения в бляшку и клонального расширения, усугубляя бремя болезни (Misra et al., 2018; Schneider et al., 2007). На фоне Apoe (-/-) макрофаги, происходящие из Itgb3 (-/-) КМ, имеют повышенные уровни цитокина фактора некроза опухоли (TNF) -α (Schneider et al., 2007). Уровни TNFα в плазме повышены у старых мышей и людей, а высокие уровни TNFα у пожилых людей коррелируют с атеросклерозом (Bauernfeind et al., 2016; Bruunsgaard et al., 2000). Важно отметить, что трансплантация КМ (ТКМ) от старых мышей молодым мышам усугубляет атеросклероз (Du et al., 2016), но основные механизмы и эффекты на рекрутирование и клональность SMC не определены.
При CHIP клонально расширенные гемопоэтические стволовые клетки обычно содержат соматические мутации в эпигенетических регуляторах, таких как Ten Eleven Translocation (TET) – 2 (Jaiswal and Libby, 2020; Jaiswal et al., 2017). На нулевом фоне рецептора липопротеинов низкой плотности (Ldlr) КМ с дефицитом TET2 предрасполагает мышей к развитию атеросклероза, вызванного усиленной западной диетой, а макрофаги, выделенные от мышей TET2 (-/-), экспрессируют повышенные уровни цитокинов, включая TNFα. (Fuster et al., 2017; Jaiswal et al., 2017). Макрофаги, привлеченные к ранним атеросклеротическим бляшкам, локально пролиферируют во время прогрессирования заболевания (Robbins et al., 2013), а у мышей с атеропрозом инициация БВ у пожилых людей по сравнению с молодыми увеличивает накопление макрофагов в аорте (Du et al., 2016). Важно отметить, что в контексте CHIP у людей, или у старых мышей, или мышей с дефицитом миелоидных клеток TET2 клональность миелоидных клеток в самих атеросклеротических бляшках неуловима. Подобно старению, влияние дефицита КМ TET2 на клональность ГМК в бляшке не определено.
Показано, что возраст КM является ключевым фактором, определяющим клональность клеток, происходящих из ГМК, в атеросклеротической бляшке: состарившийся неклеточный КМ автономно индуцирует рекрутирование и экспансию множества предшественников ГМК. Механически сниженные уровни TET2 в старых моноцитах/макрофагах эпигенетически снижают экспрессию гена Itgb3, что усиливает передачу сигналов TNFα-TNF рецептора 1 (TNFR1). Таким образом, возникает поликлональность линии ГМК и более выраженный атеросклероз (Ran Y., Gu Z., Lyu Y. et al., 2022).
Но вопрос о том, что же является мотором и главным двигателем патогенеза и прогрессирования болезней цивилизации (БЦ) и постоянно поддерживает эту «неустойчивость генома» высокоспециализированных клеток организма при наличии или отсутствии генетического дефекта в их геноме и почему приводит к закономерному исходу болезни, очень долго оставался открытым. На основании почти 35-летнего опыта применения различных типов клеточной терапии у человека мы пришли к выводу, что таким молекулярно-биологическим двигателем является клональный гематопоэз, обусловленный геномным и постгеномным повреждением аутологичных гемопоэтических стволовых клеток (ГСК) и гемопоэтических клеток-предшественников (ГКП) костного мозга. ГСК и ГПК – главные системообразующие и главные регуляторные клеточные системы крови и родоначальники всех иммунокомпетентных клеток иммунной системы организма млекопитающих и человека! Именно ГСК и ГПК формируют системообразующие иммунноспецифические (иммунотолерантные или иммуноагрессивные) реакции организма человека и животных на клетки с неустойчивым геномом и определяют их судьбу. Это показано новыми знаниями о том, что ГСК и ГКП, с одной стороны, являются самыми медленными клетками в организме (их клеточный цикл от 22 до 50 недель или почти 360 дней) и формируют все иммунные реакции и иммунную память в организме (Seiweke М. et al., 2021). С другой стороны, кроме функций репродукции клеток крови и иммунокомпетентных клеток крови, а также формирования иммунных реакций, они являются главными регуляторными и управляющими системами организма всех млекопитающих. Под их управлением и в подсистемах к ним находятся все 230 известных типов клеток организма человека (Alberts B., Johnson A., Lewis J. еt al., 2007). Изменение геномной и протеомной структуры ГСК и ГПК, как самых длительно живущих клеток в организме, происходит в результате накопления в них драматических дополнительных соматических мутаций (ДСМ). В результате формируются и постепенно расширяются патологические клоны ГСК и ГКП и их потомки начинают доминировать в гемопоэзе и циркуляторном русле (Jaiswal S., Ebert B. L., 2019; Mitchell E., Chapman M. S., Williams N. et al., 2022).
Как отмечает в своем научном обзоре S. Jaiswal (2020), революция в области анализа отдельных клеток выявила гетерогенность популяций определенных типов клеток, и сегодня признается, что клональная экспансия отдельных клеток лежит в основе этиопатогенеза ряда таких заболеваний, как рак, сосудистые заболевания, цирроз и нейродегенерации (Brunner et al., 2019; Chappell et al., 2016; Dobnikar et al., 2018; Jacobsen et al., 2017; Misra et al., 2018; Sheikh et al., 2015; Tay et al., 2017). Парадокс заключается в том, что, например, множественные предшественники гладкомышечных клеток дают начало нормальной артериальной стенке во время развития, но несколько избранных предшественников внутри стенки участвуют в формировании атеросклеротических бляшек (Chappell et al., 2016; Greif et al., 2012; Jacobsen et al. 2017; Misra et al., 2018). Кроме того, при возрастном клональном кроветворении стволовые клетки, несущие соматические мутации, дают доминантные варианты лейкоцитов, а появление патоспецифических клонов связано с повышенным риском серьезных заболеваний, асоциированных с атеросклерозом, инфарктом миокарда и ишемическим инсультом (Jaiswal S. & Lybbi, 2020; Jaiswal S. et al., 2017). Недавние исследования на людях указывают на подобное прогрессирующее накопление мутантных соматических клонов в эпителиальных клетках различных органов, что характерно и для нормального старения (Martincorena et al., 2018; Martincorena et al., 2015; Moore et al., 2020; Yoshida et al., 2020). Показано, что ДСМ со временем накапливаются во всех клетках (Welch J. S., Ley T. J., Link D. C. et al., 2012; Alexandrov L. B., Jones P. H., Wedge D. C. et al., 2015; Martincorena I., Campbell P. J., 2015; Blokzijl F., de Ligt J., Jager M. et al., 2016; Hoang M. L., Kinde I., Tomasetti C. et al., 2016). Эти ДСМ чаще всего представляют собой замены оснований (известные как однонуклеотидные варианты), небольшие вставки, или делеции (indels), или изменения числа копий больших хромосомных областей (известные как структурные варианты). По оценкам, ГСК приобретают примерно 20 соматических мутаций в год во всем геноме (Lee-Six H., Øbro N. F., Shepherd M. S. et al., 2018; Osorio F. G., Rosendahl Huber A., Oka R. et al., 2018) и примерно 0,1 мутации в год в экзонах, кодирующих белок (Welch J. S., Ley T. J., Link D. C. et al., 2012), подавляющее большинство из которых являются однонуклеотидными вариантами. В костном мозге только долгоживущие ГСК обладают способностью к самообновлению на протяжении всей жизни организма (Reya T., Morrison S. J., Clarke M. F., Weissman I. L., 2001). Поэтому в большинстве случаев только мутации, возникающие в ГСК, сохраняются на протяжении всей жизни человека. Учитывая, что на человека приходится от ∼50 000 до ∼200 000 ГСК, считается, что к 70 годам у людей насчитывается от 350 000 до 1 400 000 кодирующих мутаций в пуле ГСК. Если хотя бы одна из этих мутаций способна обеспечить селективное преимущество в отношении ГСК, в котором она возникает, клональная экспансия в крови должна быть обычным явлением при старении (Jaiswal S., Ebert B. L., 2019). Действительно, это явление, называемое клональным гематопоэзом, тесно связано со старением и показано в нескольких исследованиях лиц, не отобранных для исследования гематологических нарушений (Xie M., Lu C., Wang J. et al., 2014; Genovese G., Kähler A. K., Handsaker R. E. et al., 2014; Jaiswal S., Fontanillas P., Flannick J. et al., 2014; McKerrell T., Park N., Moreno T. et al., 2015; Buscarlet M., Provost S., Zada Y. F. et al., 2017; Acuna-Hidalgo R., Sengul H., Steehouwer M. et al., 2017; Coombs C. C., Zehir A., Devlin S. M. et al., 2017).
По мнению S. Jaiswal (2020), в большинстве исследований мутации, используемые для определения клонального кроветворения, аналогичны мутациям, обнаруживаемым при гематологическом раке (Jaiswal S., Fontanillas P., Flannick J. et al., 2014; Coombs C. C., Zehir A., Devlin S. M. et al., 2017). Наиболее часто мутирующие гены в клональном кроветворении включают DNMT3A, TET2, ASXL1, JAK2, TP53 и SF3B1, которые также часто мутируют при остром миелоидном лейкозе (Ley T. J., Miller C., Ding L. et al., 2013; Lindsley R. C., Mar B.G., Mazzola E. et al., 2015), миелодиспластическом синдроме (МДС) (Bejar R., Stevenson K., Abdel-Wahab O. et al., 2011; Papaemmanuil E., Gerstung M., Malcovati L. et al., 2013) и миелопролиферативных новообразованиях (МПН) (Nangalia J., Massie C. E., Baxter E. J. et al., 2013). Следовательно, неудивительно, что у людей с клональным гематопоэзом эти виды рака развиваются с большей скоростью, чем у людей без мутаций (Genovese G., Kähler A. K., Handsaker R. E. et al., 2014; Abelson S., Collord G., Ng S. W. K. et al., 2018; Jaiswal S., Fontanillas P., Flannick J. et al., 2014; Desai P., Mencia-Trinchant N., Savenkov O. et al., 2018; Bolton K. L., Ptashkin R. N., Gao T. et al., 2019). Однако мутации, вызывающие клональное кроветворение, также могут быть обнаружены в циркулирующих иммунных клетках, таких как гранулоциты, моноциты и лимфоциты. Это открытие повышает вероятность того, что клональное кроветворение может привести к измененным иммунным ответам, которые потенциально могут влиять на многие болезни старения (Mitchell E., Chapman M. S., Williams N. et al., 2022).
Клональное кроветворение относится к любому состоянию клональной экспансии в кроветворной системе. Рак крови, такой как хронический миелоидный лейкоз или МДС, является типичным примером клонального кроветворения. Однако те же самые мутации, обнаруженные при этих видах рака, также наблюдаются у значительной части здорового пожилого населения. Чтобы отличить наличие этих мутаций в незлокачественных условиях от злокачественного клонального кроветворения, был введен термин «клональный гематопоэз с неопределенным потенциалом» (CHIP) (Steensma D. P., Bejar R., Jaiswal S. et al., 2015). CHIP определяется наличием связанной с раком соматической мутации в крови или костном мозге у лиц без известных гематологических раковых заболеваний или других клональных состояний, таких как моноклональная гаммапатия.
По мнению S. Jaiswal (2020), еще одним аспектом определения CHIP является нижняя граница размера клона. Во всех исследованиях клонального кроветворения на сегодняшний день распределение размеров клонов правостороннее, то есть людей с меньшими клонами намного больше, чем с большими клонами. В своем логическом расширении это наблюдение предсказывает, что очень маленькие клоны должны присутствовать почти у всех людей, что впоследствии было продемонстрировано экспериментально (Young A. L., Challen G. A., Birmann B. M., Druley T. E., 2016; Razavi P., Li B. T., Brown D. N. et al., 2019).
Если эти очень маленькие клоны присутствуют почти у всех, то уже нет значимого различия быть носителем клонального кроветворения. Из-за этого факта S. Jaiswal (2020) было предположено, что CHIP должен присутствовать при фракции вариантных аллелей (VAF)> 0,02 (это означает, что> 2% секвенированных аллелей несут мутацию, что соответствует ~ 4% клеток для гетерозиготных мутаций). Некоторые комментарии предполагают, что CHIP является «техническим» определением, поскольку этот предел приблизительно соответствует уровню обнаружения при секвенировании всего экзома. S. Jaiswal (2020) предпочитает думать о CHIP как о разумном рабочем определении: учитывая вышеупомянутые результаты очень маленьких клонов у большинства людей, пороговое значение VAF является требованием для практического дизайна исследований.
В частности, клональный гемопоэз неопределенного потенциала (CHIP), как это определено в новой классификации гематолимфоидных опухолей ВОЗ, относится к CH (КГ) с соматическими мутациями в генах, связанных со злокачественными миелоидными новообразованиями, обнаруженными в крови или костном мозге с частотой вариантного аллеля (VAF) ≥2% у лиц без диагностированных гематологических нарушений или необъяснимой цитопении (Steensma D. P, Bejar R., Jaiswal S. et al., 2015; Khoury J. D., Solary E., Abla O. et al., 2022; Arber D. A., Orazi A., Hasserjian R. P. et al., 2022). Следует подчеркнуть, что ЧИП еще не является заболеванием, поскольку принятое определение исключает стойкую (≥4 мес.) цитопению и явную патологию, связанную с соматическим поражением (Valent P., Orazi A., Steensma D. P. et al., 2017; Arber D. A., Orazi A., Hasserjian R. P. et al., 2022). Используя ВАФ ≥2% в качестве порогового значения, до 20% людей старше 70 лет имеют обнаруживаемый КГ (Jaiswal S., Fontanillas P., Flannick J. et al., 2014; Genovese G., Kähler A. K., Handsaker R. E. et al., 2014; Xie M., Xie M., Lu C. et al., 2014). Немецкие исследователи установили, что, учитывая демографию в Германии, по оценкам, пострадало 2,75 млн человек (Heuser M., Thol F., Ganser A. et al., 2016). Что касается отдельного человека с клональным гемопоэзом (КГ), сообщалось о внутрииндивидуальной гетерогенности, при этом наблюдались различия между пораженными клеточными линиями, тканевыми компартментами (периферическая кровь по сравнению с костным мозгом) и анатомическими местоположениями (Hartmann L., Hecker J. S., Rothenberg-Thurley M. et al., 2022).
Мутации CHIP могут возникать как в миелоидной линии (известной как M-CHIP), так и в лимфоидной линии (известной как L-CHIP) кроветворной системы (Niroula A., Sekar A., Murakami M. A. et al., 2021). Мутации как миелоидных, так и лимфоидных соматических генов, а также миелоидные и лимфоидные мозаичные хромосомные изменения (mCA) связаны с риском развития гематологических злокачественных новообразований, специфичных для данной линии (Niroula A,. Sekar A., Murakami M. A. et al., 2021). В случае M-CHIP большинство мутаций обнаружено в трех генах, а именно DNMT3A, TET2 и ASXL1 (Niroula A., Sekar A., Murakami M. A. et al., 2021). Соматические мутации при миелоидно-ориентированном КГ коррелируют с повышенным риском миелоидных злокачественных новообразований, сердечно-сосудистых заболеваний (ССЗ) и смертности от всех причин (Von Beck K., Von Beck T., Ferrell P. B. et al., 2023). L-CHIP, по-видимому, распределяется более равномерно по большему числу генов, что напоминает распределение вариантов в остальных генах M-CHIP (Niroula A., Sekar A., Murakami M. A. et al., 2021). Соматические мутации при лимфоидно-обусловленном CH связаны с развитием лимфоидных злокачественных новообразований и поздними проявлениями аутоиммунитета и иммунодефицита (Von Beck K., Von Beck T., Ferrell P. B. et al., 2023).
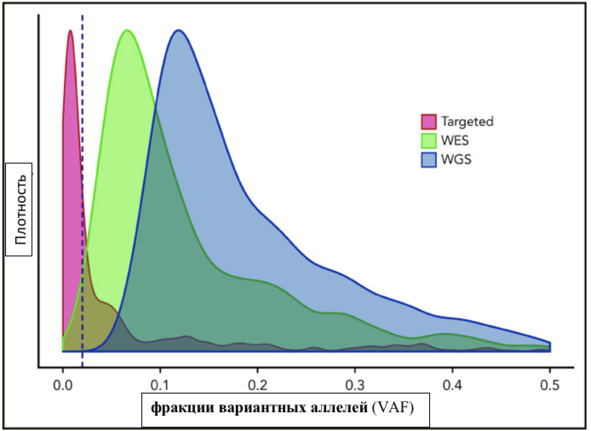
Рис. 5. Графики масштабированной плотности для вариантов аллельных фракций (VAF) мутаций, связанных с CHIP (цит. по: Abelson S., Collord G., Ng S. W. K. et al., 2018). WES-данные секвенирования всего экзома (цит. по: Jaiswal S., Fontanillas P., Flannick J. et al., 2014), WGS-данные секвенирования всего генома (цит. по: Bick A. G., Weinstock J. S., Nandakumar S. K. et al., 2019). Пунктирная красная линия нарисована на фракции вариантного

