
Полная версия
Летом 2012 г. группы Шарпантье и Дудны продемонстрировали, что они могут взять бактериальную систему CRISPR и с некоторыми изящными молекулярными доработками превратить ее в точно настраиваемый генетический «курсор», который можно использовать для отрезания конкретного участка ДНК большей или меньшей длины. Родольф Баррангу, главный редактор The CRISPR Journal, называет это исследование переломным моментом, который показал, что «эту крутую, своеобразную революционную иммунную систему бактерий можно перепрофилировать и превратить в инструмент, который люди будут легко использовать в лаборатории для разрезания ДНК»[62]. Через полгода группа Чжана в сотрудничестве с Лучано Марраффини из Университета Рокфеллера и независимой группой Джорджа Чёрча продемонстрировала, что инструмент CRISPR-Cas9 может успешно редактировать ДНК в клетках млекопитающих. «Это изменило мир», – говорит Баррангу.
Действительно, исследователи всего мира воспользовались этим простым программируемым инструментом редактирования генов и сделали новые открытия, которые попали на страницы ведущих научных и медицинских журналов. Профессор права Стэнфордского университета Хэнк Грили проводит удачную аналогию: «Модель T[63] была дешевой и надежной, и вскоре уже у всех появилась машина, и мир изменился. CRISPR сделал редактирование генов недорогим, простым и доступным… Думаю, это также изменит мир, – говорит он. – И это меня поражает»[64].
Между двумя футбольными клубами Буэнос-Айреса – «Ривер Плейтом» и «Бока Хуниорсом» – идет, как известно, вечное непримиримое соперничество. Однако существует противоборство, которое формировало жизнь на Земле с самого начала, и оно продолжается по сей день. Основная гонка вооружений на планете происходит между двумя непримиримыми врагами, ядерными сверхдержавами микробиологического мира – бактериями и вирусами (или бактериофагами), стремящимися уничтожить друг друга. Эта война длится вечность, по крайней мере не меньше миллиарда лет.
Еще до пандемии COVID-19 мы знали, что вирусы – это невидимая опасность, предвестники болезней и смертей. В своем известном высказывании лауреат Нобелевской премии Джошуа Ледерберг утверждал, что «самая серьезная угроза дальнейшему господству человека на планете – это вирусы». Помимо социального дистанцирования и некоторого естественного иммунитета, у человечества в арсенале мер противодействия имеются также вакцинация и множество специализированных или перепрофилированных методов лечения, а кроме того – препаратов. Угроза никогда не исчезнет, поскольку вирусы способны мутировать, развиваться, захватывать генетический материал своих хозяев и постоянно перерождаться.
Бактерии хорошо нас понимают. Они постоянно сталкиваются с атаками со стороны бактериофагов – вирусов, которые заражают исключительно бактерии. На планете Земля существует непостижимое количество бактериофагов (10 нониллионов (10-10)!), то есть по одному триллиону на каждую песчинку[65]. «Не спрашивайте меня, как люди получают это число, но я им верю», – говорит Марраффини[66]. Если расположить эти субмикроскопические фаги вплотную друг к другу, эта цепочка растянется на 200 млн световых лет[67]. Под электронным микроскопом многие из них выглядят довольно угрожающе, напоминая нечто среднее между лунным посадочным модулем и пауком, лапы которого растопырены, чтобы зацепиться за поверхность клетки. Другие обладают невинным очарованием круглого леденца на палочке с длинным хвостом. После присоединения вирус вводит в бактериальную клетку свой собственный генетический материал, короткую цепочку ДНК или ее двоюродную химическую сестру, РНК, используя механизмы синтеза белка бактериальной клетки. За 20–30 минут десятки и сотни заново скомпонованных вирусных потомков вырываются из уже погибшей клетки, подобно полчищу Чужих, вырвавшихся из живота Джона Хёрта. «Клетки взрываются, они лопаются, как воздушные шары», – говорит Марраффини.
Окруженные потенциальными фаговыми захватчиками, бактерии развили множество защитных систем, чтобы отслеживать и уничтожать эту угрозу. Когда я изучал биохимию в 1980-х гг., нам рассказывали, что бактерии обладают целой армией нуклеаз – высокоактивных ферментов, которые распознают и атакуют определенные мотивы чужеродной ДНК. (Последовательности ДНК самих бактерий защищены от этих нуклеаз химическими метками, подобно тому как розетки закрыты от детей специальными крышками). Ученые использовали эти ферменты ограничения как средство для разрезания, обмена или «сшивания» (лигирования) фрагментов ДНК, например помещая гены человека в ДНК бактерии, что положило начало развитию отрасли биотехнологии. Но, как мы убедимся далее, теперь мы знаем, что бактерии обладают еще и другой иммунной системой. CRISPR – это небольшой участок бактериального генома, который содержит фрагменты захваченного вирусного генома для дальнейшего использования, причем каждый такой фрагмент (или спейсер) отделен от другого одинаковыми повторяющимися палиндромными последовательностями ДНК. Представьте себе это как картотеку ФБР, в которой хранятся данные о разыскиваемых преступниках.
CRISPR – это больше, чем просто хранилище вирусных злодеяний. Совсем рядом находится арсенал мощной системы противоракетной обороны «земля – воздух». Когда клетка обнаруживает вторгшийся вирус, первым делом активируется система CRISPR, производящая копии РНК заархивированных вирусных последовательностей. Эта цепочка РНК затем разрезается на отдельные фрагменты, каждый из которых соответствует тому или иному вирусу и служит в качестве наброска внешности возможного преступника, сделанного полицейским художником. Сама по себе РНК не может причинить никакого вреда, поэтому она превращается в оружие путем связывания с ферментом, расщепляющим ДНК, называемым Cas (от англ. CRISPR-associated sequence – «последовательность, связанная с CRISPR»), образуя рибонуклеопротеиновый комплекс, оснащенный сигналом GPS и готовый к бою.
В микроскопической вселенной существует полдюжины разновидностей или типов систем CRISPR, которые делятся на два класса в зависимости от их строения и свойств[68]. Одна из простейших структур – тип II – содержит фермент Cas9. Эта нуклеаза, подобно кусачкам для проводов, добивается полноценного разрыва обеих цепей ДНК, но делает это избирательно. Она захватывает крРНК и держит ее как фотоснимок преступника – и ищет совпадения в вирусной ДНК. При обнаружении необходимого участка Cas9 и крРНК «защелкиваются» на ДНК и разрезают ее, нейтрализуя угрозу. «Cas9 поистине творит чудеса, – объясняет Урнов. – Когда она охраняет внутриклеточное пространство от вторжений, она буквально носит с собой копию объявления о разыскиваемом преступнике, спрашивая каждого: "Извините, ведь вы – точная копия разыскиваемого преступника, не правда ли? Тогда я вас порежу"»[69].
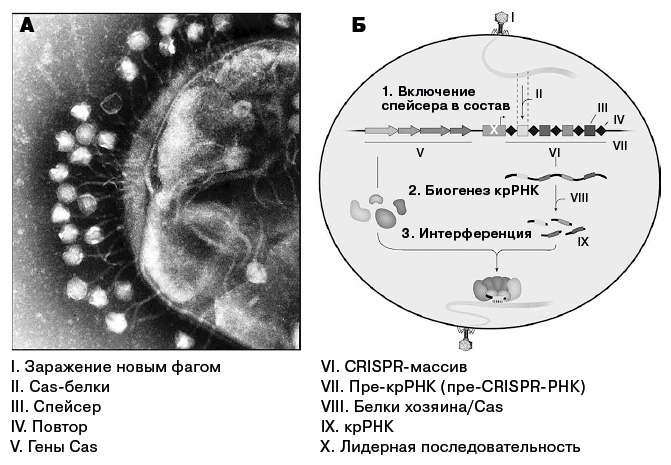
Фаги и каскад реакций CRISPR. (А) Замечен в момент совершения преступления: фаги садятся на поверхность клетки E. coli (кишечной палочки), чтобы совершить нападение. (Б) CRISPR-Cas-иммунитет. 1. Бактерия захватывает фрагменты вирусной ДНК и включает эти фрагменты как спейсеры в расширяющийся блок последовательностей CRISPR. 2. Для борьбы с фаговой инфекцией массив CRISPR транскрибируется в РНК, которая называется (пре-крРНК), а затем преобразуется в зрелые крРНК. 3. На стадии противодействия крРНК и Cas белок(и) образуют комплекс, который разрушает распознанные фаговые последовательности. Некоторые системы CRISPR (класс 1) содержат несколько белков Cas (как показано на рисунке), в то время как более простой системе класса 2 требуется одна нуклеаза – Cas9 (по материалам пункта 15 примечаний)
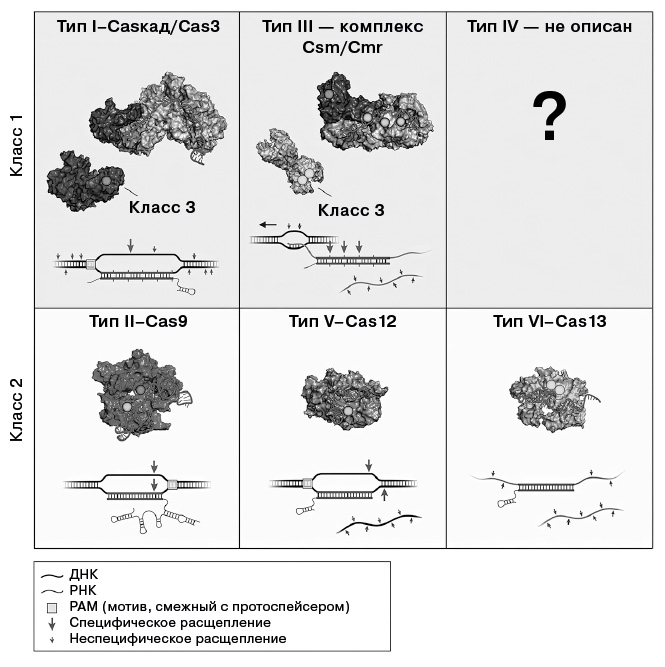
Описанные системы CRISPR. Существует несколько разновидностей систем CRISPR, которые делятся на два класса – класс 1 и класс 2. В классе 1 расщепление ДНК осуществляется комплексом белков, иногда называемых каскадом от слова Cas. В классе 2 системы CRISPR содержат одну нуклеазу Cas, такую как Cas9, Cas12 или Cas13. (Подробнее см. пункт 15 примечаний.)
Марраффини показывает, как две бактериальные системы защиты дополняют друг друга. Рестриктазы создают первый барьер защиты от вирусной угрозы, дробя вирусную ДНК на части, которые могут быть включены в массив CRISPR. Однако, если фаги, когда-либо эволюционировавшие, уклоняются от первой линии защиты, срабатывает иммунизация CRISPR. «Это аналогично вакцинации, – говорит Марраффини. – Когда ДНК фагов мертва, CRISPR может собрать спейсеры для формирования иммунитета у бактерии». Лишь немногие инфицированные вирусом бактерии действительно приобретают спейсеры – примерно 1 на 1 млн, но это дает одной клетке возможность устранить вирусную угрозу и восстановить популяцию[70].
В документальном фильме Адама Болта «Природа человека» (Human Nature, 2019) мы знакомимся с Дэвидом Санчесом, очаровательным мальчиком, страдающим от серповидноклеточной анемии. Узнав о возможностях CRISPR в лечении его болезни, он проницательно спрашивает: «Как эта штука работает и откуда она знает, как воздействовать на нужный ген, а не на тот, что отвечает за рост волос?»
Гениальность революции CRISPR заключалась в том, чтобы привязать Cas9 не к вирусной РНК, как в природе, а к синтетически разработанной РНК, запрограммированной исследователями, которая позволяет им воздействовать практически на любую последовательность ДНК любого гена любого организма. В результате у нас в руках оказался бактериальный фермент, существующий миллиард лет, и мы перепрофилировали его в молекулярный скальпель точной генной хирургии XXI в. Независимо от того, чей геном мы хотим отредактировать: хомяка или человека, комара или мыши, красной смородины или красного дерева, – процесс остается по сути одним и тем же. Это связано с тем, что все организмы в природе используют один и тот же универсальный код ДНК, состоящий из одного и того же четырехбуквенного алфавита.
В своем естественном состоянии Cas9 не интересуется ДНК, в основном случайно сталкиваясь и отскакивая от нее. Но как только Cas9, имеющая форму ладони, захватывает направляющую РНК, точная реконфигурация структуры белка заставляет ее взаимодействовать с ДНК в поисках подходящей мишени. По словам Блейка Виденхефта, профессора Университета штата Монтана, белковые комплексы Cas «патрулируют все внутриклеточное пространство, находят чужеродную [вирусную] ДНК, связываются с ней и приговаривают ее к уничтожению в считаные минуты… это довольно впечатляющий процесс»[71].
Поиск и связывание с целевой последовательностью происходят в два этапа. Прежде всего Cas9 ищет короткий мотив ДНК, называемый последовательностью PAM[72], – маяк, который дает ферменту сигнал для кратковременного связывания с ДНК, и взаимодействует с ним. «Это мимолетное взаимодействие приводит к искривлению ДНК», – объясняет Виденхефт. Изгибая ДНК, Cas9 расцепляет нити двойной спирали, чтобы направляющая РНК могла проскользнуть в образовавшуюся щель (создавая так называемую R-петлю)[73]. Направляющая РНК быстро сверяет последовательность с текстом целевой ДНК. Если будет найдено идеальное совпадение среди всех двадцати оснований (букв текста), то ДНК-последовательность будет уничтожена. Cas9 рассекает[74] обе нити ДНК так же ровно, как кухонный нож, создавая двухцепочечный разрыв (DSB, double-strand break) всего в нескольких основаниях от последовательности PAM[75].
Этот удивительный процесс был потрясающе снят на видео исследователями Токийского университета Хироси Нисимасу и Осаму Нуреки в 2017 г. Используя метод, называемый высокоскоростной атомно-силовой микроскопией, они смогли увеличить изображение в тот самый момент, когда Cas9 захватывала молекулу ДНК. В фильме Cas9 выглядит как позолоченный камень, когда она останавливается на несколько секунд на нити ДНК, прежде чем разрубить ее пополам[76]. После того как Нисимасу выложил это видео в своем аккаунте Twitter, оно стало вирусным и было показано по японскому телевидению.
Однако сориентировать Cas9, чтобы она искала конкретную уникальную последовательность в геноме человека, – это в миллионы раз сложнее, чем разрезать вирусную ДНК. Когда комплекс Cas9 входит в чужеродное пространство клеточного ядра, она сталкивается с лабиринтом ДНК – двадцатью тремя парами хромосом, шестью миллиардами букв ДНК (сравним со стандартным геномом фага, состоящим всего из нескольких тысяч оснований). Попадая в ядро, каждая молекула Cas9 обыскивает плотно упакованные спирали ДНК, чтобы найти последовательности PAM, которые встречаются в среднем один раз за каждый полный оборот двойной спирали на 360 градусов, то есть на 10 нуклеотидов. В целом фермент должен «опросить» 300–400 млн оснований, чтобы определить точную мишень для направляющей РНК, которая сама состоит почти из 20 нуклеотидов.
Йохан Эльф, биофизик из Уппсальского университета в Швеции, подсчитал, что Cas9 обычно требуется около шести часов для обнаружения каждой последовательности PAM в бактериальном геноме с остановками на двадцать миллисекунд на каждом предполагаемом участке, чтобы заглянуть в двойную спираль и проверить, действительно ли он нашел правильную мишень[77]. Но упаковка ДНК в ядре эукариотической клетки намного сложнее, чем у бактерий. Во время лекций, проводимых для студентов в Эдинбургском университете, Эндрю Вуд показывает схему строения бактериальной клетки рядом с извилистым петляющим волокном ДНК млекопитающих. «Cas9 не создана для того, чтобы работать в той среде, в которую мы сейчас ее поместили, – говорит он. – Поразительно, что она способна рассмотреть сотни миллионов нуклеотидов за считаные часы»[78].
После того как Cas9 разрезал ДНК, репаративные ферменты ДНК клетки «зашивают» разрыв. Эксперты удивляются тому, как успешно это работает[79]. Cas9 превосходит даже ранее разработанные технологии редактирования генов ZFN и TALEN[80]. «Они были созданы, чтобы работать с эукариотической ДНК, но тем не менее, по всей видимости, Cas9 превосходит их», – говорит Вуд.
Давайте сделаем паузу и отметим решающую роль, которую играет в этом процессе последовательность PAM: поиск коротких фрагментов PAM вместо распаковки и проверки практически всего генома значительно упрощает задачу для Cas9 по фиксации целевой последовательности. Наличие PAM также объясняет то, что Cas9 не разрезает случайным образом повторы в последовательности CRISPR бактериальной ДНК. Это связано с тем, что, когда последовательности ДНК изначально добавляются к участку CRISPR в геноме бактерий, последовательности PAM отсекаются. Генные инженеры не хотят ограничиваться природным набором последовательностей PAM, поэтому модифицируют исходные ферменты Cas9 и Cas других видов бактерий, чтобы расширить их предпочтения в распознавании короткой последовательности PAM.
Если у бактерий настолько эффективна система безопасности, было бы резонно задаться вопросом: почему вирусы не вымерли? Вирусы незаметно развили множество обходных механизмов – группу белков, которые способны нейтрализовать нуклеазы Cas, известные как белки анти-CRISPR. Вирусы и бактерии подобны хищникам и их жертвам, вовлеченным в бесконечную борьбу, которая продолжается сотни миллионов лет[81]. CRISPR обнаружен в 46 % бактериальных геномов и почти во всех геномах архей, но, что удивительно, совсем не встречается в геномах высших организмов. Хотя на сегодняшний день Cas9 чаще всего используется совместно с CRISPR, являясь предметом ожесточенных патентных споров, о которых я расскажу позже, этот фермент представляет собой лишь каплю в море разнообразных систем CRISPR, встречающихся в природе. Ученые прикладывают массу усилий, чтобы изучить биологическое разнообразие на Земле, открыть новые белки семейства Cas с новыми функциями и расширить набор инструментов CRISPR[82].
После того как исследователь определил последовательность гена, на которую он хочет воздействовать, он может перейти на любое количество веб-сайтов, ввести желаемый генетический текст и заказать индивидуально подобранную короткую последовательность направляющей РНК. Если CRISPR – это молекулярная система работы с текстами, то направляющая РНК действует как функция CTRL + F, выявляющая интересующие последовательности генов. Работа Cas9 подобна нажатию клавиш CTRL + X. Однако редактирование генома – это не просто наведение курсора для выделения и удаления опечатки. Речь идет о том, чтобы решить, что будет дальше и как этим управлять, как исправить опечатку.
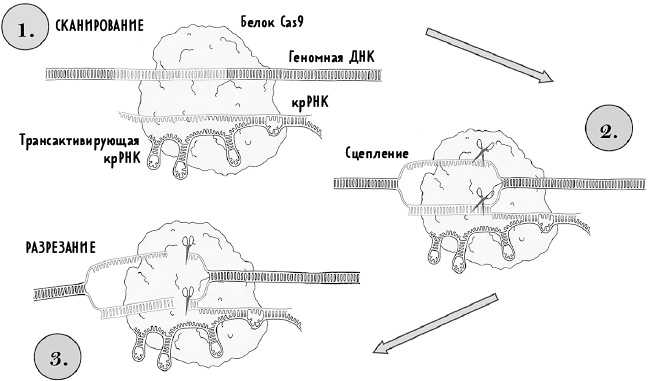
Разрезание ДНК при помощи CRISPR. 1. Сканирование: нуклеаза Cas9 связывается с направляющей РНК, образуя рибонуклеопротеидный комплекс. Направляющая состоит из крРНК и трансактивирующей крРНК. Комплекс Cas9 сканирует ДНК в поисках последовательности PAM, которая служит первичным сигналом для проверки совпадения последовательностей. 2. Сцепление: Cas9 связывается с ДНК и расщепляет двойную спираль, позволяя крРНК комплементарно (взаимодополняюще) присоединиться к одной нити ДНК. 3. Разрезание: если ДНК и РНК полностью совпадают, Cas9 претерпевает конформационное изменение, в результате чего обе нити ДНК разрезаются в одном и том же месте. (По материалам пункта 23 примечаний.)
Клетки обладают множеством молекулярных механизмов восстановления разрывов и других мутаций в ДНК. Если бы их не было, нас бы не было в живых. Два наиболее известных механизма называются негомологичным соединением концов (NHEJ) и гомологически направленной репарацией (HDR). NHEJ небрежно сшивает вместе разорванные концы ДНК, что часто приводит к небольшим вставкам или делециям генетического текста в месте восстановления. Это идеально подходит для исследователей, использующих CRISPR для преднамеренного нарушения функции гена путем его нарушения с помощью добавления случайных вставок и делеций. Другой механизм, HDR, при наличии подходящей матрицы производит надежное восстановление. В нормальных условиях матрицей является соответствующий ген на сестринской хромосоме. Прелесть редактирования генома при помощи CRISPR заключается в том, что исследователь может предоставить подходящую матрицу, содержащую желаемую последовательность для восстановления разрыва, вызванного Cas9, что приводит к нужному изменению в определенном месте молекулы ДНК[83][84].
В январе 2020 г. около пятисот ученых собрались в Банфе, горнолыжном курорте на юге канадских Скалистых гор, чтобы провести первую большую конференцию года, посвященную CRISPR. (Она также оказалась и последней, поскольку пандемия COVID-19 лишила желающих возможности ездить на подобные мероприятия.) Организаторы пригласили Дудну выступить с речью на открытии, состоявшемся воскресным утром, – к этой роли она уже привыкла. Она начала с искренних извинений за то, что не сможет остаться и пообщаться с участниками в течение следующих нескольких дней, поскольку ей было необходимо вернуться в Беркли, чтобы в понедельник утром прочитать лекцию для шестисот студентов.
Лекция Дудны, прочитанная с той же скромностью и почтением перед наукой, что были ей свойственны в начале карьеры более трех десятилетий назад, служила биотехнологическим эквивалентом обращения президента США к конгрессу о положении в стране. Основная мысль ее вступительной речи – дани уважения не только ее собственной работе, но и труду множества исследователей за предыдущую четверть века – была простой:
«Прецизионное редактирование генома осуществимо»[85].
Глава 3
Мы можем быть героями
У великих моментов в истории науки и технологий может быть самая неожиданная завязка. В 1966 г. Playtex, компания, создавшая культовый бюстгальтер Cross Your Heart, приняла участие в конкурсе NASA по разработке скафандра для первой высадки «Аполлона» на Луну. Костюмы должны были выдерживать давление и резкие перепады температур. Кроме того, они должны были обладать гибкостью – свойством, которое Playtex продемонстрировала, засняв, как один из технических специалистов компании часами играет в американский футбол в скафандре. В результате четыре швеи Playtex сшили двадцатислойный скафандр A7L, в котором Нил Армстронг прошелся по лунному подиуму[86].
Перенесемся от Моря Спокойствия на Луне к солончакам Санта-Полы у Средиземного моря. Я нахожусь в Аликанте, популярном туристическом курорте на побережье Коста-Бланка на юго-востоке Испании. Вряд ли можно сказать, что здесь самая экстремальная среда обитания на Земле. Однако, проехав примерно двадцать километров на юг, вы доберетесь до Салинас-де-Санта-Пола. Соляные озера, или солончаки, как следует из названия, представляют собой сеть прямоугольных лагун с экстремально высокой концентрацией соли, получившейся в результате сильного воздействия солнца и ветра. По периметру, где вода встречается с сушей, соль кристаллизуется, образуя твердую белую полосу, похожую на идеальный край бокала с коктейлем «Маргарита».
Это место имеет экологическое, историческое и коммерческое значение. Здесь живут фламинго и другие виды животных. Сторожевая башня, построенная в XVI в., служила подданным короля Филиппе II: отсюда они вели наблюдение за маврами. Это место похоже на заповедник, но на самом деле – это промышленная соляная шахта. В каждом озере размером с футбольное поле постоянно концентрируется соль. Сегодня Bras del Port добывает ежедневно из Средиземного моря в среднем около 4000 тонн соли. Горы соли готовы для отправки: около 60 % пойдет на очистку воды, остальное – в пищу.
Для Франсиско Мохики, микробиолога из Университета Аликанте, изучение галофильных организмов, которые процветают в этой своеобразной среде обитания, составляет особую страсть. Там, где он когда-то трудился в безвестности, сегодня изо всех сил стараются избежать внимания СМИ. В 2017 г. ведущая испанская газета El País высказала предположение, что однажды Мохика переберется из солончаков в нобелевские спа-курорты.
Мохика любезно согласился довезти меня на своем неброском Volkswagen Passat до Салинас. Этот путь он проделывает довольно часто, обычно в компании фотографов или съемочных групп, которые просят его изобразить, как он осматривает чистые розовые воды или смотрит сквозь стеклянную емкость с соленой водой на солнце, как в первый раз, будто любуясь бокалом риохи. По счастливому стечению обстоятельств Мохика никогда не собирал образцы для своих собственных исследований, поскольку во времена, когда он был молодым аспирантом, в лаборатории уже имелась груда материалов, собранных его руководителем за предыдущие десять лет.
Впервые Мохика попал на солончаки после того, как закончил военную службу в 1989 г. Он искал работу в качестве научного сотрудника, и вскоре ему предложили должность на кафедре микробиологии местного университета в лаборатории, изучающей микроорганизм под названием «галоферакс». «Меня не особенно интересовали эти организмы. Мой руководитель сам решил вопрос с моей диссертацией», – сообщил он, пока мы гуляли по соляным озерам[87].
Галоферакс – это не бактерией (хотя раньше его ошибочно называли Halobacterium), но принадлежит к особой группе одноклеточных организмов – археям. Невооруженным глазом эти два таксона трудно отличить друг от друга. Но это не согласуется с эволюционной пропастью продолжительностью около трех миллиардов лет. Признание того, что археи – это не просто ответвление от прокариот, но совершенно отдельный «третий домен» живых существ, является результатом плодотворной работы биолога-эволюциониста Карла Вёзе. Секвенирование ДНК выявило поразительные генетические различия между археями и бактериями, подобно тому как операционная система Windows отличается от macОS. Об этом удачно сказал Эд Йонг: «Это все равно, что мы смотрим на карту мира, а Вёзе вежливо объясняет, что треть ее еще не развернули»[88].
Вода выглядит розовой, а соленые корки лагун усыпаны розовато-красными полосами, где кишит микроскопическая жизнь. Красноватый оттенок связан с выработкой каротиноидов – это часть механизма защиты микробов от соли и солнечного света. «Как будто солнцезащитный крем», – смеется Мохика. Цвет меняется в зависимости от степени солености: красный становится розовым при повышении концентрации соли от 10 до 30 %. Те же химические соединения придают оперению фламинго их фирменный розовый оттенок, поскольку они питаются крошечными солоноводными креветками, которые, как и Haloferax, обитают в этих соленых водах в огромном количестве.
Любящие соль археи Аликанте по определению являются экстремофилами – формами жизни, приспособленными для жизни в необычайно суровых условиях, будь то подводные вулканические источники, выжженные пустыни или замерзшая тундра. Для галоферакса концентрации соли в обычной морской воде просто недостаточно. Чтобы жить и развиваться, ему требуется соли в десять раз больше. Воспроизвести подобные условия в лаборатории чрезвычайно трудно, поэтому эти организмы остаются малоизученными по сравнению со своими дальними бактериальными родственниками. Два основных вида галоферакса – это H. mediterranei и H. volcanii (вторые названы так не потому, что они перепутали соляное озеро с кратером вулкана, а в честь открывшего их израильского ученого Бенджамина Вулкани). Я также чувствую присутствие анаэробных бактерий, благодаря сильному сернистому запаху, распространяющемуся над водой.




