
Полная версия
Генетические технологии и медицина: доктрина, законодательство, практика
В Германии генная инженерия в целом регулируется Законом о генной инженерии [17], который направлен на защиту жизни и здоровья людей, окружающей среды, растений и животных от вредных воздействий, возникающих в результате генетических манипуляций. Он также направлен на создание правовых рамок для исследований, разработки, использования и поощрения научных, технических и экономических аспектов генетической технологии.
Данный закон применяется к:
1) генетическим установкам;
2) генетическим работам;
3) выделениям генетически модифицированных организмов;
4) размещению продуктов, содержащих или состоящих из генетически модифицированных организмов.
Согласно § 2 данного Закона его положения не распространяются на применение генетически модифицированных организмов на людях.
В сентябрьском заявлении 2015 года немецкой академии о «возможностях и ограничениях редактирования генома» были одобрены призывы к международному мораторию на «все формы зародышевой инженерии, которые могут оказать влияние на геном потомства». В документе утверждалось, что такой мораторий предоставит возможность обсудить нерешенные вопросы, разработать рекомендации по регулированию, но в то же время он не должен приводить к ограничению методологических разработок или ограничивать любые перспективные (новые) подходы к редактированию генома [6].
Использование эмбрионов для исследований запрещено в Германии Законом о защите эмбрионов 1991 г., в соответствии с которым получение линий эмбриональных стволовых клеток – уголовное преступление, но разрешается импорт линий стволовых клеток, созданных из избыточных эмбрионов ЭКО до 2008 года, при соблюдении различных условий и этических норм [42]. Наиболее важным положением является статья 5 Закона об искусственном изменении репродуктивных клеток человека, в которой устанавливается, что:
1) тот, кто искусственно изменяет генетическую информацию клетки зародышевой линии человека, будет наказан лишением свободы на срок до 5 лет или штрафом;
2) любой, кто использует человеческую гамету с искусственно измененной генетической информацией для оплодотворения, также будет наказан;
3) покушение также наказуемо;
4) подраздел (1) неприменим к:
• любому искусственному изменению генетической информации гаметы, находящейся вне тела, если она не будет использоваться для оплодотворения;
• любому искусственному изменению генетической информации такой эндогенной репродуктивной клетки, которая была взята у плода, человека или умершего человека, если исключено, что он будет передан эмбриону, плоду или человеку, или из него разовьется гамета.
Закон о стволовых клетках 2002 года не позволяет производить эмбрионы для исследований. Предимплантационная генетическая диагностика стала официально легальной в 2011 году, после того как решение федерального суда продемонстрировало, что закон не запрещает врачам проводить генетический скрининг искусственно произведенных эмбрионов перед их передачей женщине.
Общество генетики человека (GfH), основанное в 1987 году, является основной профессиональной членской организацией для генетиков человека в Германии [46]. Немецкое общество генетики человека поощряет и объединяет различные научные и клинические специальности генетики [18]. GfH тесно сотрудничает с другими немецкими, европейскими и международными научными обществами.
Академия генетики человека как постоянный институт GfH предлагает непрерывное медицинское образование (CME) для врачей и ученых в области генетики человека. Важным направлением деятельности GfH является создание стандартов надлежащей генетической лабораторной практики человека, а также практики генетического консультирования и публикации руководств по оценке качества в клинико-генетической практике. GfH учредила специальную образовательную программу, позволяющую ученым (например, биологам, биохимикам) получить сертификат специалиста клинической генетической лаборатории (GfH), который позволяет работать как профессионалу в области клинической генетики и ухода за пациентами.
Профессиональная ассоциация немецких генетиков является профессиональным политическим форумом всех врачей-специалистов по генетике и предлагает работающим в данном направлении возможность личного сотрудничества, обмена с коллегами и активного участия в формировании структур и условий работы. В соответствии с Уставом профессиональной ассоциации Немецких генетиков (BVDH) § 13 (1) [43] для поддержки деятельности на государственном уровне Совет создает комиссию по представительству страны. Представители страны поддерживают работу региональной ассоциации и, в частности, служат координаторами деятельности ассоциации на уровне страны.
Комиссия по гендиагностике (GEKO) [19] – это междисциплинарная независимая комиссия из 13 экспертов по специальностям «медицина и биология», двух экспертов по специальностям «этика и право», а также трех представителей организаций пациентов и потребителей и организаций самопомощи инвалидам. Она создает руководящие принципы в соответствии с § 23 Закона о Гендиагностике (GenDG) [20] с точки зрения общепризнанного состояния науки и техники. Эта комиссия базируется при Институте Роберта Коха, который входит в подразделение Федерального министерства здравоохранения. Данная комиссия создает рекомендации по общепринятому состоянию медицинской науки и техники, в частности по оценке генетических свойств, квалификации лиц для генетического консультирования, содержанию просвещения и генетического консультирования, проведению генетических анализов и генетических последовательных исследований [21].
Статья 119/a Конституции Швейцарской Федерации (Article 119/a of the Constitution of the Swiss Federation (overseen by the Federal Office of Public Health – BundesamtfűrGesundheit) строго запрещает клонирование и генетические модификации человеческих зародышевых клеток и эмбрионов в любых целях. Создание человеческих эмбрионов для исследований не допускается [14].
Модификации зародышевой линии человека, то есть сперматозоидов или яйцеклеток (генная терапия зародышевой линии), запрещены в Швейцарии. Клинические испытания генной терапии и разрешения должны быть одобрены Швейцарским управлением по надзору за лекарствами и медицинскими изделиями. Кроме того, для одобрения испытаний генной терапии требуется согласие местного этического комитета [22].
При производстве продуктов генной терапии необходимо соблюдать руководящие принципы надлежащей производственной практики (GMP) в соответствии с Европейским руководством по надлежащей производственной практике (1997) [13].
В 2017 году Парламент продлил мораторий на генетические технологии (за исключением исследовательских) на четыре года [23]. Таким образом, в Швейцарии существует строго регламентированный государственный режим развития генетических технологий.
В Швеции согласно статье 2 Закона о генетической целостности (2006: 351) [44] его положения распространяются на:
• использование результатов генетических исследований, генетической информации и генной терапии;
• генетическое исследование в общем медицинском скрининге;
• пренатальную и предимплантационную генетическую диагностику;
• меры для целей исследования или лечения с использованием человеческих яйцеклеток;
• осеменение и оплодотворение вне тела.
В соответствии с разделом 1 данного Закона генетическое исследование, составляющее или являющееся частью общего медицинского скрининга, может проводиться только с разрешения Национального совета здравоохранения и социального обеспечения. Такое исследование не может охватывать никого, кроме лица, давшего письменное согласие.
Редактирование генома зародышевой линии прямо запрещено Законом о генетической целостности, 2006:351 [44]. Попытки проведения исследований, которые приводят к генетическим изменениям, передаваемым через зародышевую линию у человека, не допускаются. Лечение, направленное на внесение наследуемых генетических изменений в организм человека, не допускается. Все эксперименты на соматических клетках человека должны быть одобрены этическим наблюдательным советом в соответствии с законодательством (Etikprovningslagen 2003: 460) [33]. Шведское агентство по медицинским продуктам должно будет одобрить любые терапевтические применения на людях. Данное законодательство касается генной терапии, осуществляемой путем редактирования генома.
Консультативный совет по генетическим технологиям [37] – это государственное учреждение, созданное в 1994 году. Задача совета заключается в том, чтобы посредством консультативной деятельности содействовать этически оправданному и безопасному использованию генной инженерии для здоровья человека и животных, а также окружающей среды. Консультативный совет по генным технологиям также имеет задачу распространения знаний о разработках в области генной инженерии. С 01.09.2019 шведский исследовательский совет (värdmyndighet) является членом Консультативного совета по генным технологиям.
Его деятельность регулируется:
• Постановлением (2007:1075) с инструкциями консультативному совету по генным технологиям [15];
• главой 13 раздела 19 Шведского кодекса статутов (1998:808) [35];
• Постановлением (2002:1086) о выбросе в окружающую среду генетически модифицированных организмов (ГМО) [16].
Законодательство Великобритании допускает использование избыточных эмбрионов ЭКО для исследований и создание эмбрионов в исследовательских целях путем ЭКО или клонирования. В рамках Закона об оплодотворении человека и эмбриологии 2008 года доклинические биомедицинские исследования могут включать использование соматических или половых клеток, включая человеческие эмбрионы до 14 дней [31].
Британские ресурсы для проведения генетических исследований включают в себя:
• Genomics England – была создана для реализации проекта «100 000 геномов» [3];
• Genomics England,s Discovery Forum, который позволяет компаниям получить доступ к набору данных [12];
• Британский Биобанк – исследовательский ресурс, который хранит и предоставляет доступ к образцам и данным;
• Национальный центр биопроб, который предоставляет высококачественные, высокопроизводительные услуги для биомедицинских исследователей, занимающихся исследованиями, включающими сбор, обработку, хранение и анализ биологических образцов от добровольцев и пациентов [24].
Геномика Англии преследует четыре основные цели:
• приносить пользу пациентам;
• создать этическую и прозрачную программу, основанную на согласии;
• дать возможность новым научным открытиям и медицинским озарениям;
• дать толчок развитию британской геномной индустрии.
Принципы работы над генетическими исследованиями.
1. Пациенты и общественность будут в центре исследования.
2. Системы здравоохранения и исследовательские программы будут работать в партнерстве на благо пациентов. Поощряется доступность и надлежащее использование данных для исследований и инноваций, которые служат общественным интересам, одновременно способствуя защите конфиденциальности и безопасности данных.
3. Пациенты и общественность должны иметь возможность доступа к своей собственной геномной и медицинской информации и иметь соответствующий голос при использовании своих данных для исследований.
4. Приоритетное внимание уделяется обучению и развитию работников.
5. Все медицинские и исследовательские программы в области геномики будут включать надежные этические рамки для поддержания наилучшей практики, прозрачности и доверия.
6. Открытость для международной работы по продвижению общего понимания геномики, в том числе в области реагирования на инфекционные заболевания.
7. Приверженность общего набора протоколов и стандартов, чтобы гарантировать, что данные, информация и образцы могут быть широко доступны и повторно использованы для исследований и пользы для здоровья [26].
Национальная служба геномной информатики (NGIS) и сеть национальных центров геномных лабораторий (GLHs) представляет собой интегрированную систему для геномного тестирования. NHS England и NHS Improvement в сотрудничестве с Genomics England будут работать над дальнейшим преобразованием путей оказания медицинской помощи и созданием междисциплинарных команд и межпрофессиональной инфраструктуры, которые будут иметь решающее значение для будущего. Новое исследование службы геномной медицины NHS, возглавляемое NHS England и NHS Improvement, NIHR и Genomics England, установит скоординированный подход к внедрению исследований и открытий для продвижения клинической помощи, гарантируя пациентам максимальную выгоду от исследований и инноваций, с прорывами, позволяющими предотвратить плохое здоровье, более раннюю диагностику, более эффективное лечение, лучшие результаты и более быстрое выздоровление.
Таким образом, Великобритания создала и развивает культуру сотрудничества и партнерства между правительством, промышленностью и благотворительными организациями в области медицинских исследований. Правительство продемонстрировало приверженность развитию отраслей науки о жизни и геномики Великобритании с помощью Фонда Industrial Strategy Challenge Fund и двух сделок в секторе наук о жизни. Следующее поколение новаторов в области геномики и наук о данных будет обучаться с использованием таких активов, как UK Biobank и ADD, а также набора данных Genomics England, что еще больше укрепит научную базу [26].
Франция ратифицировала Конвенцию Овьедо в 2011 году и таким образом официально приняла принципы статьи 13 конвенции, касающуюся предотвращения внесения любых изменений в геном человека, в геном потомков [38].
Французское законодательство разрешает использование избыточных эмбрионов ЭКО, но запрещает создание человеческих эмбрионов для исследований и создание трансгенных человеческих эмбрионов.
Статья L2151-5 Кодекса общественного здравоохранения разрешает проведение исследований эмбрионов на определенных условиях.
Статья L 2151-2 запрещает создание трансгенных эмбрионов [10].
Статья 16-4 Гражданского кодекса Франции (пункт 3) предусматривает, что без ущерба для исследований, направленных на предупреждение и лечение генетических заболеваний, никакие изменения генетических характеристик не могут быть внесены в целях модификации потомков данного лица [11].
Генетическая экспертиза может проводиться только в медицинских, судебных или научных целях и только в разрешенных лабораториях. Эта практика, в частности, регулируется статьями 16–10 и последующими статьями Гражданского кодекса [34].
Более того, Национальная академия медицины рекомендовала сохранить действующее законодательство, запрещающее любые манипуляции с геномом, приводящие к изменениям генома потомства, и развитие исследований с использованием технологий целенаправленного редактирования генома, включая работу с зародышевыми клетками и эмбрионами человека, до тех пор, пока отредактированные эмбрионы не будут перенесены в матку в соответствии с текущим состоянием знаний и законодательства [27].
Таким образом, французское законодательство в настоящее время считается в целом поддерживающим фундаментальные исследования в этой области и проводит различие между любыми мероприятиями, направленными на изменение генетических характеристик потомства, и исследованиями, которые непосредственно не приводят к рождению ребенка, генетические характеристики которого были бы изменены [45].
В Китае согласно статье 8 Этических рекомендаций для исследования эмбриональных стволовых клеток человека (Признано Министерством науки и техники и Министерством здравоохранения Китайской Народной Республики 24.12.2003) [28] для проведения исследования эмбриональных стволовых клеток человека необходимо серьезно соблюдать принципы информированного согласия и осознанного выбора, подписывать форму информированного согласия и защищать конфиденциальность субъектов. Исследователь должен использовать точный, ясный и понятный язык, чтобы правдиво информировать субъектов об ожидаемой цели эксперимента и возможных последствиях и рисках до эксперимента, получить их согласие. В соответствии со статьей 9 исследовательское подразделение, занимающееся эмбриональными стволовыми клетками человека, создает комитет по этике, состоящий из исследователей и управленческого персонала в соответствующих областях, таких как биология, медицина, право или социология. В его обязанности входит проведение этических и научных исследований эмбриональных стволовых клеток человека.
В рамках существующей нормативно-правовой базы редактирование генома соматических клеток человека может считаться терапевтической технологией третьей категории, а не лекарством [30].
Положением о генетических ресурсах человека от 28.05.2019 (Государственный совет Китая, 2019) [29] регламентирован весь процесс исследования от сбора до эксплуатации и совместного использования материала и любых полученных из него данных. Особое внимание уделено защите конфиденциальности и прав субъектов данных, включая право на добровольное участие и отказ от сбора данных. Согласно регламенту, поставщики генетического тестирования должны уважать частную жизнь потребителей и не могут собирать и использовать генетические данные потребителей без их информированного согласия. Однако регламент не содержит подробных требований к информированному согласию и защите частной жизни, поскольку основной целью нового регламента является эффективная защита и рациональное использование генетических ресурсов человека в Китае. Согласно Положению, китайская организация имеет право собирать, сохранять и использовать человеческие генетические ресурсы Китая (CHGR) для научных исследований или клинических испытаний. Продажа генетических ресурсов человека запрещена.
Для осуществления научно-исследовательской деятельности с использованием человеческих генетических ресурсов иностранные организации и физические лица, а также организации, непосредственно контролируемые ими («иностранная организация»), сотрудничают с китайской организацией и запрашивают одобрение технических административных управлений Государственного Совета. Любой патент, полученный в результате совместного исследования, находится в совместном владении обеих сторон, право собственности на другие технические результаты может быть согласовано. Иностранная организация имеет право на использование данных, полученных в результате совместного исследования. Для клинических испытаний, в которых используются человеческие генетические ресурсы и которые не предполагают его экспорта, достаточно упрощенной регистрации. Экспорт материалов с использованием человеческих генетических ресурсов подлежит утверждению Государственным Советом.
Согласно китайскому патентному законодательству, любая патентная заявка с использованием генетических ресурсов, составленная с нарушением законов КНР, не подлежит рассмотрению, а в случае, если такая заявка была одобрена, она признается недействительной в Китае [7]. Таким образом, в Китае имеется широкая правовая база для развития генетических исследований и международного сотрудничества.
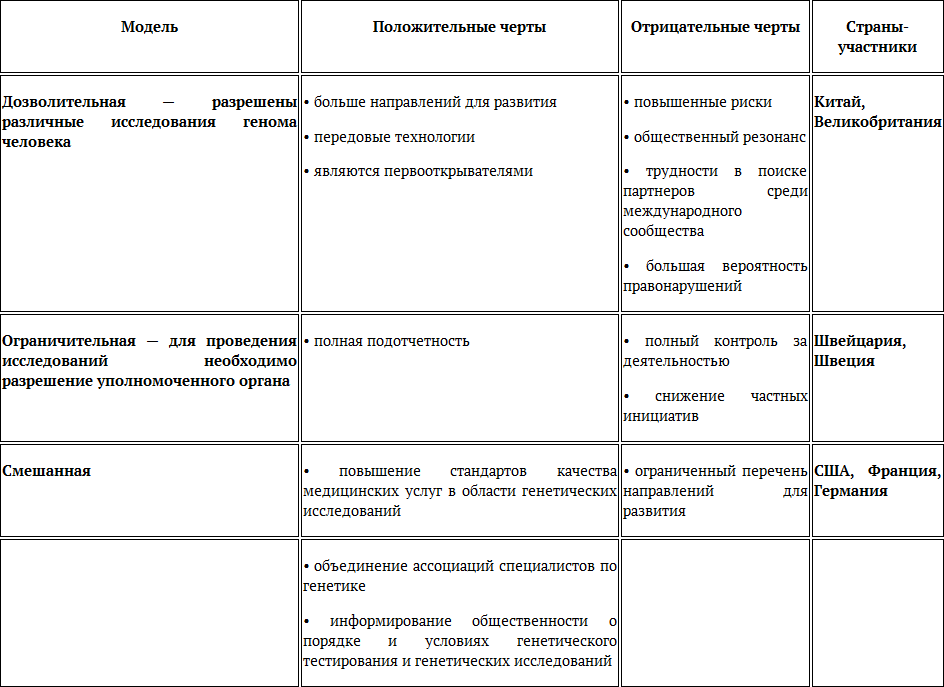
Подводя итоги, целесообразно отметить, что на сегодняшний день в общемировом масштабе дифференцируются следующие модели правового регулирования генетических технологий в сфере медицины (виды национальных режимов развития генетических технологий): дозволительная, ограничительная и смешанная. Первая модель характеризуется открытостью к нововведениям, стремлением к изучению новых направлений деятельности и высоким уровнем исследовательских инициатив, поддерживаемых государством, в связи с чем ее следует обозначить как «дозволительная/разрешительная» модель. Данной модели присущи такие положительные черты, как: широкий выбор направлений для развития, использование, изучение и разработка передовых технологий, лидирующие позиции по данному направлению развития на международной арене. При этом освоение новых направлений в сфере генетических технологий влечет за собой появление отрицательных черт (рисков), а именно: в результате выхода за рамки общепризнанных границ развития страны сталкиваются с проблемой трудности выбора партнера среди международного сообщества для некоторых направлений сотрудничества, поскольку во многих странах установлен мораторий на соответствующую деятельность. Кроме того, поскольку проводимые исследования напрямую связаны с правами и свободами человека, развитие генетических технологий сталкивается с этическими требованиями и зачастую вызывает общественный резонанс, предполагает усиление защиты информации, получаемой в рамках таких исследований, с целью недопущения ее злоупотреблением. Данная модель характерна для таких стран, как Китай, Великобритания.
Вторая модель правового регулирования генетических технологий не допускает вмешательств в модификацию зародышевой линии без согласия специально уполномоченных государственных органов, в связи с чем может быть обозначена как «ограничительная». Данная модель характерна для таких стран, как Швеция и Швейцария. Регулирование развития генетических технологий в данных странах закреплено на законодательном уровне. В случае успешной проверки генетических исследований необходимо получить официальное разрешение уполномоченных субъектов. Такой подход к развитию генетических технологий имеет ряд достоинств, а именно: подотчетность специализированному органу, что гарантирует высокую эффективность разработанных методик генной терапии. Однако в данных странах распространена практика введения моратория на определенную сферу развития генетических технологий. Данный запрет включает в себя такие недостатки, как отсутствие инициатив со стороны частного сектора ввиду сложности процедуры отбора на дальнейшее утверждение результатов генетических исследований. Такой строгий подход к установлению режима развития генетических технологий в данных странах обусловлен целью обеспечения уважения человеческого достоинства и свободы.
Третья модель представляет собой объединение черт первой и второй модели и, следовательно, может быть представлена как «смешанная». Такой подход к развитию генетических технологий характерен для таких стран, как США и Германия. Данная модель также имеет такой недостаток, как определенный перечень направлений развития, однако предполагает более мягкие законодательные рамки и способствует установлению международных контактов. Основным достоинством данной модели является обязательное информирование общественности о порядке и условиях генетических исследований и тестирований. Это способствует переходу к режиму общественного контроля, привлечению экспертов и организаций в данную отрасль.
Библиографический список
1. Мохов А. А. Принцип предосторожности в биомедицине // Медицинское право. 2017. № 1. С. 5–10.
2. ABMGG Statement on Racial Injustice. URL: http://www.abmgg.org/ (дата обращения: 30.11.2020).
3. About Genomics England. URL: https://www.genomicsengland.co.uk/about-genomics-england/ (дата обращения: 30.11.2020).
4. Association for Molecular Pathology v United States Patent and Trademark Office // United States Supreme Court. 2013. № 12–398.
5. California Health and Safety Code, Sec. 24185-24187. URL: https://codes.findlaw.com/ca/health-and-safety-code/ (дата обращения: 30.11.2020).
6. Chancen und Grenzen des genome editing The opportunities and limits of genome editing. URL: www.leopoldina.org/uploads/tx_leopublication/2015_3Akad_Stellungnahme_Genome_Editing.pdf (дата обращения: 30.11.2020).
7. China’s State Council Publishes New Regulations on the Management of Human Genetic Resources. URL: https://www.ropesgray.com/en/newsroom/alerts/2019/06/Chinas-State-Council-Publishes-New-Regulations-on-the-Management-of-Human-Genetic-Resources (дата обращения: 30.11.2020).
8. Clinical Laboratory Improvement Amendments (CLIA). URL: https://www.cdc.gov/clia/index.html (дата обращения: 30.11.2020).
9. Clinical Laboratory Improvement Amendments (CLIA). URL: https://www.cms.gov/Regulations-and-Guidance/Legislation/CLIA/ (дата обращения: 30.11.2020).
10. Code de la santé publique. URL: https://www.legifrance.gouv.fr/codes/article_lc/LEGIARTI000024325610/2011-07-09 (дата обращения: 30.11.2020).
11. Code civil. URL: https://www.legifrance.gouv.fr/codes/article_lc/LEGIARTI000006419299 (дата обращения: 30.11.2020).
12. Discovery Forum – partnership on an industrial scale. URL: https://www.genomicsengland.co.uk/discovery-forum-partnership-on-an-industrial-scale/ (дата обращения: 30.11.2020).
13. EudraLex Volume 4 Good Manufacturing Practice (GMP) guidelines. URL: https://ec.europa.eu/health/documents/eudralex/vol-4_en (дата обращения: 30.11.2020).









