
Полная версия
Прецизионная иммунотерапия рака и других злокачественных опухолей
Фундаментальные научные представления о раке в настоящее время претерпели определенные изменения, в частности на сегодняшний день известно, что канцерогены (неблагоприятные факторы внешней среды и микроокружения) системно воздействуют не только и не столько на отдельные тканеспецифические клетки организма, сколько повреждают преимущественно тканеспецифические стволовые клетки (СК) и приводят к возникновению в них анеуплоидий (дополнительных хромосом или отсутствие хромосом). Повреждения (мутации) генома в тканеспецифической СК ведут к неустойчивости её кариотипа (P. Duesburg et al, 2011). Анеуплодии приводят к неустойчивости хромосом у потомков этой опухолевой СК (ОСК), то есть, во всех опухолевых клетках (ОК) организма, что абсолютно согласуется с классическими представлениями о морфологии ОК (Theodor Boveri,1914). Хромосомная нестабильность в клетке приводит к появлению мутаций в онкогенах и генах-онкосупрессорах в ОСК (Reya T, Morrison S.J.,Clark M.F., Weissman I. L.,2001). Накопление мутаций в генах приводят к нестабильности генов (F. Urh et al., 2005). Появление случайных мутаций в ОСК приводит к генерации дефектных белков (L.A. Loeb, 1976). Наши собственные исследования по протеомному картированию и профилированию нормализованной сигнальной интенсивности белков в ОСК при различных онкологических заболеваниях показали (Брюховецкий А.С,2014), что их белковый состав или протеом ОСК на 35—65% состоит из онкоспецифических белков (ОСБ), то есть белков, не встречаемых в норме у человека. Это белки «не человеческого вида», то есть не вида «homo sapiens», а мутантные «чужеродные» ОСБ, которые формируют количественные и качественные онкоспецифические патологические изменения в хромосомах ядра СК в виде анеуплодий (Брюховецкий А. С., 2014). В то же время стало известно, что возможна обратимость трансформации ОК при дифференцировке в нормальные клетки из-за нестабильности дефектных белков (Васильев Ю.М,1986). Появление анеуплодий и изменений хромосомного видового баланса ядра ОСК и ОК при раке стало причиной создания новой теории происхождения рака, представленной американским ученым Pеter Duesberg с соавт. (2011), в основе которой лежит фундаментальный тезис о том, что «канцерогенез это одна из форм видообразования» в эволюции. Свои доказательства Duesberg с соавт. (2011) основывает на демонстрации изменения модифицированных кариотипов в ОК при различных типах рака. Можно скептически отнестись к данным исследованиям, как это сделали множество исследователей, но наши собственные исследования (Брюховецкий А. С.,2013, Брюховецкий А. С. с соавт.,2015, Брюховецкий И. С., 2017), направленные на сравнение результатов протеомного картирования и профилирования ОСК и ОК и здоровых тканеспецифических СК организма человека, полностью подтвердили исследования P. Duesberg и его команды (2011), по части формирования в результате канцерогенеза нового фенотипа тканей, содержащего белки, не характерные для протеома здоровых тканей данного вида организма. Характерной особенностью этих протеомных модификаций, вследствие определенных геномных трансформаций, происходящих в ОСК и ОК под воздействием процессов канцерогенеза, является изменение не столько геномной (она минимальна), сколько эпигеномной (транскриптомной и протеомной) структуры ядра и других компартаментов этих клеточных систем, изменяя их видоспецифичный фенотип на опухолевый. Канцерогенез кардинально изменяет функционирование большинства внутриклеточных путей сигнальной трансдукции (ВКПСТ) в пострадавшей ОСК и ОК, модифицирует их и делает их малоуправляемыми для основных регуляторных клеточных и гуморальных систем иммунитета и собственных тканеспецифических СК.
Нарушение внутриклеточного сигналинга в ОК и ОСК является самым очевидным нарушением в функционировании ОК, и об этом написано огромное количество научных работ и научных обзоров литературы. Поэтому, мы не будем в этой главе останавливаться на перечислении всех пострадавших при канцерогенезе внутриклеточных путей сигнальной трансдукции (ВКПСТ) в ОСК и в ОК, так как эти изменения хорошо описаны в большинстве руководств для врачей онкологов и специализированных руководствах по молекулярной биологии рака, а остановимся на другой особенности молекулярно-биологического повреждения ОК и ОСК, которая была выявлена нами в процессе собственных исследований при многоуровневом сравнительном протеомном картировании и профилировании белков ОСК и ОК и нативных тканеспецифических СК (Брюховецкий А. С., 2014; Bryukhovetskiy A.S. et al.,2015). Большинство современных мировых научных исследований сосредоточены на изучении ОСБ в ОК и ОСК с целью сделать их основными целями и мишенями для таргетной (молекулярнонацеленной) терапии рака (Личиницер М. Р., 2016, Горбунова В. А. с соавт.,2017). Несомненно, эти изменения очень важно понимать и использовать в создании инновационных противораковых лекарственных средств, но в каждом конкретном случае рака они крайне специфичны и вариабельны в процессе персонального канцерогенного неопластического перерождения клеток и тканей. Мы же задались вопросом о том, что осталось не измененным (не пострадавшим в результате канцерогенеза) в протеомной структуре ОСК и ОК при завершении процесса канцерогенеза и формировании определенной, фенотипически завершенной клеточной линии ОСК при различных видах рака. К нашему удивлению, при целом ряде злокачественных онкологических заболеваний (раке молочной железы, раке легких, мультиформной глиобластоме и др.) оказались не пострадавшими всего 10 путей внутриклеточной сигнальной трансдукции, а все остальные ВКПСТ, в той или иной мере, были трансформированы опухолевым процессом.
Акцепторные белки этих неопластически измененных ВКПСТ в ОК и ОСК были замещены на онкоспецифические белки, которые становятся малодоступными для регуляции известными белками-лигандами, найденными нами в международных базах данных белок-белковых взаимодействий (Брюховецкий А. С., 2014).
Таблица 1.
Внутриклеточные сигнальные пути в опухолевых стволовых клетках рака молочной железы, рака легкого и мультиформной глиобластомы, не пострадавшие в процессе канцерогенеза
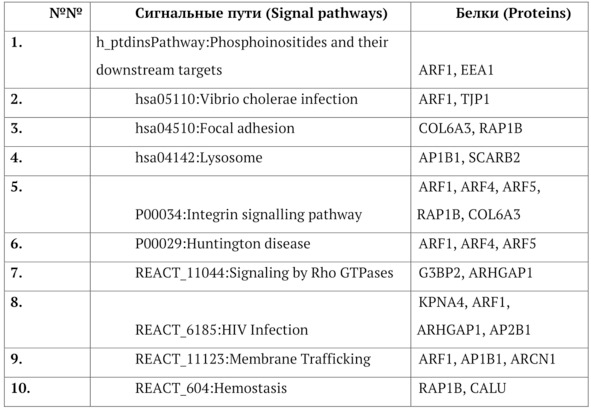
Список внутриклеточных путей сигнальной трансдукции, не пострадавших в результате канцерогенеза в ОК и ОСК различных опухолей представлен в таблице 1. Таким образом, небольшое количество внутриклеточных сигнальных путей в ОСК и ОК остались не вовлечены в процесс канцерогенеза, и они могут быть основными объектами целенаправленного регуляторного и управляющего воздействия на них, и белки этих путей могут быть основными целями и мишенями в регуляторной терапии рака.
Почему эти новые знания о биологии рака так важны для терапии злокачественных опухолей? Потому, что стандартная методология поиска мишеней и целей таргетной терапии среди известных онкоспецифических белков (ОСБ) в ОК и ОСК не позволяет добиться длительного и стойкого подавления патологических эффекторных функций (пролиферации, миграции, репродукции, метастазирования и т.д.) этих клеток. Попытка полного и окончательного уничтожения ОСК таргетными фармацевтическими препаратами, абсолютно очевидно, потерпела фиаско. Она показала преходящий (временный) эффект этого научно-методологического подхода в терапии опухолей и продемонстрировала не достаточную терапевтическую эффективность прямого блокирующего воздействия самых различных моноклональных антител (МКАТ) на онкоспецифические белки ВКПСТ в этих клетках. МКАТ, разработанные различными фармацевтическими компаниями «Большой Фармы», эффективны в течении 3—4 месяцев, а в дальнейшем ОСК и ОК приспосабливаются к ним, и эффективность терапии снижается.
Оказалось, что убить ОСК физически достаточно трудно, а зачастую вообще, практически не возможно. ОСК выживает в самых неблагоприятных условиях микроокружения и экстремального внешнего воздействия. ОСК человека – один из уникальных способов выживания поврежденных или «мутантных» клеток эукариот в природе, совершенный способ преодоления и переживания неблагополучия биологической клеточной системой в неблагоприятных условиях окружающей среды. Она идентична споре растения или цисте у бактерий, и в этой форме существования живая ОСК способна перенести самые экстремальные воздействия, сохранив основные свойства своего генома для продолжения своего биологического вида. При улучшении условий она очень быстро сможет восстановиться и дать потомство. По-видимому, именно сохранность и функциональность при канцерогенезе путей фокальной адгезии и пути интегринов в ОК и ОСК обеспечивает ей высокий уровень репродуктивных функций, миграции и патотропизма (Bryukhovetskiy A.S. et al.,2016).
ОСК как конечные мишени (цели) в противораковой терапии совсем недавно были описаны в работе A.Shabbir, Esfandiar T., Farassati F. (2018). С научных позиций группы этих авторов, концепция опухолевых стволовых клеток в настоящее время представляет значительный интерес по причине высокой значимости и выводов для нашего понимания биологии опухоли, а также развития новейших противораковых терапевтических средств. Опухоли, впрочем, как это происходит и в здоровых органах, содержат в себе плюрипотентные клетки, способные генерировать свой собственный тип, а также клетки, способные продолжать дальнейшую дифференциацию. Считается, что ОСК являются высоко резистентными к цитотоксическим воздействиям режимов традиционной противораковой терапии (Polyak K.,Hahn W.C., 2006), что приводит к возникновению и развитию невосприимчивого (рефракторного) статуса у опухолей (Polyak K., Hahn W.C., 2006; Aquirre- Ghiso J.A.,2007). Следовательно, ОСК могут рассматриваться как основные драйверы опухолевой целостности и функциональности. Этот факт напоминает роль и значение, которые играют здоровые стволовые клетки (СК) при развитии тканей и органов. Терапевтические меры, призванные элиминировать дифференцированные раковые клетки, оставляя (сохраняя) при этом ОСК, вследствие этих причин, обречены на неудачу из-за резистентности ОСК и их способности репопулировать опухоли (Fujiki H.,Sueoka E., 2017). Данное явление, в действительности, рутинным образом наблюдается в клинической практике. Клиническая ответная реакция на режим химиотерапии с течением времени понижается, по мере того, как опухоль вступает в рефракторную (невосприимчивую) фазу, которая индуцируется за счет обогащения ОСК в популяции опухолевых клеток. Данное явление даже наблюдается в клетках, окультуренных у больных на ранних стадиях заболевания, как, например, при колоректальном раке (SW480, ATCC CCL-228), и рецидивы злокачественных признаков приводят к широко распространенному метастазированию (SW620, ATCC CCL-227). Такой показатель, как SW260, согласно данным, полученным группой A.Shabbir, Esfandiar T., Farassati F. (2018), демонстрирует существенно более высокий процент клеток, позитивных к CD133 – маркеру ОСК.
Современные методы по выявлению ОСК включают в себя поверхностные маркеры, такие, как CD24, CD34, CD44, CD44, CD90, CD133, ABCB5, и EpCAM, каждый из которых был показан, как способный указывать на субпопуляции (группы в популяциях) ОСК в целом ряде злокачественных новообразований (Aponte P.M., 2017). Кроме того, функциональные пробы, такие, как обнаружение фенотипа сторонней популяции с помощью метода исключения Hoechst 33342, способность прорастания в качестве блуждающих сфер в среде, свободной от сыворотки, а также ALDH активность, тоже были задействованы для выявления и изолирования ОСК.
С терапевтической точки зрения, две основные стратегии для таргетирования ОСК были заявлены до сего времени. Первая стратегия основывается на распознавании характеристик клеточного сигналинга опухолевых стволовых клеток. В основном виде, определенные про-онкогенные клеточные сигнальные пути обнаруживаются, как являющиеся сверхактивными в раковых стволовых клетках на более высоких уровнях, чем дифференцированные раковые клетки или незлокачественные клетки. Сверх-активация подобных путей способствует формированию фенотипических признаков раковых стволовых клеток, как, например, сопротивляемость апоптозу и усиленная инвазивность. К примерам подобных путей можно отнести JAK/STAT, Wnt/B-catenin, Hedgehog, Notch, и пути TGF-B (Takebe N.,Miele L.,Harris P.J et al.,2015, Jung H.J.,2017). Пути сигналинга RalA были показаны группой A.Shabbir et al. (2018), как являющиеся сверх-активизированными в ряде злокачественных онкологических заболеваний человека, таких как, например, рак печени, рак легких, медуллобластома, злокачественные опухоли выстилки периферического нерва, и рак яичников (Ginn K.F., Fangman B.,Terai et al., 2016; Wang K.,Terai K., Peng W et al., 2013; Male H., Patel V.,Jacob M.A. et al., 2012; Ezzeldin M.,Borrego-Diaz, Taha M. et al., 2014; Borrego-Diaz E., Terrai K.,Lialite K et al.,2012; Bodempudi V.,Yamoutpoor F., Pan W. et al., 2009). В соответствии с данными, полученными A.Shabbir et al. (2018), в то время как уровни RalA экспрессии являются сопоставимыми с уровнями, наблюдаемыми в ОСК и дифференцированных раковых клетках, экспрессия RalAGTP (активная форма RalA) происходит на более высоких уровнях в ОСК. В общем виде, ни один из выше обозначенных путей клеточного сигналинга, не является специфичным к ОСК; следовательно, стратегии на основе их ингибирования могут оказывать воздействие на другие клетки.
К ряду других мишеней с предпочтительной экспрессией в ОСК можно отнести поверхностные маркеры, как, например, CD44, CD90, CD33, и CD133 (Mallard B.W.,Tiralongo J., 2017; Jang J.W., Song Y.,Kim J et al.,2017), помпа АТФ-связывающих кассетных транспортеров и множественной лекарственной устойчивости (Ding X.W. Wu J.H.,Jiang C.P.,2010), и маркеры микроокружения (как CXCL12/CXCR4 и VEGF/VEGFR) (Wang X.,Cao Y.,Zhang S.et al., 2017).
Вторая же стратегия основывается на применении онколитических вирусов для таргетирования ОСК. Онколитические вирусы представляют собой перспективный класс компетентных по репликации вирусов, которые во многих случаях выходят на передовой уровень онкологии посредством клинических испытаний, и один из заявленных вирусов уже получил одобрение Администрации США по лекарственными препаратам и пищевым продуктам (FDA USA) для терапии меланомы (Fukuhara H.,Ino Y.,Todo T.,2016; Lawler S.E.,Speranza M.C.,Cho C.F., Chiocca E.A., 2017; Borrego-Diaz E., Mathew R.,Hawkinson D., 2012). Предполагается, что ряд подобных вирусов способен уничтожать ОСК. Группа ученых Shabbir A., Esfandiar T., Farassati F. (2018) занялась разработкой и оценкой мутированных версий вируса herpes simplex-1, которые могут нацеливаться на ОСК. Работа команды A.Shabbir, Esfandiar T., Farassati F. (2018) крайне важна, так как их данные показали, что таргетирование подобной неосновной популяции может эффективно ингибировать рост опухолевых клеток in vitro и вызывать существенную регрессию в установленных моделях гетеротопических и ортотопических опухолях на животных. Дальнейшие исследования по таргетированию ОСК могут привести к разработке высокоэффективных противораковых средств с минимальным количеством побочных эффектов.
С позиций современной онкологии и новых знаний о молекулярной биологии рака и других злокачественных опухолей научное определение термина «рак» или «злокачественное новообразование» (ЗНО) можно сформулировать следующим образом: рак и другие ЗНО это онкологические заболевания человека, обусловленные минимальным генетическим повреждением и накоплением критического количества (4—5 мутаций) анеуплодий в ядре тканеспецифичной стволовой клетки (СК) человека в результате неблагоприятного (канцерогенного) воздействия на неё клеток микроокружения и факторов внешней среды, которое приводит к формированию ОСК с неопластическим фенотипом из ОСБ, неконтролируемыми эффекторными функциями (пролиферации, деления, миграции, репродукции и т.д.) и способностью к уклонению от регуляторного надзора и контроля клеток собственной иммунной системы человека.
Уклонение ОСК и её потомков от надзорных киллерных клеток собственной иммунной системы человека является центровым механизмом канцерогенеза и приводит к потере системного контроля иммунитета над общим количеством ОК в организме, что сопровождается бурным опухолевым ростом, гипоксией и нарушением функции вовлеченного в неопластических процесс органа или ткани. В данном механизме заболевания представлены и эксплуатируются все основные молекулярно-биологические характеристики рака, которыми оперирует современная онкология. На механизмах уклонения ОК от контроля специализированных киллерных клеток иммунной системы мы остановимся ниже в следующих главах. Но именно недостаточность надзора иммунной системы за «оборотом» ОК в организме человека и считается краеугольной причиной опухолевого роста и возникновения неконтролируемого количества ОК в организме онкологического пациента.
Вообще, наличие ОК и допустимое количество ОК в организме здорового человека является предметом научной дискуссии. По мнению известного американского онколога W.R. Shapiro (1982), в норме, у каждого здорового человека, имеется около 500 000 (5х105) ОК. Их появление обусловлено естественными сбоями и ошибками в процессах физиологической регенерации и естественного самообновления клеток организма человека в саногенезе. Однако собственная иммунная система способна и должна контролировать это количество ОК в организме человека, и рак не развивается, когда у больного сохранны молекулярно-биологические механизмы врожденного и приобретенного противоопухолевого иммунитета а тканеспецифические стволовые клетки способны контролировать ОСК. Установлено, что иммунная система способна самостоятельно распознать и элиминировать опухоль, когда количество клеток в ней не превышает 5х105 клеток (W.R. Shapiro, 1982). При аутопсии людей умерших от несчастных случаев, травмы не совместимой с жизнью или от острой сердечной недостаточности у них находили бессимптомные злокачественные опухоли в виде осункованных объемов значительно большего количества ОК, но генерализации опухоли и метастазирования при этом не отмечалось (Олюшин В. Е. с соавт.,2012). Таким образом, проблема рака и других ЗНО это проблема количественного контроля и надзора клеток иммунной системы в организме больного человека над ОК и ОСК.
Как утверждает W.R.Shapiro (1982), когда количество ОК не превышает более 1х109 (<1 миллиарда), то это состояние диагностируется как «предрак», а когда количество ОК становится больше 1х109, то диагностируется рак. В то же время показано, что после радикальной хирургической операции в организме онкологического пациента остается 1—5 х109 ОК (Арчаков А. И.,2014). Радио- и химиотерапия позволяет в лучшем случае уменьшить количество ОК в организме до 1х107 (Shapiro W.R., 1982, Черных Е. Р. с соавт,2010). Таким образом, что бы ожидать выздоровления, нужно еще, как минимум, на 2 порядка уменьшить количество ОК в организме (Черных Е. Р., Ступак В. В., Центнер М. И. с соавт.,2004). Однако, как утверждает Давыдов М. И. (2017), «однажды пропустив рак, иммунная система пациента вряд ли сможет его догнать…» и начать снова контролировать количество ОК.
Другими словами, современные циторедуктивные хирургические методы лечения опухолей способны удалить количество ОК только до 109, так как ниже этого количества глаз человека не способен различить опухоль даже с использованием микрохирургической техники и флюоресцентных методов интраоперационной диагностики ОК. Химиотерапия (ХТ) и лучевая терапия (ЛТ) опухолей работают в диапазоне от 1х109 до 1х107 ОК на уровне цитостатического и цитотоксического воздействия на ОК. Поэтому при чувствительности опухоли к ХТ и ЛТ проведение дополнительных линий ХТ и ЛТ не целесообразно и научно не обосновано. При количестве ОК от 1 х107 до 1х105 должна работать собственная иммунная система, а точнее её клеточное и гуморальное звено. Поэтому стимулирование иммунной системы иммунопрепаратами и другие современные методы неспецифической и специфической, активной и пассивной адоптивной иммунотерапии (ИТ) рака способны регулировать работу иммунной системы именно в этом диапазоне ОК. Очевидно, что ИТ рака должна являться непосредственным продолжением любой конвенциональной противоопухолевой терапии, направленной на снижение общего количества ОК в организме больного и служить её логичным завершением. Не проведение ИТ онкологическим пациентам обрекает их на высокую вероятность прогрессирования и рецидива заболевания, как только будут вновь сформированы благоприятные условия для выживания ОСК и спящих ОК.
К сожалению, когда в результате проведенного стандартного противоопухолевого лечения (хирургии, ХТ, ЛТ) количество ОК становится ниже 105 клеток, контроль над количеством ОК может быть обеспечен только механизмами клеточной регуляции системами врожденного иммунитета, обеспечивающими жесткий контроль над функциями ОСК и элиминации оставшихся ОК. Можно ли «спротезировать» эти регуляторные иммунные воздействия клеточных систем врожденного иммунитета современными онкоиммунными лекарственными препаратами и добиться достаточной элиминации ОК? Скорее всего, да. Однако, очевидно, что эти попытки искусственного иммунного надзора не способны обеспечить системный контроль над эффекторными функциями ОСК (пролиферацией, миграцией, митозами, метастазированием и т.д.), а также осуществить полное уничтожение оставшихся (резидуальных) ОК в организме больного. Поэтому спонтанное выздоровление или излечение от рака после комплексного противоопухолевого лечения не реально и не возможно, так как в организме больного не мобилизуются фундаментальные механизмы противоопухолевого саногенеза, изучение и понимание которых, может позволить создать новые протоколы иммунокоррекции механизмов врожденного иммунитета (Личиницер М. Р.,2016).
Стоит отметить, что, несмотря на достижения современной науки, по-прежнему актуальным и неразрешенным остается вопрос комбинирования различных подходов с иммунотерапией опухоли и традиционных методов лечения в рамках единой программы для онкологических пациентов. Благодаря данным фундаментальных исследований в онкологии в настоящее время в медицинской среде сформировалось целостное видение особой роли, которую способна играть иммунная система в терапии онкологического процесса. С одной стороны, стимуляция ответа опухолеспецифических иммунокомпетентных клеток способна пресекать, либо существенно ограничивать процесс роста и распространения раковых клеток в организме, однако, с другой стороны, также известно о негативном влиянии микроокружения опухоли, которое напрямую задействует иммунные клетки в патологический процесс и благодаря секреции ряда факторов поляризует иммунокомпетентные клетки в толерантные подтипы, усугубляя злокачественный процесс в организме больного. Это способствует появлению большого количества химио- и радиорезистентных и иммунологически не чувствительных ОК и ОСК, находящихся в «спящем» состоянии.
Исследование «спящего» состояния раковых клеток и изучение их роли в механизмах и последствиях рецидивов и метастазирования рака и других злокачественных новообразований является наиболее важным фундаментальным аспектом изучения биологии рака последнего времени. Проблема заключается в том, что метастазирование болезни и ее рецидивы, появляющиеся спустя несколько лет (даже несколько десятилетий) после хирургической ремиссии у многих больных, перенесших онкологические заболевания, и это воспринимается и обозначается учеными как «спячка» опухоли (tumor dormancy). Однако достоверные знания относительно данного явления до настоящего времени остаются крайне ограниченными. Значительное количество проделанных работ и научных обзоров (Х.Gao et al.2017) суммировали три основные потенциальные модели, которые могут послужить объяснением подобного процесса, и к ним можно отнести ангиогенную спячку, иммунологическую спячку, и клеточную спячку. Очень важно для биологии рака обсудить только что приоткрытые механизмы, лежащие в основе спячки раковых клеток.
Основное внимание в области «спящих» ОК в большинстве работ уделяется взаимовлиянию, происходящему между «спящими» или дормантными раковыми клетками и их микросредой. Кроме того, важно понимать потенциальные механизмы реактивации подобных спящих клеток в определенных анатомических участках организма человека, в том числе в лимфоузлах и костном мозге. Также в подобных процессах важно понимать молекулярный механизм клеточной спячки при раке и других ЗНО.
Как мы уже отмечали выше, рецидивы опухоли и метастазирование при некоторых видах онкогенеза могут возникать спустя годы и даже десятилетия после проведенного лечения, причиняя огромный вред пациентам, и именно они несут ответственность за подавляющее большинство смертельных случаев, связанных с онкогенезом. Неспособность предотвратить и устранять метастазирование ОК, согласно большинству литературных обзоров, представляет собой наиболее существенную трудность, с которой сталкиваются современные врачи-онкологи (Х.Gao et al.2017). Последнее время, обширный временной период, при котором больные остаются бессимптомными до образования метастазов и рецидива, представляет собой период клинических наблюдений, известный как состояние покоя опухоли (опухолевая спячка). Подобное явление в настоящее время попало под пристальное внимание ученых онкологов всего мира. Состояние покоя опухоли впервые было определено R. Willis (Willis R.A. 1934), и затем R. Hadfield (1954) заново охарактеризовал это явление как временную митотическую и ростовую задержку. Митотическая задержка в точности соотносится с дремлющим состоянием клеток, что предполагает факт существования G0-G1 фазы задержки клеточного цикла в каких-либо конкретных раковых клетках (Goss PE, Chambers AF., 2010). Задержка роста ОК означает дремлющую канцерогенную массу, в которой компоненты раковых клеток сохраняются в постоянном количестве за счет баланса между делением клеток и их апоптозом. Помимо того, современные научные источники дают основания для предположения, что сохранение постоянной численности ОК может происходить как вследствие ангиогенной, так и/или иммунологической спячки ОК (Aguirre-Ghiso JA., 2007; Rakhra K, Bachireddy P, Zabuawala T, et al.,2010; Kareva I.,2016). Широко известен тот факт, что остаточные раковые клетки непрерывно сталкиваются с различными сдерживающими рост состояниями во время распространения и туморогенного прогрессирования, как, например, гипоксией, истощением и воздействием химиотерапии (Osisami M, Keller ET.,2013; Rankin EB, Giaccia AJ.,2016). Эти раковые клетки могут секретировать ряд факторов в целях модулирования своих сигнальных путей, имеющих отношение к росту, через механизм взаимовлияния между остаточными раковыми клетками и их микросредой, что приводит к состоянию покоя или пролиферации. Остаточные раковые клетки могут уклоняться от иммунологического надзора и летального воздействия химиотерапии при тяжелых состояниях выживания за счет задержки роста. Тем не менее, они могут покинуть состояние покоя (спячки) и пролиферировать снова в отдаленных органах.

