
Полная версия
Внутренние болезни
Этиология. Возбудителем заболевания может быть любой инфекционный агент (бактерии, грибы, сальмонеллы и др.), но у абсолютного большинства больных (около 95 %) развитие заболевания обусловлено бактериальной инфекцией, наиболее часто – зеленящим стрептококком (30 – 60 %), стафилококком (30 – 40 %). В последние годы существенно увеличилась частота инфекционного эндокардита, вызванного грамотрицательной флорой (синегнойная палочка, энтеробактерии) и грибами. Грибковый эндокардит наиболее часто возникает у больных после протезирования клапанов сердца. По данным различных лабораторий, у 5 – 25 % больных даже при повторных посевах крови возбудителя обнаружить не удается, что чаще всего обусловлено предварительной антибактериальной терапией.
Патогенез. В развитии заболевания решающее значение имеют два фактора: наличие возбудителя в крови (бактериемия) и условий, благоприятствующих его оседанию (колонизации) на эндокарде (эндотелии).
Кратковременная бактериемия достаточно часто возникает в организме (экстракция зубов, воспалительные заболевания, операции и инструментальные процедуры на органах урогенитального тракта и др.).
Обычно инфекционный агент достаточно быстро исчезает из крови и уничтожается. Наиболее существенными факторами, способствующими колонизации возбудителя, является его вирулентность и изменения эндотелия (повреждение). Повреждение эндотелия чаще отмечается у пациентов с пороками сердца, особенно при наличии значительного градиента давления между двумя камерами (пороки аортального и митрального клапана, дефект межжелудочковой перегородки). Гемодинамический удар о стенку в сочетании с нарушениями кровотока (турбулентность) создают благоприятные условия для повреждения эндотелия и формирования в местах повреждений стерильных микротромбов (небактериальный тромботический эндокардит). Небактериальный тромботический эндокардит часто возникает также после операций на сердце, при длительном наличии в сосудах катетеров. При наличии абактериальных тромбов инфекционные агенты оседают на них. Так возникает локальный инфекционный очаг в сердечно-сосудистой системе. Риск инфицирования эндотелия значительно возрастает при поступлении в кровоток инфекционных агентов, обладающих высокой адгезивностью.
Дополнительным фактором, способствующим возникновению инфекционного эндокардита, является снижение противоинфекционной защиты организма (хронические заболевания, длительная терапия цитостатиками, глюкокортикоидами, антибиотиками).
Длительное наличие инфекционного агента в организме в сочетании с постоянной антигенной стимуляцией продуктами распада тканей приводят к выработке антител против этих антигенов с увеличением в крови количества циркулирующих иммунных комплексов и их отложением в органах и тканях. Присоединение иммунного компонента при инфекционном эндокардите приводит к изменению клинико-лабораторных проявлений заболевания (васкулиты, нефрит, асептический миоперикардит).
Морфология. При инфекционном эндокардите выявляются типичные морфологические изменения: наличие полипозных инфицированных образований (вегетаций) с некрозами прилежащих тканей, формированием изъязвлений, перфорацией и надрывами клапанов. Нередко выявляются абсцессы в области клапанных колец, реже – в миокарде. При присоединении иммунных нарушений наблюдаются типичные для васкулита и нефрита морфологические изменения (отложения иммунных комплексов в субэндотелии, мезангии с типичными вторичными пролиферативно-воспалительными и некротическими изменениями).
Классификация инфекционных эндокардитов отражает исходное (до начала заболевания) состояние сердечно-сосудистой системы, этиологию, локализацию патологического процесса, остроту течения, наличие осложнений (табл. 1.12).
Таблица 1.12
Классификация инфекционного эндокардита

С учетом исходного состояния сердечно-сосудистой системы различают первичный и вторичный инфекционный эндокардит. Первичный эндокардит возникает при исходно интактном сердце, вторичный – у больных с предсуществовавшими изменениями сердца и крупных сосудов (пороки, кардиомиопатии, аневризмы и др.).
Острый инфекционный эндокардит является одним из проявлений острого сепсиса. Поэтому под термином инфекционный эндокардит обычно подразумевают заболевание подострого течения (в прошлом использовался термин подострый инфекционный эндокардит).
Клиническая картина. Клинические проявления чрезвычайно разнообразны – от картины сепсиса до малосимптомного течения. Малосимптомное течение более характерно для лиц пожилого возраста и пациентов с предсуществовавшей сердечной недостаточностью.
Клиническая картина инфекционного эндокардита складывается из проявлений, обусловленных наличием инфекции, локализацией местных изменений (формирование недостаточности пораженного клапана), иммунологическими нарушениями и осложнениями.
Наиболее характерным признаком инфекционного эндокардита является повышение температуры (наблюдается у 85 – 92 % пациентов). Гектическая лихорадка более типична для эндокардита, вызванного стафилококком, кишечной и синегнойной палочкой. При наличии провоцирующего события (экстракция зуба, инфицированная рана и др.) лихорадка появляется через 1 – 2 недели. Лихорадка обычно сочетается с ознобами, потливостью, недомоганием, артралгиями и миалгиями, ухудшением аппетита.
Приблизительно у трети больных выявляются проявления геморрагического диатеза, обусловленные повышением проницаемости сосудистой стенки и васкулитами. У 10 – 20 % больных возникают эмболии (в мозг, почки, сердце, легкие и в другие органы) с возможным формированием абсцессов, у 80 – 90 % пациентов отмечаются проявления сердечной недостаточности. При физикальном исследовании обращает на себя внимание бледность больных, наличие петехий (на конъюнктиве, слизистых, коже), пятен Джейнуэя (мелкие геморрагические высыпания на ладонях и стопах), узелков Ослера (мелкие болезненные узелки на пальцах).
При исследовании сердечно-сосудистой системы наблюдается тахикардия и проявления, связанные с локализацией патологического процесса на клапанах, скоростью и выраженностью формирования недостаточности клапана, а также предсуществовавшей патологией. Как правило, выявляется различная степень кардиомегалии, при аускультации – данные за наличие формирующейся недостаточности пораженного клапана. Достаточно характерна динамичность аускультативных изменений. У ряда больных шумы могут появляться или резко изменяться внезапно (перфорация, отрыв створки, разрыв хорды). При выраженной аортальной недостаточности будут представлены и ее периферические симптомы (быстрый пульс, высокое пульсовое давление, пульсация крупных артерий).
Наличие сердечной недостаточности и эмболий проявляется соответствующими изменениями (гепатомегалия, отеки, застой в легких). Приблизительно у 1/3 больных выявляется спленомегалия.
Лабораторная и инструментальная диагностика. При исследовании крови отмечается нормохромная анемия, сдвиг лейкоцитарной формулы влево при повышенном или нормальном количестве лейкоцитов, тромбоцитопения, увеличение СОЭ. Биохимические данные характеризуются воспалительными изменениями (наличие С-реактивного белка, повышение фибриногена, α2– и γ – глобулинов, положительная тимоловая проба), у 50 % больных выявляется ревматоидный фактор, увеличение количества циркулирующих иммунных комплексов, снижение титра комплемента, у отдельных больных – ложноположительная реакция Вассермана.
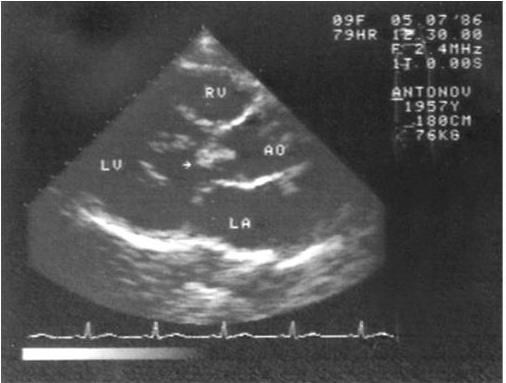
Рис. 1.7. Эхокардиограмма больного инфекционным эндокардитом. Вегетация (указана стрелкой) на аортальном клапане
Наиболее существенным методом диагностики являются повторные посевы крови. Забор крови желательно производить до начала антибактериальной терапии из разных вен в количестве 10 – 15 мл 3 – 5 раз с интервалом не менее 15 мин. при остром эндокардите и 3 – 5 проб с интервалом 4 – 6 ч – при подостром. Положительными считаются результаты, при которых рост одного и того же возбудителя отмечается в большинстве проб. При бактериальном эндокардите при соблюдении всех правил забора и культивирования крови возбудитель выявляется у 90 – 95 % больных, предварительно не получавших антибиотики. Отрицательные результаты обычно отмечаются у больных, длительно получавших антибактериальную терапию, а также при грибковых и вирусных миокардитах. Поэтому в целом частота отрицательных результатов посевов крови составляет около 20 – 35 %.
Присоединение гломерулонефрита проявляется типичными изменениями мочи (протеинурия, наличие эритроцитов и цилиндров).
Результаты рентгенологического и ЭКГ-исследования отражают изменения сердца, обусловленные формулирующимся пороком и предсуществовавшей патологией.
Наиболее информативным инструментальным методом исследования является эхокардиография, особенно транспищеводная, выявляющая достаточно мелкие вегетации (не менее 5 мм) и сопутствующие изменения клапанного аппарата (рис. 1.7). Вегетации обычно появляются не раньше, чем через 2 недели после начала заболевания и длительно сохраняются после выздоровления (несколько месяцев). Ультразвуковое исследование, как правило, выявляет увеличение размеров селезенки.
Диагноз инфекционного эндокардита считается достоверным при наличии лихорадки, шума в сердце, эмболий, бактериемии, вегетаций по данным эхокардиографического исследования. При необнаружении вегетаций диагноз оценивается как вероятный, а наличие лихорадки неизвестного генеза в сочетании с эмболиями и/или шумом в сердце является критерием возможного инфекционного эндокардита.
В диагнозе необходимо отразить характер заболевания (первичный, вторичный), при положительных результатах посевов – этиологию, характер предсуществовавшей патологии, локализацию местных изменений, осложнения.
Примеры формулировки диагноза:
1. Первичный инфекционный эндокардит, вызванный зеленящим стрептококком, аортальная недостаточность.
2. Вторичный инфекционный эндокардит митрального клапана. Сложный митрально-аортальный порок ревматической этиологии. Эмболический инфаркт миокарда 12.07.98. Сердечная недостаточность III ф. к. по NYHA.
Дифференциальный диагноз. Поскольку проявления инфекционного эндокардита чрезвычайно разнообразны, то его приходится дифференцировать со многими заболеваниями. Это диффузные заболевания соединительной ткани, васкулиты, лимфомы и другие злокачественные новообразования. У лиц с ревматическими пороками сердца появление симптомов инфекционного эндокардита нередко длительно трактуется как рецидив ревматизма. У любого больного с лихорадкой невыясненного происхождения необходимо исключить инфекционный эндокардит.
Решающее значение в постановке правильного диагноза имеет ежедневная внимательная аускультация сердца (появление новых шумов регургитации или изменения характера предсуществовавших шумов), данные эхокардиографического и бактериологического исследований.
Течение. Острый инфекционный эндокардит протекает по типу острого сепсиса. Особенности течения подострого эндокардита обусловлены характером возбудителя, путем его поступления, возрастом больных и наличием сердечной недостаточности. В частности, для грибкового эндокардита характерны крупные вегетации, выявляемые при эхокардиографическом исследовании, эмболии крупных артерий большими эмболами и быстрое разрушение клапана. Инфекционный эндокардит наркоманов обычно локализован на трехстворчатом, реже – пульмональном клапане и часто осложняется повторными эмболиями в малый круг кровообращения.
Эндокардит, вызванный гемолитическим стрептококком, обычно хорошо поддается терапии пенициллином. Особенно тяжело протекает инфекционный эндокардит протеза клапана, что обусловлено быстрым развитием дисфункции протеза, приводящей к сердечной недостаточности. Для пожилых пациентов и больных с предсуществовавшей сердечной недостаточностью более характерна стертая клиническая картина.
Прогноз. Исходы. Исключительно редко инфекционный эндокардит заканчивается полным выздоровлением. Это возможно лишь при ранней диагностике и начале терапии до развития деструктивных изменений клапанного аппарата. У большинства больных исходом заболевания является формирование недостаточности пораженного клапана, требующее в последующем хирургической коррекции.
В настоящее время, благодаря своевременной диагностике и активной терапии, включающей хирургические методы лечения, летальность больных резко снизилась. Причинами смерти больных обычно являются эмболии и сердечная недостаточность, при остром эндокардите возможно развитие бактериального шока. У больных, перенесших инфекционный эндокардит, высок риск рецидивов заболевания. Для своевременного выявления ранних рецидивов рекомендуется производить посев крови через 2 – 6 недель после отмены антибактериальной терапии.
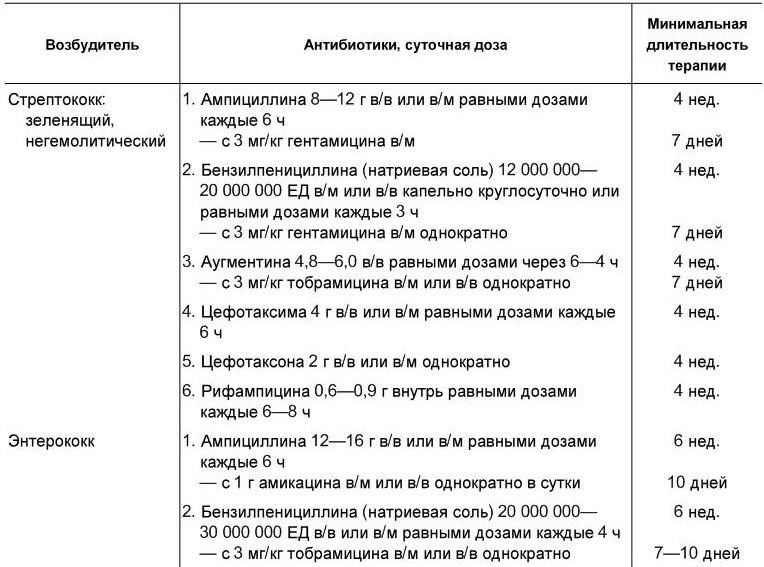
Лечение. Диагноз инфекционного эндокардита или подозрение на его наличие – повод для госпитализации больного. Основа терапии – антибактериальные препараты. Лечение начинают сразу же после взятия крови на посев, а при остром течении – немедленно после постановки диагноза. В первые дни (до получения результатов посева крови) препараты подбираются эмпирически. Обычно исходят из того, что наиболее часто возбудителями являются стрептококки. После получения данных о возбудителе и его чувствительности в терапию вносятся коррективы [Гогин Е. Е., Тюрин В. П., 1997]. Рекомендуется комбинированное введение антибиотиков парентерально в полных терапевтических дозах (табл. 1.13). При грибковых эндокардитах обычно используется амфотерицин В. Он вводится медленно капельно внутривенно в дозе не менее 1,0 г в сутки.
Таблица 1.13
Антибиотики, применяемые при инфекционном эндокардите в зависимости от этиологии болезни
[Гогин Е. Е., Тюрин В. П., 1997]

Длительность терапии определяется исчезновением клинико-лабораторных признаков воспаления, но она не должна быть короче четырех недель даже при самом благоприятном ответе на терапию. Как правило, снижение температурной реакции отмечается через 3 – 7 дней после начала терапии. Длительная антибактериальная терапия может осложняться различными побочными действиями, в том числе ухудшением функционального состояния почек. Нефротоксичность наиболее характерна для гентамицина.
Исключительно редко используются глюкокортикоиды. Их назначение допустимо лишь у больных с иммунными осложнениями (нефрит, васкулит) в малых дозах (15 мг преднизолона) на фоне антибактериальной терапии. Достаточно широко применяются хирургические методы лечения – протезирование пораженного клапана, сочетающееся в случае необходимости с санацией полостей сердца. Показаниями к хирургическому лечению являются инфекционный эндокардит протезированного клапана, абсцесс фиброзного кольца или миокарда, отсутствие эффекта от адекватной медикаментозной терапии в течение 2 – 3 недель, серьезные деструктивные изменения клапанного аппарата, грибковый эндокардит. В квалифицированных кардиохирургических центрах летальность не достигает 5 %.
Профилактика. Поскольку инфекционный эндокардит наиболее часто развивается у лиц с предсуществовавшими изменениями сердечно-сосудистой системы (пороки сердца, кардиомиопатии, пролапсы клапанов и т. д.), то этим больным рекомендуется профилактическое назначение антибиотиков перед выполнением любых вмешательств, которые могут привести к бактериемии (оперативные вмешательства на органах желудочно-кишечного тракта, мочеполовой системы, на инфицированных тканях, все стоматологические вмешательства, при которых возможно кровотечение, эндоскопическое исследование с биопсией и др.).
Наиболее часто профилактически назначается амоксициллин (внутрь 3,0 г за час до вмешательства и 1,5 г – через 6 часов после него). При вмешательствах на органах желудочно-кишечного тракта и мочеполовой системы рекомендуется его сочетание с гентамицином (80 мг за час до вмешательства внутримышечно). При аллергии к амоксициллину могут использоваться и другие антибиотики (ампициллин 3,0 г внутрь за час до и через 6 часов после процедуры, эритромицин 1,0 внутрь до и 0,4 г через 6 часов после вмешательства и др.).
РЕВМАТИЗМ
Определение. Ревматизм – системное воспалительное заболевание соединительной ткани токсико-иммунного генеза с преимущественной локализацией изменений в сердечно-сосудистой системе, развивающееся в результате перенесенной острой инфекции β-гемолитическим стрептококком группы А у предрасположенных к нему лиц.
Распространенность ревматизма широко колеблется в различных странах. В благополучных в экономическом отношении государствах количество впервые возникших случаев ревматизма не достигает 0,07 случаев на 1000 населения в год, в развивающихся странах оно составляет около 10 на 1000 населения в год. Заболеваемость ревматизмом в целом по России невысока, однако в настоящее время отмечается тенденция к росту, особенно в социально неблагополучных регионах.
Хотя острый ревматизм отмечается во всех возрастных группах, но наиболее часто он возникает у детей и подростков (в возрасте 5 – 15 лет). В развивающихся странах частота новых случаев ревматизма в год среди детей и подростков составляет 2,3 – 3,3 %.
Этиология. Развитие ревматизма связано с острым воспалением, обусловленным β-гемолитическим стрептококком группы А. Наиболее часто процесс локализован в носоглотке (фарингит, ангина). Острые воспалительные заболевания носоглотки возникают достаточно часто, однако последующее развитие ревматизма отмечается не более чем у 3 % людей. Это обусловлено рядом факторов. Наиболее существенными из них являются особенности возбудителя, социальные условия и особенности состояния организма человека, переносящего острую фарингеальную инфекцию.
Ревматизм, как правило, развивается после инфицирования штаммами А-3, -5, -18, -19 и -24 β-гемолитического стрептококка. Особенностью микробов этих штаммов является наличие в их оболочке М-белка и высокое содержание гиалуроновой кислоты. Из социальных факторов наиболее существенным является скученность населения, облегчающая прямую передачу вирулентных штаммов. В развитии ревматизма может иметь значение и наследственная предрасположенность, однако ее конкретные механизмы до настоящего времени не выяснены. Наконец, развитию заболевания способствуют погодные условия (холод, высокая влажность).
Патогенез ревматизма связан как с иммунными, так и с неиммунными нарушениями. Многие токсины и биологически активные вещества, выделяемые стрептококком (стрептолизин, гиалуронидаза, дезоксирибонуклеаза), оказывают прямое влияние на миокард (кардиотоксичность), соединительную ткань (деполимеризация), тучные клетки и нейтрофилы (дегрануляция с освобождением белков, стимулирующих воспаление). М-белок угнетает фагоцитарную активность макрофагов и нейтрофилов, С-белок (стрептопептид) оказывает тормозящее действие на лимфоциты-супрессоры.
Поступление в организм стрептококковых антигенов стимулирует выработку антител. Многие антигены имеют близкую структуру с белками кардиомиоцитов. Поэтому противострептококковые антитела могут перекрестно реагировать с белками кардиомиоцитов. Определенное место в патогенезе имеют и циркулирующие иммунные комплексы, элиминация которых макрофагами снижена.
Морфология. Классическим морфологическим проявлением ревматизма является наличие в соединительной ткани типичных ревматических гранулем (Ашоффа – Талалаева), сочетающихся с морфологическими признаками неспецифического воспаления – отеком и фрагментацией коллагеновых волокон, фибриноидным некрозом, деполимеризацией основного вещества соединительной ткани. Эти изменения выявляются у всех больных в миокарде (ревматический миокардит). Приблизительно у 30 % больных с первой атакой ревматизма в патологический процесс вовлекается клапанный аппарат сердца, где наблюдаются характерные для ревматического эндокардита бородавчатые изменения (бородавчатый вальвулит). Чаще поражаются митральный и аортальный клапаны, реже – трехстворчатый и исключительно редко – клапаны легочной артерии. Возможно развитие перикардита. К внесердечным проявлениям ревматизма относятся поражения суставов и внутренних органов. В суставах преобладают экссудативные изменения. Вовлечение в патологический процесс легких, плевры, почек, печени и других органов наблюдается редко, у детей возможны ревматические изменения центральной нервной системы (хорея).
Классификация. В настоящее время нет общепринятой в мире классификации ревматизма. В нашей стране принята рабочая классификация ревматизма, в соответствии с которой выделяют активную и неактивную фазы ревматизма, оценивают остроту течения, наличие органных изменений и состояние кровообращения (табл. 1.14).
При остром течении ревматизма все клинико-биохимические изменения, свидетельствующие об активности процесса, ликвидируются в срок до 3 месяцев, при подостром – в течение 3 – 6 месяцев, при затяжном – в срок более 6 месяцев. Непрерывно рецидивирующее течение характеризуется постоянным обострением процесса, латентное – минимальными клинико-лабораторными проявлениями. Для активности III степени типичны яркие клинические проявления ревматизма в сочетании с выраженными лабораторными изменениями (нейтрофильный лейкоцитоз, СОЭ > 40 мм в час, резкое увеличение содержания фибриногена, С-реактивного белка, α2-глобулинов в крови, высокие титры антител к антигенам стрептококка). При активности II степени отмечается меньшая выраженность клинико-лабораторных изменений, а при I степени активности – минимальные изменения.
Таблица 1.14
Рабочая классификация ревматизма

Клиническая картина. Проявления ревматизма обычно возникают через 2 – 3 недели после фарингита или ангины. Клиническая картина острого ревматизма складывается из неспецифических изменений, обусловленных воспалением, и симптомов, связанных с преимущественной локализацией местных изменений. К признакам первого типа относятся лихорадка, выраженность которой широко варьирует у различных больных, слабость, потливость, ухудшение аппетита. К классическим проявлениям, обусловленным локализацией местных воспалительных изменений, относятся полиартрит, кардит, кольцевидная эритема, хорея и ревматические узелки.
Ревматический полиартрит отмечается приблизительно у 30 % больных. Он характеризуется наличием местных воспалительных изменений крупных и средних суставов (отек, гиперемия, ограничение функции, боли), нередко имеющих мигрирующий характер и быстро полностью проходящих при приеме нестероидных противовоспалительных препаратов. У части больных отмечаются лишь боли в суставах (артралгии) и мышцах (миалгии).
Наиболее частое ревматическое поражение сердца – миокардит. У взрослых и подростков он обычно протекает достаточно легко и проявляется неопределенными неинтенсивными болевыми ощущениями в области сердца (кардиалгии), незначительной одышкой, тахикардией, наклонностью к гипотонии. При объективном исследовании может выявляться умеренная кардиомегалия, глухость тонов, систолический шум над верхушкой сердца, обусловленный дисфункцией папиллярных мышц. У части пациентов эти изменения выражены минимально. Тяжелое течение ревматического миокардита чаще отмечается у детей. В этих случаях быстро развивается кардиомегалия, проявления сердечной недостаточности, а при объективном исследовании выявляется резкая глухость тонов, патологические III и IV тоны, интенсивный шум митральной регургитации.
Наличие перикардита обычно проявляется достаточно интенсивными болями в области сердца постоянного характера, иногда с усилением на вдохе, а при физикальном исследовании – шумом трения перикарда. Большой выпот в полость перикарда не характерен для ревматического перикардита.
Ревматический эндокардит обычно диагностируется ретроспективно – при формировании через несколько месяцев порока сердца.
Подкожные ревматические узелки в области суставов, кольцевидная эритема и хорея относятся к редким проявлениям ревматизма. К числу редких проявлений ревматизма относятся также васкулиты, нефрит и изменения со стороны других внутренних органов.
Лабораторная и инструментальная диагностика. Ревматизм протекает с выраженными лабораторными изменениями. Типично наличие воспалительных изменений со стороны крови – нейтрофильный лейкоцитоз, увеличение СОЭ, высокое содержание С-реактивного белка, α2– и позднее – γ – глобулинов, фибриногена, при тяжелом миокардите возможно повышение активности ферментов, свидетельствующих о поражении кардиомиоцитов. Более специфично увеличение титра антистрептококковых антител (антистрептолизин О, антигиалуронидоза, антистрептокиназа). У многих больных повышен титр циркулирующих иммунных комплексов и снижено содержание комплемента. При посеве из зева обычно выявляется рост β-гемолитического стрептококка.









