
Полная версия
Внутренние болезни
Из инструментальных исследований наиболее существенна ЭКГ, на которой отмечаются изменения конечной части желудочкового комплекса (двухфазные, изоэлектричные, отрицательные зубцы Т), замедление атриовентрикулярной проводимости, нарушения ритма (обычно, экстрасистолы). Рентгенологически может наблюдаться кардиомегалия, при эхокардиографическом исследовании – гипокинезия левого желудочка, снижение фракции выброса и митральная регургитация.
Дифференциальный диагноз. При отсутствии яркой клинической картины ревматизм необходимо дифференцировать со многими заболеваниями, дающими близкие клинические проявления. К ним относятся тиреотоксикоз, нейроциркуляторная дистония, алкогольная дистрофия миокарда, безболевая форма ишемической болезни сердца. Но для всех этих состояний не характерны воспалительные изменения со стороны крови. Еще большие трудности возникают при дифференциальном диагнозе с заболеваниями, протекающими с воспалительными изменениями со стороны крови – неревматические миокардиты, диффузные заболевания соединительной ткани (склеродермия, системная красная волчанка), инфекционный эндокардит. У больных с пороками сердца, особенно при наличии сердечной недостаточности, нередко отсутствуют существенные биохимические изменения, свидетельствующие об активности ревматизма. Единственным проявлением активности в этих случаях может быть появление или нарастание сердечной недостаточности, присоединение нарушений ритма и проводимости. При исследовании крови у этих больных нередко выявляется анемия.
Диагноз активного ревматизма основывается на результатах клинико-лабораторных исследований. При этом обычно используют критерии Джонса. К основным критериям при постановке диагноза относятся: кардит, полиартрит, хорея, кольцевидная эритема и ревматические узелки. В дополнительные критерии входят клинические (лихорадка, артралгии, ревматизм в анамнезе или ревматический порок), лабораторные (увеличение СОЭ и наличие С-реактивного белка) и ЭКГ (замедление атриовентрикулярной проводимости) изменения. Сочетание двух основных или одного основного и двух дополнительных критериев рассматривается как достаточное основание для постановки диагноза.
В диагнозе отражается активность процесса и его степень, клинико-анатомические изменения, характер и особенности течения.
Примеры формулировки диагноза:
1. Ревматизм, активная фаза (III степень активности). Миокардит. Полиартрит.
2. Ревматизм, непрерывно-рецидивирующее течение (II степень активности). Комбинированный митральный порок с преобладанием недостаточности. Мерцательная аритмия. Сердечная недостаточность III ф. к. по NYHA.
Течение. У больных без пороков сердца ревматизм обычно протекает благоприятно. У больных с уже сформировавшимися пороками сердца активный ревматизм имеет склонность к затяжному течению. Особенно упорно протекают рецидивы ревматизма у больных с искусственными клапанами сердца.
Прогноз и исходы. У 70 % больных первая атака ревматизма заканчивается полным выздоровлением. У 30 % больных исходом является формирование порока сердца. При этом при высокой степени активности чаще формируется клапанная недостаточность, при низкой степени активности – стенозы. Однако раз перенесенный ревматизм всегда опасен возможностью рецидива. Каждый рецидив ревматизма резко увеличивает риск формирования порока сердца или же новых пороков на фоне предсуществовавшего клапанного дефекта, что в сочетании с рецидивами миокардита приводит к развитию и прогрессированию сердечной недостаточности.
Лечение. Наличие активного ревматизма – повод для госпитализации больного. Рекомендуется ограничение физической активности. Обязательной является антибактериальная терапия – пенициллин (около 6 млн ЕД в сутки), при непереносимости антибиотиков пенициллиновой группы – цефалоспорины. Длительность терапии – около 2 недель. Одновременно на 6 – 8 недель назначаются противовоспалительные нестероидные препараты (диклофенак – до 150 мг в сутки, ибупрофен – до 800 – 1000 мг в сутки, аспирин – 4,0 – 6,0 г в сутки и др.). Отсутствие эффекта от нестероидных препаратов – показание для назначения глюкокортикоидов. Назначение глюкокортикоидов изначально показано больным с тяжелым течением миокардита, а также лицам, переносящим активный ревматизм при наличии протезов клапанов. Начальная доза составляет 40 – 60 мг. Длительность терапии – около 4 – 6 недель. После стихания проявлений активности доза глюкокортикоидов снижается постепенно с переходом на нестероидные противовоспалительные препараты на 2 – 3 недели.
Профилактика. Первичная профилактика ревматизма сводится к улучшению социальных условий, адекватной терапии стрептококковой инфекции, в частности фарингитов. При наличии показаний выполняется тонзиллэктомия.
Все больные, перенесшие ревматизм, нуждаются во вторичной профилактике. Она заключается в ежемесячном введении 1 200 000 ЕД бициллина-5 в течение 5 лет. Во многих странах эти пациенты получают профилактически бициллин пожизненно.
МИОКАРДИТЫ
Определение. Миокардит – это заболевание, проявляющееся наличием воспалительных изменений в миокарде.
Распространенность. Истинная распространенность миокардитов не известна, что связано с отсутствием общепринятых критериев диагностики, наличием форм с латентным течением. Распространенность миокардитов в популяции не достигает 1 %. С наибольшей частотой миокардит диагностируется в возрасте 30 – 40 лет. Женщины болеют чаще, чем мужчины.
Этиология. Наиболее частыми причинами миокардитов являются инфекционные агенты (вирусы Коксаки А и В, гриппа, ЭКХО-вирусы и др.) и иммунные нарушения (ревматизм, диффузные заболевания соединительной ткани, аллергические заболевания). Миокардит может осложнять течение большинства инфекционных и аутоиммунных заболеваний, быть результатом химических, физических и токсических воздействий на миокард.
Патогенез. Особенности патогенеза миокардитов определяются их этиологией. При вирусных миокардитах вирус непосредственно проникает в кардиомиоциты, реплицируется и вызывает дистрофические и некробиотические изменения кардиомиоцитов с сопутствующими воспалительными реакциями. Миокардиты при воздействии многих инфекционных агентов (дифтерия, брюшной тиф), физических и химических факторов, некоторых медикаментов обусловлены токсическим повреждением кардиомиоцитов с вторичными воспалительными изменениями.
При туберкулезе, сифилисе, токсоплазмозе инфекционные агенты представлены непосредственно в миокарде.
В основе иммунных миокардитов также лежат далеко не одинаковые механизмы. В одних случаях превалирует повреждение миокарда из-за наличия иммунных комплексов, стимулирующих освобождение большого количества биологически активных веществ (гистамин, серотонин, брадикинин и др.), повреждающих как кардиомиоциты, так и сосуды микроциркуляторного русла (сывороточная болезнь, диффузные заболевания соединительной ткани). В других случаях превалируют реакции гиперчувствительности замедленного типа. Иммунные нарушения нередко возникают вторично в ответ на повреждение кардиомиоцитов (вирусы, токсины, физические агенты и др.). Они проявляются выработкой антител к измененным белками кардиомиоцитов (миозин, белки митохондрий и др.). Развитие вторичных иммунных нарушений обычно способствует утяжелению клинических проявлений миокардита и хронизации его течения.
Морфология. Морфологические изменения при миокардитах чрезвычайно разнообразны. Специфические изменения характерны лишь для ревматизма, сифилиса и туберкулеза. При миокардитах другой этиологии, как правило, выявляются неспецифические изменения. В острой фазе заболевания они проявляются дистрофическими и некробиотическими изменениями кардиомиоцитов, наличием отека интерстиция и лейкоцитарных инфильтратов. При хронически протекающих миокардитах эти изменения ассоциируются с наличием кардиосклероза.
Классификация. Общепринятой классификации миокардитов нет. Но во всех классификациях выделяется этиология (при возможности) и острота течения (табл. 1.15).
Таблица 1.15
Классификация неревматических миокардитов [Новиков Ю. И., 1983]
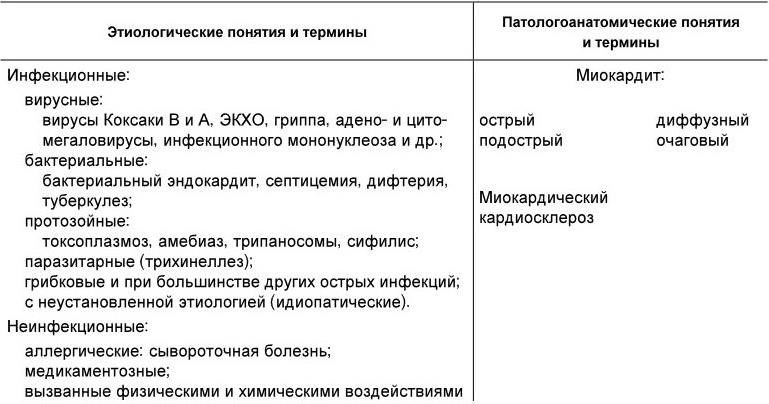
В ряде классификаций все миокардиты подразделяются на ревматические и неревматические, в других учитывается распространенность повреждения миокарда (очаговые, диффузные). Выделение очаговых и диффузных миокардитов в определенной мере условно, поскольку у большинства больных имеются диффузные изменения миокарда различной степени выраженности. Исключение составляют сифилитические и туберкулезные миокардиты, при которых специфические изменения имеют очаговый характер. В некоторых классификациях выделяются особенности течения (клинические варианты).
Клиническая картина складывается из проявлений заболевания, приведшего к развитию миокардита (ревматизм, дифтерия, вирусная инфекция и др.), и симптомов, обусловленных непосредственно поражением миокарда. Взаимосвязь между воздействием этиологического фактора и клиникой, обусловленной миокардитом, далеко не одинакова. При иммунных миокардитах между инициирующим воздействием и проявлениями миокардита обычно проходит 2 – 3 недели. Большинство инфекционных и токсических миокардитов развиваются в первые дни после или непосредственно в период воздействия этиологического фактора.
Клиническая картина миокардита представлена как неспецифическими симптомами, обусловленными воспалением, так и более специфичными признаками, связанными с поражением миокарда.
Наличие воспаления проявляется лихорадкой, чаще умеренной, слабостью, потливостью. Из симптомов, обусловленных поражением миокарда, наиболее частыми являются постоянные боли неопределенного характера в области сердца (кардиалгии), одышка, сердцебиения. При выраженных изменениях миокарда будут представлены признаки сердечной недостаточности.
При физическом исследовании больных нередко выявляются тахикардия, нарушения ритма, возможна тенденция к гипотонии. Приблизительно у половины больных наблюдается увеличение размеров сердца, приглушенность тонов, нежный систолический шум митральной регургитации из-за дисфункции папиллярных мышц. При тяжелом поражении миокарда выслушиваются патологические тоны сердца (III и IV).
Особенностью вирусных миокардитов является частое вовлечение в патологический процесс перикарда (миоперикардит), при дифтерийных миокардитах нередко выявляются серьезные нарушения проводимости, вплоть до полной атриовентрикулярной блокады.
Лабораторная и инструментальная диагностика. При лабораторном исследовании больных миокардитом обычно выявляются изменения, свидетельствующие как о наличии воспаления (нейтрофильный лейкоцитоз, увеличение СОЭ, повышение уровня С-реактивного белка, α2– и γ – глобулинов), так и о вовлечении в патологический процесс миокарда (повышение активности аминотрансфераз, лактатдегидрогеназы, особенно ЛДГ1, креатинфосфокиназы и др.).
Иммунологическое исследование свидетельствует об активации как гуморального (наличие антител к антигенам миокарда, циркулирующих иммунных комплексов, снижение титра комплемента), так и клеточного иммунитета. У больных вирусным миокардитом при исследовании в динамике с интервалами в 2 – 3 недели отмечается существенное нарастание титра специфических противовирусных антител.
При электрокардиографическом исследовании у абсолютного большинства больных (70 – 80 %) выявляются изменения зубца Т (уплощение, двухфазность, инверсия), сочетающиеся с разнообразными нарушениями ритма. У части пациентов наблюдается депрессия сегмента ST и нарушения проводимости. При улучшении состояния больного эти изменения подвергаются обратному развитию.
Размеры сердца при рентгенологическом исследовании могут быть как нормальными, так и увеличенными. При наличии сердечной недостаточности будут представлены признаки легочного застоя.
Эхокардиографическое исследование при тяжелом миокардите обнаруживает дилатацию полостей сердца, уменьшение фракции изгнания, митральную и трикуспидальную регургитацию, наличие тромбов в полостях.
При биопсии миокарда в биоптатах наблюдаются типичные воспалительные изменения.
Диагноз миокардита основывается на сочетании результатов клинических, лабораторных и инструментальных исследований. В сомнительных случаях для уточнения диагноза прибегают к биопсии миокарда.
В диагнозе следует отражать этиологию (при возможности), остроту течения заболевания и распространенность поражения миокарда.
Диагноз можно считать достоверным при сочетании возможного этиологического фактора с двумя или более критериями вовлечения миокарда в патологический процесс (изменения электрокардиограммы, повышение активности «кардиальных» ферментов, тахикардия, приглушенность I тона, наличие патологических тонов, кардиомегалия, сердечная недостаточность).
Подразделение миокардитов на диффузный и очаговый условно, поскольку у большинства больных с так называемым очаговым миокардитом повторные биопсии миокарда, как правило, выявляют распространенное поражение. Очаговый миокардит обычно диагностируется при наличии умеренных изменений атриовентрикулярной проводимости (удлинение P – Q, исчезающее при динамическом наблюдении), сочетающихся с минимальными клиниколабораторными признаками миокардита.
Примеры формулировки диагноза:
1. Острый дифтерийный миокардит. Атриовентрикулярная блокада II степени с периодами Самойлова – Венкебаха (Мёбиц тип I).
2. Острый вирусный миокардит (вирус Коксаки В). Желудочковая экстрасистолия.
Дифференциальный диагноз. Диагноз миокардита при наличии типичных клинико-лабораторных признаков не представляет затруднений. Диагностические сложности возникают в трех ситуациях.
Во-первых, при наличии минимальных проявлений. Хорошо известно, что при ряде хронически протекающих воспалительных заболеваний (туберкулез лимфатических узлов, очаги хронической инфекции) возможно появление неспецифических ЭКГ-изменений (изменения зубца Т), нередко сочетающихся с умеренными воспалительными изменениями со стороны крови. Во-вторых, при хроническом миокардите, протекающем с выраженной кардиомегалией и сердечной недостаточностью (миокардит Абрамова – Фидлера), обычно возникают значительные сложности при дифференциальном диагнозе с дилатационной кардиомиопатией (см. соответствующий раздел). Диагностический поиск затруднен тем, что у многих больных течение дилатационной кардиомиопатии осложняется повторными эмболиями, приводящими к воспалительным изменениям со стороны крови. Нередко диагностические трудности могут быть решены лишь после повторных биопсий миокарда. Третья ситуация – ревматический миокардит у больного с ревматическими пороками сердца и сердечной недостаточностью. В этих случаях обычно отсутствуют типичные воспалительные изменения со стороны крови. Нередко правильный диагноз возможен лишь при динамическом наблюдении за больным. Характерным для этих больных является отсутствие ожидаемого ответа при терапии сердечной недостаточности.
Течение большинства миокардитов доброкачественное. Неблагоприятное течение наблюдается у больных с выраженными клиническими проявлениями заболевания и значительной кардиомегалией. В этих случаях обычно возникают серьезные осложнения: разнообразные нарушения ритма и проводимости, эмболии, сердечная недостаточность, которые могут привести к смерти.
Прогноз и исходы. У большинства больных миокардитом прогноз благоприятный. Неблагоприятный прогноз характерен для больных с так называемым идиопатическим миокардитом Абрамова – Фидлера, а также для пациентов с диффузным миокардитом различной этиологии, протекающим с выраженной кардиомегалией.
Причиной смерти больных могут быть желудочковые аритмии и полная атриовентрикулярная блокада (внезапная смерть), эмболии в жизненно важные органы, тяжелая сердечная недостаточность. При благоприятном исходе тяжелого миокардита, как правило, развивается кардиосклероз и сохраняется кардиомегалия. Отдаленный прогноз этих больных также неблагоприятен.
Лечение. Терапия больных миокардитами должна проводиться в стационаре. Она включает несколько направлений. При инфекционных миокардитах (брюшной тиф, сифилис, туберкулез и др.) необходимо этиотропное лечение. Все больные нуждаются в ограничении физической активности (полупостельный режим), при наличии сердечной недостаточности – ограничение поваренной соли, ингибиторы ангиотензинпревращающего фермента, по показаниям – диуретики, антиаритмические препараты (амиодарон, соталол), применение сердечных гликозидов нежелательно из-за повышенной чувствительности. Присоединение серьезных нарушений атриовентрикулярной проводимости – показание к кардиостимуляции (временной или постоянной).
Основными препаратами, используемыми при лечении больных миокардитом, являются нестероидные противовоспалительные препараты. Обычно назначают индометацин до 200 мг/сут., либо производные фенилуксусной (диклофенак – до 150 мг/сут.) или фенилпропионовой (ибупрофен – до 1,5 г/сут.) кислот. Длительность терапии 4 – 5 недель.
Допустимы сочетания противовоспалительных препаратов с соединениями хинолинового ряда (делагил – 0,25 – 0,5 г/сут., плаквенил – 0,4 г/сут.). Действие хинолиновых производных начинает проявляться не ранее, чем через 2 – 3 недели после начала терапии, длительность терапии – до 2 месяцев.
Наличие инфекционного миокардита – противопоказание для назначения глюкокортикоидов. Их применение оправдано при иммунных миокардитах, особенно при быстро нарастающей кардиомегалии, свидетельствующей о преобладании экссудативной фазы воспаления. Суточная доза преднизолона составляет 30 – 40 мг, длительность терапии – 4 – 8 недель.
После выписки из стационара больные должны находиться на диспансерном наблюдении в течение 2 лет.
ПЕРИКАРДИТЫ
Определение. Перикардиты – это воспаление серозной оболочки сердца (перикарда).
Распространенность. Истинная распространенность перикардитов не известна. При вскрытии поражение перикарда отмечается в 3 – 6 % случаев. Женщины болеют в 3 раза чаще, чем мужчины. В последние годы, благодаря широкому применению ультразвукового исследования, прижизненная диагностика перикардитов существенно улучшилась.
Этиология. Наиболее частой причиной перикардитов являются инфекционные возбудители: вирусы, микробактерии туберкулеза, микробы, редко – грибы. Асептический перикардит может быть проявлением ревматизма, диффузных заболеваний соединительной ткани, аутоиммунных и аллергических заболеваний. Он нередко осложняет течение инфаркта миокарда, пневмонии, хронической почечной недостаточности. Воспалительные изменения перикарда закономерно возникают после операций на сердце, при опухолях перикарда и метастазах в перикард, облучении средостения, травмах грудной клетки. У части больных этиологию установить не удается (идиопатический перикардит), однако чаще всего идиопатические перикардиты являются вирусными.
Патогенез. В большинстве случаев воспаление перикарда обусловлено непосредственно повреждением перикарда инициирующим фактором (инфекционный возбудитель, ионизирующая радиация, опухолевые клетки, травмы и т. д.). При аутоиммунных и аллергических заболеваниях перикардит является одним из проявлений основного патологического процесса.
Морфология. Характер морфологических изменений определяется этиологией заболевания и длительностью его течения. Так, острые перикардиты обычно протекают с отложением фибрина на листках перикарда, наличием выпота в полости перикарда. При бактериальных перикардитах жидкость в полости перикарда имеет гнойный характер, при вирусных и многих других перикардитах выпот обычно серозный. При длительно существующем перикардите постепенно развиваются сращения листков перикарда, нередко импрегнируемые кальцием (панцирное сердце).
Классификация. Существуют две классификации перикардитов; одна из них является этиологической, вторая — клинико-морфологической (табл. 1.16).
Таблица 1.16
Классификация перикардитов
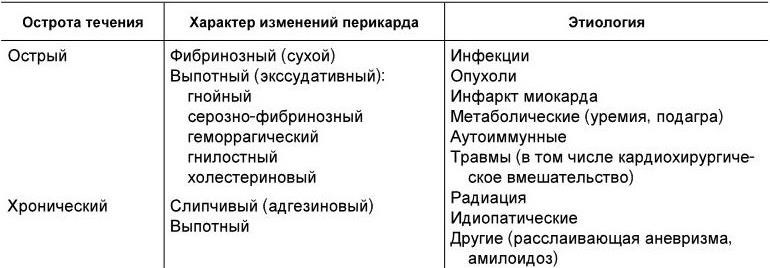
Классификация перикардитов достаточно динамична. Например, острый фибринозный перикардит туберкулезной этиологии может перейти в хронический слипчивый с исходом в панцирное сердце.
Клиническая картина. Клинические проявления перикардита определяются остротой развития симптомов, при выпотном перикардите – скоростью накопления жидкости в полости перикарда, а также симптомами заболевания, осложнившегося перикардитом.
При остром фибринозном перикардите у большинства больных отмечаются боли в области сердца и лихорадка. Выраженность лихорадки и болевого синдрома широко варьирует. Боли обычно локализованы в прекардиальной области, редко иррадиируют (в шею, в надключичные области), усиливаются на вдохе, связаны с положением тела, не уменьшаются при приеме нитроглицерина.
Одним из наиболее характерных проявлений острого фибринозного перикардита является шум трения перикарда. Он может выслушиваться в систолу, диастолу и пресистолу или же только в одну из фаз сердечного цикла, шум усиливается на вдохе, при наклоне туловища вперед. Нередко шум выслушивается в течение короткого времени. У 30 – 40 % больных шум выслушать не удается.
При остром выпотном перикардите клиническая картина зависит от этиологии заболевания и скорости накопления жидкости в полости перикарда. При инфекционном перикардите отмечается лихорадка, максимальная – при гнойном и гнилостном экссудате. Физикальное исследование сердца при небольшом выпоте не выявляет изменений. При значительном выпоте, приводящем к нарушению диастолического расслабления желудочков, отмечается набухание шейных вен, одутловатость лица, увеличение размеров сердца. При этом существенно увеличиваются размер абсолютной тупости сердца, а верхушечный толчок не совпадает с перкуторной границей и определяется кнутри от левой границы сердца. Тоны сердца обычно громкие, поскольку жидкость накапливается преимущественно внизу и сзади и оттесняет сердце к передней грудной стенке.
При быстром накоплении выпота возможно развитие тампонады сердца, проявляющееся нарушениями кровообращения. При повышении давления в полости перикарда затрудняется как венозный приток, так и диастолическое расслабление сердца. Это приводит к резкому уменьшению количества крови, поступающей в большой круг кровообращения. Гемодинамические нарушения определяют все клинические проявления тампонады сердца. Больные ощущают одышку, резкую слабость. При физикальном исследовании выявляется резчайшая одышка, набухание шейных вен, бледность, акроцианоз, нитевидный, нередко исчезающий на вдохе пульс, что сопровождается снижением артериального давления более чем на 10 мм рт. ст. (так называемый «парадоксальный пульс»). Артериальное давление резко снижено. Размеры сердца равномерно увеличены, тоны глухие. Как правило, выявляется увеличение печени. При отсутствии адекватной терапии (пункция перикарда) симптомы нарастают и больной может погибнуть от неспособности сердца выполнять насосную функцию.
При хроническом выпотном перикардите клинические проявления существенно не отличаются от таковых при острых формах. Однако медленное накопление экссудата вызывает адаптивные изменения со стороны сердечно-сосудистой системы. Поэтому даже при наличии большого количества жидкости проявления тампонады сердца могут отсутствовать.
Хронический слипчивый перикардит нередко является исходом острого. Клинические проявления при нем обусловлены нарушением диастолического расслабления сердца, что приводит к уменьшению ударного и минутного объемов, повышению венозного давления (> 10 мм рт. ст.) и постепенному развитию венозного застоя (набухание шейных вен, гепатомегалия, отеки, асцит).
Больные отмечают слабость, одышку. При исследовании сердца его размеры обычно оказываются нормальными. Тоны сердца приглушены. У многих больных выслушиваются так называемые перикардиальные щелчки – короткие, достаточно громкие звуки в фазу ранней диастолы. Их объясняют внезапным прекращением наполнения желудочков из-за невозможности их дальнейшего расширения в результате сдавления толстым неэластичным перикардом.
Лабораторная и инструментальная диагностика. При остром инфекционном перикардите обычно выявляются типичные воспалительные изменения со стороны крови (нейтрофильный лейкоцитоз, увеличение СОЭ, высокие значения С-реактивного белка, фибриногена и др.). При застое в большом круге повышен уровень прямого билирубина и аминотрансфераз в крови.









