
Полная версия
Гемопоэтическая стволовая клетка в патогенезе болезней цивилизации, ее диагностические возможности и биотерапевтический потенциал
Однотипность иммунологических реакций организма при этих двух полярных заболеваниях позволяет предположить схожесть патогенетических механизмов их развития с определенными вариациями и особенностями их морфологического дефекта в клетках иммунной системы. Оба этих заболевания имеют в своей основе доказанный генетический дефект – статистически достоверные транскриптомные и протеомные нарушения, что позволило нам заподозрить, что в основе их молекулярно-биологического дефекта лежит повреждение ГСК как родоначальницы всех клеток системы кроветворения и иммунитета у человека. ГСК, или стволовые кроветворные клетки, – очень малочисленная, но гетерогенная клеточная популяция, объединяющая в себе несколько типов (субпопуляций) клеток, отличающихся по уровням дифференцировки и способности к пролиферации. Среди них присутствуют как недифференцированные, практически не делящиеся стволовые клетки (СК), так и коммитированные (ограниченные в направлении дифференцировки) клетки-предшественники. Концентрация стволовых клеток (СК) в периферической крови в состоянии стабильного кроветворения мала – менее 0,01%, – что делает затруднительным их изучение даже самыми чувствительными методами (Гривцова, Тупицын, 2017). Но именно ГСК имеют самый большой клеточный цикл среди всех клеток организма человека (360 дней), являются основной регуляторной и управляющей системой в существующей иерархии всех клеточных систем организма, первыми реагируют на мутации генов в клетках и появление асептического воспаления в патологических тканях и органах, мигрируют туда на градиент концентрации воспаления из костного мозга, адгезируют к патологическим клеткам и «направляют их развитие» в сторону дифференцировки или апоптоза по механизму bystander effect. ГСК в зоне воспаления осуществляют горизонтальный и вертикальный информационный обмен цитоплазматическими белками с патологическими клетками (рис. 1, 2). Эти научные факты нами были изучены и опубликованы ранее в научной литературе (Брюховецкий И. С. и др., 2014; Милькина и др., 2016), они описывают универсальный механизм формирования патоспецифического протеома в ГСК. В зависимости от мутационного повреждения клеток-мишеней в тканях ГСК происходят геномно-протеомное повреждение ГСК и формирование из них опухолевых стволовых клеток или клеток, получивших вакцинацию иммуноспецифическими белками, что мы показали в своих исследованиях по онкопротеомике стволовых клеток (Брюховецкий А. С., 2014). Поэтому целью настоящего способа диагностики стало прицельное изучение и выявление патологической специфики протеомных профилей белковых маркеров клеточной поверхности ГСК при таких смертельных заболеваниях, как рак и другие ЗНО, а также БАС, что имеет большое значение для выявления уникальных иммуноспецифических характеристик молекулярного ландшафта клеточной поверхности ГСК как фундаментальных молекулярно-биологических критериев для ранней диагностики этих неизлечимых заболеваний.
Глава 4. Фундаментальные аспекты проблемы: взаимодействие гемопоэтических стволовых и опухолевых клеток in vitro (соавт. д.м. н.
И.С. Брюховецкий)
Одним из ключевых этапов эволюции многоклеточных организмов стало появление способности к специфическому координированному межклеточному взаимодействию, что сделало возможным согласованную регуляцию метаболизма, дифференциацию клеток и проявление физиологических функций дифференцированных клеток (акад. М. А. Пальцев, 2003). Вектор взаимодействия стволовой и дифференцированной клеток определяется локальными микроусловиями среды, однако только в патологии и клинике можно понять всю глубину адаптивных возможностей организма. В этой главе мы остановимся на закономерностях межклеточного взаимодействия ГСК с нормальными и патологически измененными, а именно опухолевыми клетками.
Закономерности миграции гемопоэтических стволовых клеток к опухолевым клеткам различных линий in vitro
Для обоснования феномена направленной миграции ГСК в неопластический очаг и выявления некоторых механизмов реализации этого феномена был выполнен эксперимент in vitro, который проходил в 2 этапа:
1. исследование миграции стволовых клеток в сочетанных культурах с клетками различных линий;
2. исследование миграции стволовых клеток человека в сокультурах с клетками злокачественных опухолей различных типов.
Использованы дермальные фибробласты человека (ATCC® PCS-201-012™), астроциты крысы (CTX TNA2 (ATCC® CRL-2006)), клетки злокачественной крысиной глиомы линии С6 (ATCC® CCL-107), линии U-87 MG (ATCC® HTB-14) и T-98G (ATCC® CRL-1690) глиобластомы человека, клетки линии МСА-7 аденокарциномы молочной железы (ATCC® HTB-22) и линии A549 (ATCC® CCL-185) карциномы легких человека, первичная культура CD34+ ГСК человека (ATCC® PCS-800-012™). Перед началом эксперимента все клетки протестированы на контаминацию микоплазмой с помощью Universal Mycoplasma Detection Kit (ATCC® 30—1012K™).
Для изучения закономерностей миграции СК и выявления некоторых механизмов и особенностей реализации этого феномена выполнен эксперимент in vitro, который проходил в 2 этапа. Задачей первого этапа было выявление особенностей взаимодействия ГСК с опухолевыми и нормальными высокодифференцированными клетками – фибробластами и астроцитами.
Миграция стволовых клеток млекопитающих в сочетанных культурах с клетками различных линий in vitro
Для создания сочетанных культур использовали культуральные вставки с размером пор 12 мкм (Millipore, США). Дно лунок культурального планшета (Grinner BioOne, США) покрывали полиэтиленимином, а затем ламинином (Gibco, США). В каждую лунку планшета помещали пористую культуральную вставку с диаметром пор 12 мкм, которую фиксировали каплей стерильного парафина (рис. 1). Планшет заполняли средой DMEM (Dulbecco’s modified Eagle’s medium (DMEM; Gibco; Thermo Fisher Scientific, Inc., Waltham, MA, США)) с пониженным содержанием глюкозы и добавлением 10% эмбриональной телячьей сыворотки (FBS) и 100 U/мл пенициллина (стрептомицина). Все реагенты производства компании Gibco (Thermo Fisher Scientific, Inc., США).
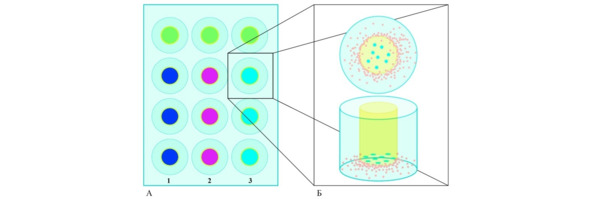
Рис. 1.⠀Схема эксперимента по изучению миграции СК in vitro. А. Общая схема эксперимента. Вставка содержит: 1 – клетки глиомы С6; 2 – астроциты; 3 – фибробласты. Зеленым выделены лунки, которые оставляли пустыми, для оценки пассивной миграции клеток. Б. Схематическое изображение наблюдаемого явления: клетки глиомы линии С6 индуцируют миграцию ГСК, которые формируют вал вокруг и проникают внутрь культуральной вставки
Внутрь вставки вносили 0,5 × 104 клеток глиомы С6, астроцитов или фибробластов, предварительно окрашенных витальным трейсером Vybrant™ CFDA SE CellTracer (кат. № V12883 Invitrogen™). Планшет с культуральными вставками инкубировали в течение 24 ч, затем на дно лунки планшета снаружи культуральной вставки высаживали по 0,5 × 104 ГСК, предварительно окрашенных флуоресцентным маркером CellTracker™ Red CMTPX Dye (кат. № C34552, Invitrogen™).
Клетки культивировали 120 ч (37° C, 5% CO2). Подсчет клеток, мигрировавших сквозь культуральную вставку, проводили с использованием высокоэффективной количественной микроскопии (Cell-IQ, CM Technologies, Великобритания) с временными отрезками 24—48—72—96—120 ч; регистрировали количество Red CMTPX Dye-позитивных объектов как на границе, так и внутри культуральной вставки. Полученные результаты верифицировали методом цитофлуориметрии.
Спустя 24 ч после начала совместного культивирования наблюдали формирование клеточного вала из флуоресцирующих клеток, располагающихся по периметру культуральной вставки с клетками глиомы. Этот феномен был отчетливо выражен в сокультурах, содержащих опухолевые клетки, и отсутствовал в лунках планшета, где стволовые клетки были совмещены с фибробластами и астроцитами (рис. 2 А—Г).
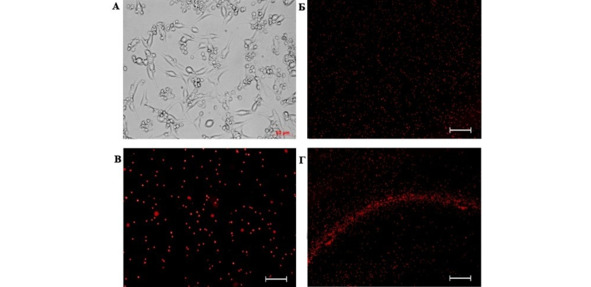
Рис. 2.⠀Перераспределение ГСК в планшете при совместном
культивировании через 24 ч. А – опухолевые клетки внутри культуральной вставки; Б – сокультура ГСК и фибробластов: формирование вала не наблюдается, увеличение 5x; В – сокультура ГСК и астроцитов: формирование вала не наблюдается, ув. 10x; Г – сочетанная культура ГСК и клеток глиомы С6 – формирование клеточного вала по периметру культуральной вставки, содержащей опухолевые клетки, ув. 5x
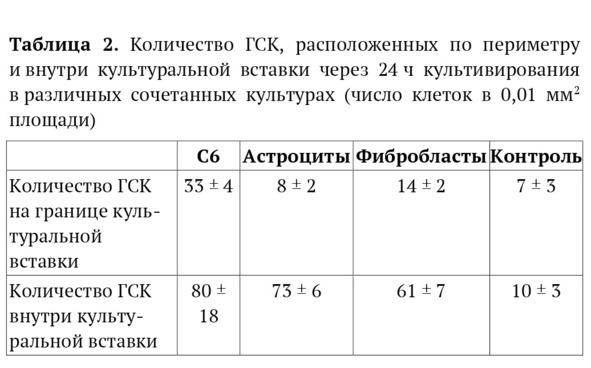
В культурах, содержащих опухолевые клетки, ГСК мигрировали сквозь культуральную вставку и визуализировались среди неокрашенных клеток глиомы в форме округлых объектов, отвечающих на воздействие лазера устойчивым флуоресцентным сигналом, регистрируемым в спектре, соответствующем Red CMTPX (577⁄602 нм). В культурах, содержащих фибробласты и астроциты, регистрировались только единичные Red CMTPX-позитивные объекты. В культуральных вставках, оставленных пустыми, выявлялись только солитарные клетки, соответствующие спектру флуоресценции ГСК (табл. 2).
Примечание: данные представлены в виде М ± s.e.m., N = 12 для каждой группы, по каждой точке.
Подсчет числа ГСК, мигрировавших сквозь пористую мембрану или сосредоточенных по периметру культуральной вставки, показал четкое увеличение числа флуоресцирующих элементов в сокультурах, содержащих клетки глиомы, начиная со 2-го по 5-й день эксперимента (рис. 3). Значимых динамических изменений числа ГСК на этапах совместного культивирования культур с астроцитами и фибробластами не наблюдали (рис. 4).
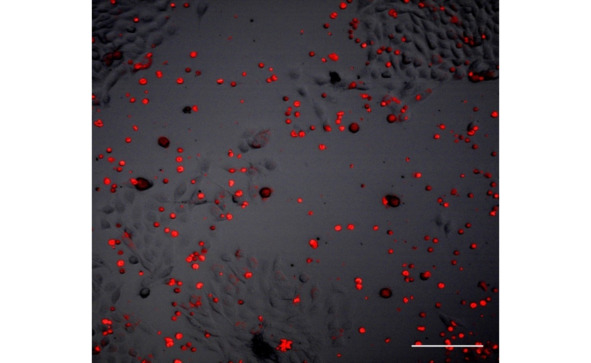
Рис. 3.⠀ГСК человека, мигрировавшие в лунки с глиомой С6.
Окраска CellTracker™ Red CMTPX. Конфокальная микроскопия, флуоресценция при воздействии лазера λ = 546 нм; ув.: об. 10х
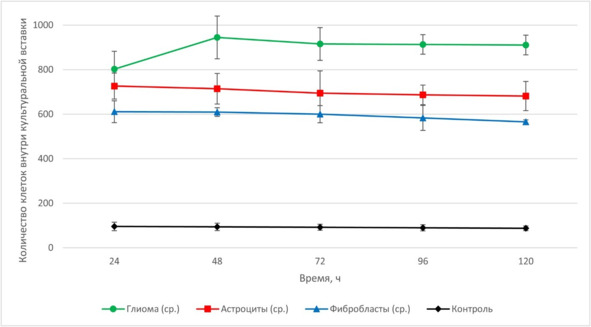
Рис. 4.⠀Динамика накопления стволовых клеток в культуральных вставках, содержащих клетки глиомы линии С6, астроциты, фибробласты, и в контрольных вставках. По оси абсцисс – время сокультивирования
(24—48—72—96—120 ч), по оси ординат – число флуоресцирующих клеток во вставке (М ± s.e.m., N = 9 по каждой точке)
Очевидно, направленная миграция ГСК к клеткам глиомы обусловлена продукцией опухолевыми клетками сигнальных молекул. Поскольку в данном эксперименте были использованы клетки крысиной глиомы линии С6, способность ГСК мигрировать в отношении опухолевых клеток человека нуждалась в уточнении.
Очевидно, направленная миграция ГСК к клеткам глиомы обусловлена продукцией опухолевыми клетками сигнальных молекул. Поскольку в данном эксперименте были использованы клетки крысиной глиомы линии С6, способность ГСК мигрировать в отношении опухолевых клеток человека нуждалась в уточнении.
Миграция стволовых клеток человека в сочетанных культурах с клетками злокачественных опухолей различных линий
В данном эксперименте использованы клетки аденокарциномы молочной железы и карциномы легких человека; кроме того, 2 типа клеток глиобластомы: а) клетки общего пула опухоли; б) опухолевые стволовые клетки (ОСК) глиобластомы.
Для получения ОСК клетки глиобластомы культивировались в среде DMEM (Gibco; Thermo Fisher Scientific, Inc.) без добавления сыворотки, с добавлением L-глутамина (2 мМ), B-27 (0,5 мМ), основного фактора роста фибробластов (20 нг/мл), эпидермального фактора роста (20 нг/мл), пенициллина / стрептомицина (100 ед./мл) и гепарина (5 мкг/мл). ОСК выделяли из глиомасфер на основании экспрессии антигена CD133, используя MicroBead (кат. №130-100-857; Miltenyi Biotec, Inc.). Чистота популяции ОСК, по данным проточной цитометрии (антитела CD133/1-VioBright FITC (кат. №130-105-226; Miltenyi Biotec, Inc.)), составила 96,72%.
Все опухолевые клетки и фибробласты (контроль), используемые в эксперименте, окрашивали Vybrant™ CFDA SE CellTracer, вносили внутрь культуральной вставки в количестве 0,5 × 104. Пространство снаружи культуральной вставки планшета заполняли нейральными прогениторными клетками (НПК) человека (Neural Progenitor Cell Origin ATCC-BXS0117 Normal; Human (ATCC® ACS-5003™)), или ГСК человека в количестве 0,5 × 104. Клетки были окрашены флуоресцентным маркером CellTracker Red CMTPX Dye. Культивирование проводили в течение 120 ч при стандартных условиях. Результаты сравнительного анализа миграционной активности клеток в смешанных культурах представлены на рис. 5.
Нейральные прогениторные клетки (НПК) обладали существенно большей подвижностью при сокультивировании с CD133+ ОСК линий U-87 и T98G (+926 и +913,1% от контроля). Аттрактивность НПК в отношении общего пула клеток линий U-87 и U-251 была менее выраженной (+598,7 и +688,8% от контроля) и сопоставима с опухолевыми клетками иного происхождения. ГСК, несколько уступая НПК в способности мигрировать к CD133+-клеткам глиобластомы, тем не менее активно мигрировали к этим клеткам (+618,2% к ОСК U-87 и +623,8% к ОСК T98G по сравнению с контролем). Общий пул клеток глиобластомы обладал меньшей аттрактивностью для ГСК (U-87 +449,2% и T98G +523,7% в сравнении с контролем), что сопоставимо с миграцией ГСК к клеткам рака молочной железы (439,2%) и рака легкого (516,8%).
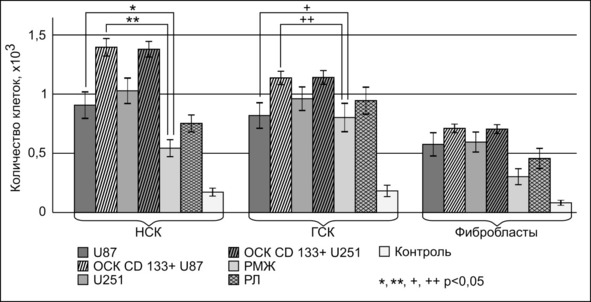
Рис. 5.⠀Количество НПК, ГСК и фибробластов, мигрировавших через культуральную вставку, через 120 ч совместного культивирования. По оси ординат – количество клеток × 103, данные представлены в виде М ± s.e.m., N = 15 для каждой группы
Обращала внимание выраженная сильная способность глиобластомы привлекать высокодифференцированные клетки – фибробласты. При этом наилучшей подвижностью эти клетки обладали в отношении ОСК (U-87 +897,6% и T98G +889%); клетки общего пула глиобластомы обладали несколько меньшей способностью индуцировать миграцию фибробластов, которая была сопоставима с неопластическими клетками рака молочной железы (380,9%) и легкого (574,9%).
Итак, нейральные прогениторные клетки обладали существенно большей подвижностью к клеткам глиобластомы в сравнении с клетками других типов. Миграционная активность НПК зависела от типа опухолевых клеток в сокультуре, и они более активно мигрировали к ОСК двух типов глиобластомы. Дифференцированные клетки глиобластомы обладали несколько меньшей способностью индуцировать миграцию НПК, однако опухолевые клетки ненейронального происхождения существенно слабее индуцировали процессы миграции нейральных стволовых клеток.
Следует отметить, что по мере приближения ГСК к культуральной вставке и их проникновения внутрь в популяции клеток глиобластомы индуцировалась высокая подвижность. В серии снимков, выполненных в режиме реального времени, с интервалом 3 ч (через 23, 26, 29 и 48 ч после начала эксперимента), видно, что клетки глиобластомы активно передвигались по дну планшета внутри культуральной вставки и как бы собирали мигрирующие к ним ГСК. Через 48 ч наблюдения практически все неопластические клетки были «облеплены» мигрирующими клетками (рис. 6).
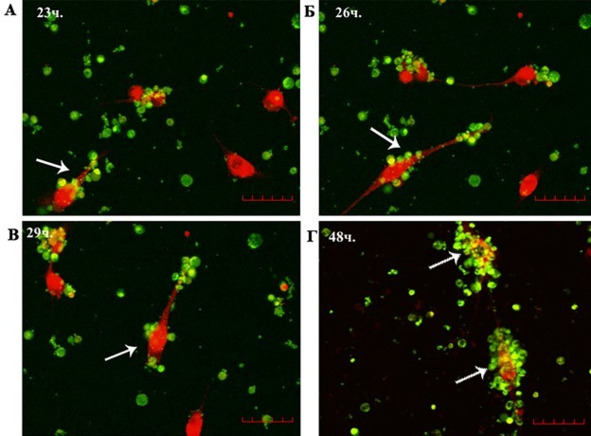
Рис. 6.⠀Динамический ряд клеток U-87 глиобластомы в сокультуре с CD34+ ГСК. Опухолевые клетки окрашены CellTracker™ Red CMTPX (красный), а ГСК – Vybrant® CFDA SE (зеленый). Стрелкой показана активно перемещающаяся клетка глиобластомы, к поверхности которой адгезируют ГСК. А – 23 ч, Б – 26 ч, В – 29 ч, Г – 48 ч. Флуоресцентная лазерная микроскопия в режиме реального времени. Масштаб 400 мкм
Взаимодействие стволовых клеток человека с клетками злокачественных опухолей in vitro
Способность нормальных стволовых клеток мигрировать и взаимодействовать с опухолевыми клетками требует изучения закономерностей такого взаимодействия. Для ответа на эти вопросы была выполнена серия экспериментов in vitro, в которых использованы клетки глиомы линии С6, глиобластомы линии U-87, клетки аденокарциномы легкого линии А549 и рака молочной железы МСF-7. Для каждой модели выполнены визуальное и цитометрическое изучение процесса взаимодействия ГСК с опухолевыми клетками и автоматизированный мониторинг процесса сокультивирования стволовых и опухолевых клеток в соотношении 3:1; 1:1 и 1:3 в режиме реального времени.
Взаимодействие гемопоэтических стволовых клеток на модели глиомы линии С6
В рамках подготовки экспериментов 0,5 × 106 клеток глиомы линии С6 после окраски витальным трейсером CFDA SE были внесены в лунки планшета, где инкубировались при стандартных условиях. Спустя 6 ч неприкрепившиеся опухолевые клетки были отобраны и в культуру внесено 0,5 × 106 ГСК, окрашенных флуоресцентным трейсером Red CMTPX. В качестве контроля использовали фибробласты, которые после окраски маркером Red CMTPX вносили в культуру опухолевых клеток в соотношении 1:1.
Через 6 ч клетки линии С6 визуализировались в виде веретеновидных или полигональных образований, отвечающих стойким флуоресцентным сигналом на воздействие лазера (λ = 488 нм). В свою очередь, ГСК при воздействии лазера другого типа (λ = 546 нм) формировали флуоресцентный сигнал, визуализируясь в форме округлых образований (рис. 7 А, Б).
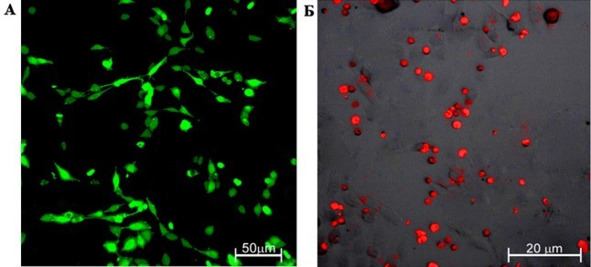
Рис. 7.⠀Флуоресценция сокультивируемых клеток, 6 ч с начала эксперимента in vitro. А – клетки глиомы линии С6, окраска CFDA SE (λ = 488 нм); Б – CD34+ стволовые клетки крысы, окраска CMTPX (λ = 546 нм). Флуоресцентная лазерная микроскопия
Спустя 12 ч ГСК адгезировали к клеткам глиобластомы и визуализировались на поверхности клеток глиомы С6 в виде красных флюоресцирующих объектов (рис. 8).
Спустя 24 ч наблюдения в цитоплазме клеток глиомы стали появляться включения красного флуорохрома, что означало присутствие красителя Red CMTPX, ковалентно связанного с белками цитоплазмы ГСК в процессе окраски (рис. 9). Это явление достигало максимума через 48 ч с начала эксперимента, сохранялось до конца исследования и отсутствовало в контрольной культуре с фибробластами.
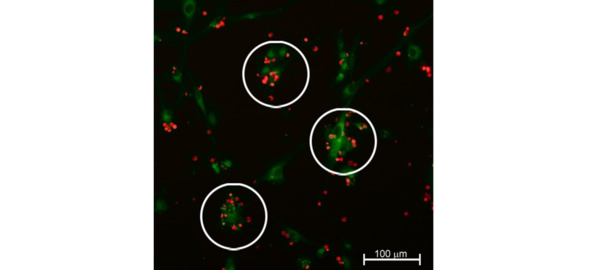
Рис. 8.⠀Адгезия ГСК (CMTPX, λ = 546 нм) к поверхности клеток глиомы (CFDA SE, λ = 488 нм), 12 ч. Мультифотонная флуоресцентная лазерная микроскопия. ГСК визуализируются в виде цилиндров красного цвета на поверхности клеток глиомы
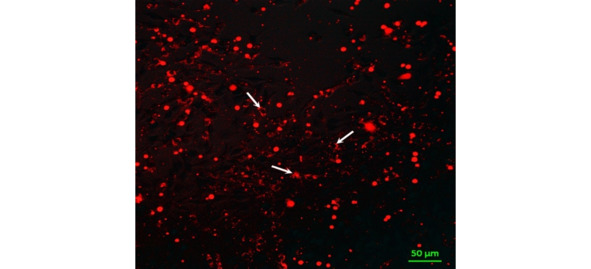
Рис. 9.⠀Перенос флуоресцентной метки CMTPX из ГСК в клетки линии С6. Флуоресцентная лазерная микроскопия in vitro. Стрелками показано накопление красителя в сокультивируемых клетках
При визуальном наблюдении перенос флуоресцентной метки был заметен в направлении от ГСК к клеткам глиомы, поскольку через 48 ч накопление флуоресцентного красителя CMTPX отмечено именно в цитоплазме клеток линии С6.
Спустя 120 ч контрольная культура опухолевых клеток отвечала на воздействие лазера (λ = 488 нм) устойчивым флуоресцентным сигналом, визуализируя четкую форму клеток глиомы без признаков обмена флуоресцентной меткой с ГСК (рис. 10 А, Б).
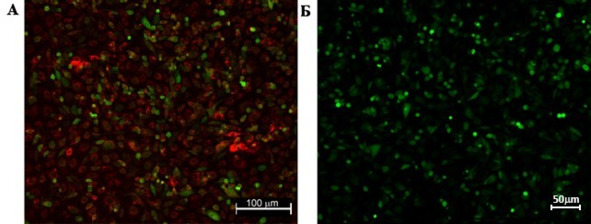
Рис. 10.⠀Сокультура ГСК (CMTPX, λ = 546 нм) c клетками глиомы С6 (CFDA SE, λ = 488 нм). А – клетки линии С6 отвечают на воздействие лазеров 2 типов; Б – клетки глиомы отвечают стойким флуоресцентным сигналом на воздействие лазера λ = 488 нм, что свойственно красителю СFDA SE, которым они изначально окрашены. Флуоресцентная лазерная микроскопия, 120 ч эксперимента
Таким образом, при наблюдении взаимодействия 2 популяций совместно культивируемых клеток, окрашенных разными красителями, было обнаружено, что клетки не только мигрируют и адгезируют друг к другу, но и осуществляют перенос флуорохрома в соседние клетки.
Результаты цитологического мониторинга подтверждаются при цитофлуориметрической оценке сокультуры на разных этапах эксперимента (24, 48, 72, 96 ч). Методом проточной цитофлуориметрии показано, что наиболее активное взаимодействие клеток происходит в период 24—48 ч (рис. 11 А, Б), что проявляется накоплением в неопластических клетках флуоресцентной метки.
Число клеток, содержащих двойную окраску, изменяется динамически: через 24 ч в культуре обнаруживается 25,8% дважды меченых клеток, через 48 ч – 40,82%, через 72 ч – 8,75%, через 96 ч – 5,47%. При этом по мере увеличения срока наблюдения тенденция к исчезновению ГСК в смешанной культуре становилась все очевиднее. Так, на 24 ч количество ГСК составляло 47,45%, к 48 ч эксперимента их количество сократилось до 9,01%, критически уменьшилось – к 72 ч (1,18%), а к 96 ч количество ГСК в сокультуре составило 0,73% (рис. 12 В, Г).
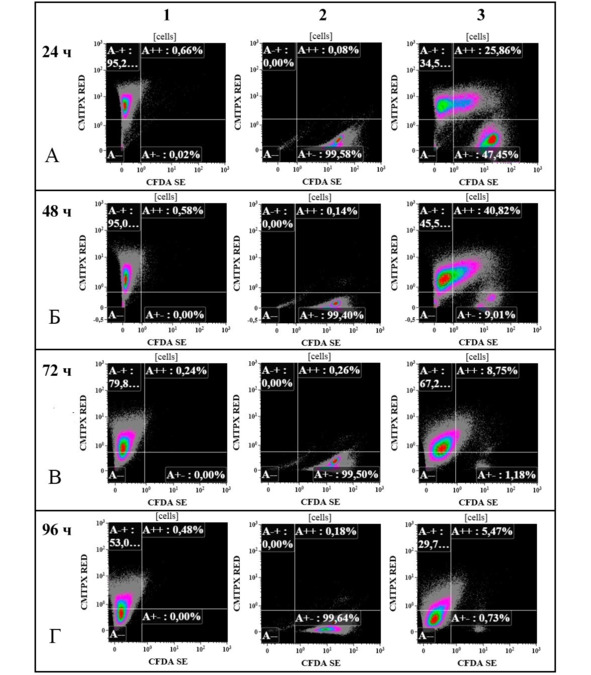
Рис. 11.⠀Результаты сокультивирования ГСК (CFDA SE, λ = 488 нм) и глиомы С6 (Red CMTPX, λ = 546 нм) при исходном соотношении клеточных популяций 1:1. (А—+) – клетки, окрашенные CFDA SE, λ = 488 нм; (А+—) – клетки, окрашенные Red CMTPX, λ = 546 нм; (А—) – клетки погибшие либо потерявшие окраску; (А++) – область с клетками, включившими окраску обоими красителями. Для контроля использованы чистые клеточные культуры ГСК и глиомы С6, окрашенные маркерами Red CMTPX, λ = 546 нм и CFDA SE, λ = 488 нм соответственно. А – анализ клеток через 24 ч;
Б – анализ клеток через 48 ч; В – анализ клеток через 72 ч; Г – анализ
клеток через 96 ч
Важно отметить, что в контролях количество клеток глиомы С6 закономерно уменьшалось, что, вероятно, следует объяснить ускоренными темпами пролиферации неопластических клеток, которые постепенно утрачивают флуоресцентную метку. Однако и в сокультуре С6/ГСК количество монопозитивных клеток линии С6 уменьшается, при этом монопозитивных клеток на 96 ч эксперимента в сокультуре с ГСК значительно меньше, чем в контроле. Сказанное выше свидетельствует в пользу переноса флуоресцентной метки из ГСК в опухолевые клетки на ранних сроках сокультивирования (до 48 ч). При этом на более поздних сроках (48—96 ч) клетки глиомы особенно интенсивно накапливали флуоресцентную метку от ГСК. Важно отметить, что в ходе сокультивирования популяция клеток ГСК практически исчезла на поздних сроках (120 ч).
Для изучения эффектов взаимодействия ГСК с опухолевыми клетками интеллектуальная система мониторинга Cell-IQ была настроена на распознавание образов и подсчет числа живых и мертвых клеток в режиме реального времени. Под живыми клетками понималась итоговая сумма образов интерфазы и митоза (2).

Рис. 12.⠀Образы опухолевых клеток по данным системы Cell-IQ.
А – адгезировавшие клетки; Б – неадгезировавшие пролиферирующие клетки (в т.ч. с признаками ранней профазы); В – мертвые клетки
Термином «пролиферирующие» были обозначены клетки, обнаруживающие прекращение функциональной активности, имеющие отчетливые признаки открепления от субстрата и характеризующиеся увеличением объема ядра и клетки в целом, округлыми контурами клеточной мембраны и светлой цитоплазмой с отсутствием патологических включений, а также другими морфологическими признаками ранней профазы. При подсчете пролиферирующих клеток также учитывались клетки, находящиеся в митозе.
Динамическое наблюдение числа опухолевых клеток, сокультивируемых с ГСК, показало зависимость антипролиферативного эффекта от соотношения внесенных в культуру клеток. К концу эксперимента кривая нарастания числа живых клеток в сокультуре С6/ГСК при соотношении 3:1 не обнаруживала значительных отличий от контрольной культуры клеток линии С6 (рис. 13).
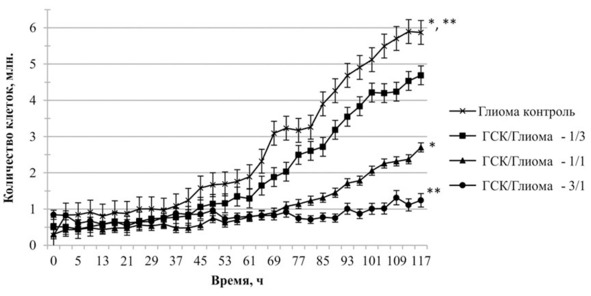
Рис. 13.⠀Результаты сокультивирования клеток линии С6 с ГСК. По оси абсцисс – время эксперимента (ч), по оси ординат – количество клеток линии С6 в сокультурах с ГСК. Данные приведены в виде М ± s.e.m., n = 30 по каждой точке. Знаком * показаны достоверные (p <0,05) различия в количестве клеток линии С6 в сокультуре с ГСК/C6 в соотношении 1:1 и знаком ** в соотношении 3:1 по сравнению с контрольной

