
Полная версия
Гемопоэтическая стволовая клетка в патогенезе болезней цивилизации, ее диагностические возможности и биотерапевтический потенциал
По-видимому, роль клеток микроокружения ГСК в восстановлении нарушенного гемопоэза является определяющей для уровня функциональной активности ГСК как в нише костного мозга, так и для ГСК, трансплантируемых в кровь или ткань, а также переливаемых в ликвор в составе кластера костномозговых клеток. Возможно, что для того чтобы получить требуемый функциональный (регуляторный, противоопухолевый, нейрореставрационный и т.д.) эффект ГСК в организме человека, целесообразно использовать их именно в составе лейконцентрата, содержащего весь спектр клеток микроокружения костномозговой ниши. Интересно, что изолированное введение клеток лейкоконцентрата мононуклеаров (МНК), освобожденных от ГСК (СD34+, CD45+, CD45—), не обеспечивает требуемых нейрореставрационных эффектов в эксперименте у крыс (Брюховецкий А. С. и др., 2015), как и изолированое введение очищенных ГСК не дает нужных эффектов нейрорегенерации (Брюховецкий, Хотимченко, 2018).
Как было отмечено выше, мобилизованные МНК костного мозга являются важной частью костномозговой ниши, в которой располагаются ГСК и МСК, и клетки микроокружения даже в периферической крови сопровождают ГСК и имеют важнейшее значение в поддержании активности и функциональности различных типов стволовых клеток. По-видимому, клетки естественного микроокружения обеспечивают активность и системную функциональность ГСК и МСК. В этом ключе ГСК и МССК целесообразно использовать совместно с клетками их ближайшего микроокружения (Брюховецкий А. С., 2013).
ГСК, имплантированные в полушарие, противоположное опухолевому или другому патологическому (воспалительному, ишемическому, кровоизлиянию и т.д.) очагу, так же как и введенные внутривенно, демонстрируют общее свойство ГСК – целенаправленно мигрировать к очагу патологии и восстанавливать нарушенный внутритканевой гомеостаз (Брюховецкий А. С., 2011; Брюховецкий И. С. и др., 2015; Брюховецкий, Хотимченко, 2018). Данное свойство ГСК используется для суперселективной доставки иммунолипосомальных конструкций, содержащих противоопухолевые химиопрепараты или другие молекулы цитотоксического или цитостатического действия. Кроме того, возможна суперселективная доставка рентгеноконтрастных веществ, радиоизотопных препаратов, сигнальных белков и наноконструкций, повышающих чувствительность опухолевых клеток к традиционным способам терапии (Брюховецкий А. С., 2011). Перспективной представляется стратегия использования ГСК как транспортной системы адресной доставки биологической информации для локальной модуляции процессов апоптоза, что требует продолжения исследований в данном направлении (Брюховецкий И. С. и др., 2014, 2016). Подобные свойства СК, характерные для гемопоэтических стволовых клеток, описаны и для МССК (Сaplan, 2013, 2014; Choop et al., 2015, 2016).
Начиная с последнего триместра внутриутробного развития на протяжении всей жизни человека основным гемопоэтическим органом является костный мозг – именно там сосредоточено абсолютное большинство стволовых кроветворных клеток (СКК). Содержание стволовых клеток в костном мозге у здоровых индивидуумов колеблется в пределах 0,5—4,0% среди мононуклеаров (Andrews et al., 1986; Civin et al., 1984). И этот небольшой пул стволовых кроветворных клеток обеспечивает человеку ежесуточную потребность в 400 млрд клеток крови.
Концентрация стволовых клеток в периферической крови в состоянии стабильного кроветворения (у практически здорового человека) мала – менее 0,01%, а истинно стволовые клетки еще более редкая популяция – 1:100 000 (Чертков, Дризе, 1998), что делает затруднительным изучение их свойств и особенностей поведения даже самыми чувствительными методами.
Именно поэтому на ранних этапах изучения ГСК основным источником их получения был костный мозг, т.к. долго считалось, что клетки-предшественники отсутствуют в периферической крови в нормальных условиях. Однако по мере совершенствования методик, позволяющих обнаружить очень незначительные количества клеток-предшественников гемопоэза (КПГ), был установлен факт периодического поступления гемопоэтических предшественников в периферическое русло под влиянием ряда факторов (Elias et al., 1992; Sprangrud, 1994). И так появилась уникальная возможность мобилизации периферических стволовых клеток крови (ПСК) – повышения количества КПГ в периферической крови при стимуляции гемопоэза ростовыми клеточными факторами. В это же время была представлена и первая характеристика клеток класса гемопоэтических предшественников (Ogawa, 1993).
Открытие феномена мобилизации СКК сделало возможным использование стволовых клеток крови для восстановления кроветворения после введения высоких доз цитостатиков и открыло новую эру в лечении когорты пациентов, требующих значительной эскалации доз химиопрепаратов (Heguet, 2015).
Феномен мобилизации стволовых кроветворных клеток заключается в их способности покидать костный мозг и выходить в кровеносное русло под влиянием повреждающих воздействий (например, цитостатиков), цитокинов, ростовых или колониестимулирующих факторов (Link et al., 2000).
При мобилизации стволовые клетки крови сохраняют свои главные свойства – значительный пролиферативный потенциал и способность к дифференцировке в зрелые клетки крови (Chtinantakul et al., 2012; Eaves et al., 2015; Mohle еt al., 1999; Zanjani et al., 1999).
В процессе мобилизации концентрация СКК возрастает до уровней, достаточных для трансплантации. Детальное изучение мембранных маркеров этих клеток проводится иммунологическими методами, в частности проточной цитометрией, с использованием многопараметровой иммунофлуоресценции и идентификации СКК на основании экспрессии антигена CD34.
Постепенно методы мобилизации периферических стволовых клеток крови совершенствовались и была показана возможность сохранения жизнеспособных ГСК в жидком азоте.
До настоящего времени большинство трансплантаций кроветворной ткани – это аутологичные трансплантации мобилизованных периферических СКК, когда больному после введения сверхвысоких доз химиопрепаратов кроветворение восстанавливают его собственными стволовыми кроветворными клетками, заготовленными заранее в период ремиссии основного заболевания (Korbling et al., 2011).
При аутологичной трансплантации у онкологического больного всегда существует риск ретрансплантации болезни, т.е. пересадки вместе со здоровыми кроветворными клетками клеток опухоли, циркулирующих в крови. Избежать этого возможно при использовании в качестве поддержки кроветворения донорских стволовых клеток.
Кроме того, при трансплантации донорских стволовых клеток при соблюдении определенных условий развивается феномен «трансплантат против болезни», что делает процедуру не просто терапией поддержки, но самостоятельным лечением.
Трансплантационным материалом могут являться как периферическая кровь, так и костный мозг и пуповинная кровь. Преимущества какого-либо источника стволовых кроветворных клеток определяются условиями конкретного лечебного учреждения, поскольку у каждого метода имеются достоинства и недостатки (Azouna et al., 2011; Blume et al., 2000).
Таким образом, развилось целое направление терапии онкологических больных, позволяющее использовать сверхвысокие дозы химиопрепаратов в качестве консолидирующей терапии, а травмированный этими высокими дозами гемопоэз поддерживать мобилизованными стволовыми клетками крови.
При обобщении знаний, полученных в области изучения гемопоэтических предшественников и всех последующих клеточных типов, были разработаны подробные схемы гемопоэза, которые мы используем и по настоящее время. Не последнюю роль здесь также сыграли российские ученые, и в первую очередь это И. Л. Чертков – выдающийся экспериментальный гематолог, д.м.н., проф., главный научный сотрудник Гематологического научного центра РАМН. Иосиф Львович внес большой вклад в изучение клональности кроветворения. Согласно теории Черткова, стволовые кроветворные клетки (СКК) обладают высоким, но не безграничным пролиферативным потенциалом; они не бессмертны и не могут «самоподдерживаться». СКК закладываются только в эмбриогенезе и расходуются последовательно, образуя короткоживущие, локально расположенные, сменяющие друг друга клеточные клоны, аналогично тому, как это происходит в яичнике. Иосиф Львович изучал оба типа стволовых клеток – и мезенхимальные, и кроветворные. В своих работах он продемонстрировал, что МССК являются родоначальниками кроветворного микроокружения и отличаются от СКК по радиочувствительности.
Считается, что при внутривенной трансплантации костного мозга в виде клеточной взвеси МССК теряются – они неспособны проникнуть в микрообласты, где происходит их функционирование, даже в случае если костномозговая взвесь вводится внутрь кости. МССК способны к переносу кроветворного микроокружения только при трансплантации под кожу или капсулу почки без превращения костного мозга в одноклеточную взвесь. В работах Черткова впервые были получены физиологические характеристики МССК, им разработана принципиально отличная от общепринятого мнения теория клональной кинетики СКК. Полученные данные нашли подтверждение в мировой практике. Показано, что при внутривенной трансплантации костного мозга донорские МССК не выживают; выявлены клоны «здоровых» СКК у больных с опухолями лимфоидной и кроветворной системы. Данные о клональности кроветворения подтвердились в исследованиях печального опыта Чернобыльской аварии. С сер. 1970-х гг. И. Л. Чертков вместе с А. Я. Фриденштейном заложили фундамент для экспериментального изучения стволовых клеток костного мозга. В 1984 г. вышла в свет монография Иосифа Львовича «Гемопоэтическая стволовая клетка и ее микроокружение», на которой, подобно труду Е. Уилсона, было воспитано не одно поколение гематологов, и которая до сих пор остается ключевым руководством в онкогематологии. Иосиф Львович был одним из пионеров гибридомной технологии; он основал первую компанию по производству моноклональных антител в СССР. Ряд диагностических препаратов на основе моноклональных антител для определения группы крови, созданных И. Л. Чертковым, широко используется и сейчас (Чертков, Воробьев, 1973; Чертков, Дризе, 1998; Mathe et al., 1972).
Постепенно схемы кроветворения уточнялись и дополнялись с учетом вновь получаемых знаний, однако принципиальная структура их не изменилась до сих пор. Создание структурной схемы гемопоэза облегчило понимание процессов кроветворения как в норме, так и при патологии, и особенно в онкогематологии, что позволило оценивать уровень злокачественной трансформации клеток, соотнося их иммунофенотип с нормальным аналогом и повлияло на разработку принципиально новых схем лечения.
Как уже упомянуто выше, более 60 лет прошло с момента, когда впервые была высказана гипотеза о существовании единой родоначальной гемопоэтической клетки, до получения первых реальных доказательств ее существования. Тогда был разработан и применен в эксперименте метод клонирования кроветворных клеток в селезенке смертельно облученных мышей (Till, McCulloch, 1961). Установлена способность клеток-предшественников гемопоэза образовывать в организме или культуре колонии-клоны, возникающие из одной клонообразующей клетки (Metcalf, Moor, 1971).
Далее, благодаря развитию методов клонирования гемопоэтических клеток-предшественников не только in vivo, но и in vitro, стало возможным глубокое изучение клеток данного отдела гемопоэза, а также была показана неоднородность класса гемопоэтических предшественников. В 70-х гг. были охарактеризованы полипотентные КПГ, способные к самоподдержанию, обеспечивающие стойкое, длительное восстановление гемопоэза. Данные клетки имели высокий потенциал пролиферации и были способны к дифференцировке по всем направлениям гемопоэза (McCulloch, 1970; Lajtha, 1975).
Длительное время полипотентные КПГ отождествлялись с клетками, формирующими селезеночные колонии, т.н. колониеобразующими единицами селезенки КОЕ-С, но дальнейшие исследования показали, что КОЕ-С не являются истинными ГСК, а представляют собой промежуточную фракцию клеток, относящихся к наиболее ранним предшественникам, вступившим на путь дифференцировки. Данная популяция неоднородна и содержит КОЕ-С8, образующие макроскопические колонии в селезенке спустя 8 дней после трансплантации гемопоэтической ткани и КОЕ-С12 с более высоким пролиферативным потенциалом, способные формировать дочерние колонии. Считается, что КОЕ-С12 содержат фракцию клеток, способных длительно поддерживать гемопоэз (Jones et al., 1990; Ploemacher, Brons, 1989).
В культуральных системах in vitro популяцию наиболее примитивных гемопоэтических клеток-предшественников на начальных этапах дифференцировки, а также ГСК в настоящее время отождествляют с клетками, инициирующими долгосрочную культуру клеток костного мозга (КИ-ДККМ) и культуру клеток с высоким потенциалом пролиферации (КОЕ-ВПП) (Bertoncello, 1992; Bredly, Hodson, 1979; Lerner, 1990).
Мышиные КОЕ-ВПП способны генерировать КОЕ-С12 и восстанавливать костный мозг летально облученных мышей (Moore, 1980). Аналогичная популяция выявлена в эмбриональной печени и пуповинной крови человека (Lu et al., 1993; Muench et al., 1994; Bender et al., 1991).
По мере дифференцировки КПГ возрастает ее потенциал пролиферации, а способность к самоподдержанию снижается.
Клонирование гемопоэтических предшественников в краткосрочной культуре вязких сред с добавлением ростовых факторов дало возможность изучать коммитированные клетки-предшественники гемопоэза (КПГ) – клетки, имеющие определенную направленность дифференцировки (Colony assays of Haematopoietic cells, 1995). Считается, что клетка становится коммитированной, как только выходит из состояния покоя, хотя данное утверждение может оспариваться.
Были подробно описаны типы КПГ, вступивших на путь дифференцировки. В настоящее время в пуле коммитированных КПГ выделяют несколько популяций. На 14—18-й день после посева колонии в культуре образуется КОЕ-бласт – клоны из 40—1000 клеток без окончательной дифференцировки, с высокой способностью к самоподдержанию, которые при вторичных пересевах генерируют гетерогенные колонии из зрелых гемопоэтических клеток. Возможно, КОЕ-бласт – это переходная форма от ГСК к коммитированным КПГ (Leary, Ogawa, 1987; Rowley et al., 1987). КОЕ-бласт как клетки, инициирующие долгосрочные культуры, определяются рядом авторов как плюрипотентные.
Следующая в ряду дифференцировок – общий предшественник всех линий гемопоэза с высоким пролиферативным потенциалом – полипотентная КОЕ-ГЕММ (колониеобразующая единица гранулоцитов, эритроцитов, макрофагов и мегакариоцитов). Клетки именно этого пула восполняют при необходимости все ростки гемопоэза. В культуре КОЕ-ГЕММ образует смешанные колонии, в их составе обнаруживаются гранулоциты, эритроидные клетки, мегакариоциты и макрофаги. Клетки данной субпопуляции способны восстанавливать и лимфоидное звено, что было доказано методами меченых генов в сочетании с клонированием клеток (Чертков, Дризе, 1998; Lemieux et al., 1995). КОЕ-ГЕММ очень гетерогенны по размеру и составу, потенциал пролиферации у большей части клеток данного пула чрезвычайно высок, а грань между КОЕ-ГЕММ и СГК несколько размыта; возможно, часть клеток, формирующих такие колонии, могут быть отнесены к разряду стволовых.
Бипотентные клетки-предшественники относятся к разряду коммитированных в отношении миелоидного ростка гемопоэза предшественников, способных дифференцироваться по 2 направлениям. К данному классу клеток-предшественников относят КОЕ-ГМ – колониеобразующие единицы гранулоцитов, макрофагов, а также БОЕ-Э/Мег – раннего общего предшественника эритроцитов и мегакариоцитов (Bol, Williams, 1980; Debile, Columbel, 1996; Ferrero, Broxmeyer, 1983). БОЕ-Э/Мег представлены эритробластами в окружении мегакариоцитов, а КОЕ-ГМ формируют гетерогенные лейкоцитарные колонии в культуре полужидких (вязких) сред на 12-й день от посева и состоят из 100—1000 клеток. (Debile, Columbel, 1996). С точки зрения характеристики трансплантационного материала именно данный класс предшественников имеет наибольшее значение. КОЕ-ГМ определяет быстрое восстановление нейтрофильного звена, тогда как БОЕ-Э/Мег обеспечивают восполнение гемопоэза тромбоцитами и формируют красный росток.
Унипотентные клетки-предшественники: клоногенные предшественники гранулоцитов (КОЕ-Г), макрофагов (КОЕ-М) так же, как и КОЕ-ГМ, формируют колонии как минимум из 20—50 зрелых клеток (более 50 – критерий других лабораторий). При этом клеточные колонии гранулоцитов, содержащие меньшее число клеток, определены как кластеры, большие и малые (10—20 и 20—50 клеток соответственно). Кроме того, некоторыми исследователями принято, что гранулоцитарные колонии, содержащие более 500 клеток, соответствуют наиболее ранним гемопоэтическим предшественникам (в литературе встречаются термины «пре-КОЕ-Г» и «пре-КOЕ-ГМ»), подобным ранним эритроидным предшественникам (БОЕ-Э – бурстобразующие единицы эритроцитов) (Bender, van Epps, 1991; Cashman et al., 1983). БОЕ-Э формируются ранними эритроидными предшественниками на 18—20-й день от посева, могут быть малыми – включают 3—8 кластеров, средними – включают 9—16 кластеров, и большими – более 16 кластеров. Наиболее зрелые эритроидные предшественники – колониеформирующие единицы эритроцитов (КОЕ-Е) – образуют 1 или 2 кластера из 8—100 гемоглобинизированных эритробластов. Колонии такого типа формируются к 10—12-му дню с момента посева. Все клетки класса унипотентных обладают низкой способностью к самоподдержанию и высоким потенциалом пролиферации, обеспечивая быстрое, но кратковременное восстановление определенного (каждая единица – лишь одного) ростка гемопоэза. Материал с преобладанием гемопоэтических клеток-предшественников такого уровня дифференцировки наиболее успешно может быть применен в качестве гематологической поддержки при проведении полужестких химиотерапевтических режимов.
По мере накопления знаний в области изучения клоногенных предшественников были определены нормы количественного содержания различных колониеобразующих единиц при посеве 200 тыс. мононуклеарных клеток костного мозга и 1 мл нормальной периферической крови (табл. 1).
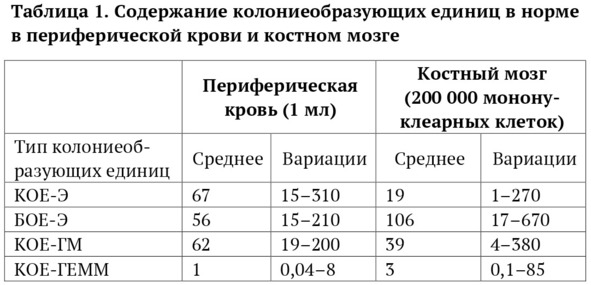
Данные, получаемые при оценке колониеобразования клеток крови, включая КПГ, имеют большое значение с точки зрения качества гематологического материала, который будет применен с целью гематологической поддержки при высокодозной химиотерапии.
Длительное время оценка качества гемопоэтического материала при аутологичной трансплантации проводилась на основании определения роста колоний клеток в различных полужидких системах. Однако отсутствие единых стандартов данного теста из-за многообразия реактивов, а также временная отсрочка в получении результатов делали достаточно информативный метод колониеобразования не совсем удобным для клинического применения.
И всегда возникал вопрос определения момента начала проведения сборов ПСК. Гематологические показатели крови не всегда отражали реальный выброс клеток-предшественников в периферическое русло, и часто сборы требовали проведения более 3 повторных сеансов аферезов.
Данная проблема была решена с момента открытия антигена CD34— – основного маркера гемопоэтических клеток-предшественников (Civin, Strauss, 1984; Katz et al., 1985).
Внедрение в клиническую практику методов проточной цитометрии позволило оценить фенотип клеточной мембраны с помощью моноклональных антител к различным дифференцировочным антигенам. Стало возможным иммунофенотипически охарактеризовать все типы КПГ, включая СГК, и иммунологически различать клетки-предшественники различных классов по уровням коэкспресии на CD34+-клетках других антигенов (Bender et al., 1991; Андреева и др., 2000).
Было установлено, что в норме популяция CD34+-клеток составляет 1—5% мононуклеарных клеток костного мозга и 0,01—0,1% клеток периферической крови, морфологически расцениваемых как бластные формы (Krause, Fackler, 1996; Sperling, Buchner, 1995). При этом уровни экспрессии CD34 могут быть как яркими (++), что определяет СГК, так и средними (+) у коммитированных предшественников и слабыми (-/+) на последних стадиях дифференцировки КПГ.
В настоящее время используется несколько моноклональных антител (МКА) к молекуле CD34: My10, HPCA2, ICH3, IMM3, ICO115, QBEND10 с различными спектрами чувствительности к данной молекуле и ее функциональным эпитопам. Показано, что наиболее качественными с точки зрения определения количеств циркулирующих КПГ являются МКА HPCA-2 с изотипом IgG-1 (Andrews et al., 1986; Loken, 1987; Siena et al., 1991).
Разработано несколько цитометрических протоколов для корректной оценки количества CD34+-клеток в кроветворной ткани, и наиболее распространенным является ISHAGE-протокол, однако в наших исследованиях показано, что применение этого метода может привести к некоторым погрешностям в количестве наиболее примитивных CD45—, CD34+ стволовых кроветворных клеток. Изучение более 1 тыс. образцов мобилизованных стволовых кроветворных клеток крови и стволовых клеток костного мозга позволило нам разработать новый подход к оценке количества CD34+-клеток в любой кроветворной ткани на основании сочетания CD34 и нуклеотропных красителей семейства Syto (Гривцова, 2016).
Важным моментом изучения CD34+-клеток была демонстрация существования высокодостоверной корреляционной положительной взаимосвязи между числом CD34+-клеток в кроветворной ткани и количеством всех основных классов колониеобразующих единиц (Андреева (Гривцова) и др., 2000).
Исследование коэкспрессии на CD34+-клетках других дифференцировочных антигенов подтвердило установленную ранее высокую гетерогенность гемопоэтических стволовых клеток. В сочетании с оценкой роста колоний определение иммунологического фенотипа клеток-предшественников позволило наиболее полно охарактеризовать субпопуляции КПГ и их последовательность в ряду дифференцировок (Socinski et al., 1988), а также соотнести мембранный фенотип КПГ с функциональной активностью клеток (Андреева (Гривцова) и др., 2000; Андреева (Гривцова), 2000; Andreeva (Grivtsova) et al., 1999).
Так, общее число CD34+-клеток складывается из КОЕ-ГЕММ, КОЕ-ГМ, КОЕ-Э, кластеробразующих клеток, а также стволовых, би- и унипотентных клеток-предшественников. В пределах CD34+ СКК существуют минорные субпопуляции непролиферирующих и недифференцирующихся клеток, а также наиболее ранние некоммитированные предшественники, обладающие значительным потенциалом к самоподдержанию.
По мере дифференцировки СКК от истинно стволовых до линейно рестриктированных унипотентных происходят изменения мембранного фенотипа клеток. Иммунологический фенотип CD34+-клеток очень точно отражает стадию зрелости стволовой клетки, или, точнее, клетки-предшественника. На основании экспрессии ряда антигенов на мембране CD34+ можно судить о субпопуляционном составе СКК, т.е. о присутствии среди них полипотентных и линейно коммитированных клеток.
В настоящее время имеются достаточно четкие представления о соответствии между уровнем дифференцировки стволовой клетки или клетки-предшественника и иммунологическим фенотипом ее мембраны (Lanza et al., 2001; Seita et al., 2010).
Говоря об иммунологическом фенотипе клетки, мы подразумеваем под этим целый спектр антигенов и рецепторных молекул экспрессируемых, т.е. присутствующих на мембране и (или) в цитоплазме клетки.
Наиболее ранней стволовой, линейно не рестриктированной (не приобретшей черты какого-либо направления дифференцировки) соответствует клетка, экспрессирующая антиген CD34, но отрицательная в отношении экспрессии таких линейно неограниченных антигенов, как HLA-DR и CD38. Рядом исследований показано, что на клетке такого уровня может выявляться слабая экспрессия молекулы Thy-1, большинство из изотипов которой экспрессируются клетками негемопоэтической природы (D’Arena et al., 1998; Humeau et al., 1996; Mayani et al., 1994). Таким образом, истинной СКК может удовлетворять иммунофенотип CD34+CD90±HLA-DR—CD38—.
Стволовым кроветворным клеткам, только вступившим в цикл дифференцировок, инициирующим рост долгосрочных клеточных культур (КИ-ДККM) и формирующим селезеночные колонии у мышей, с точки зрения иммунологического фенотипа могут соответствовать сразу несколько популяций. Экспрессия антигена CD34 на подобных клетках выраженная (CD34++). Среди данных субпопуляций клеток выявляют СКК, отличающиеся по экспрессии антигенов CD38 и HLA-DR.
На части клеток выявляется молекула CD90, и целый ряд работ подтверждает возможность экспрессии панмиелоидных антигенов CD13, CD33. Однако большинство клеток пула КИ-ДККМ являются CD13—CD33— и, возможно, на данном этапе дифференцировки клетка выбирает путь между лимфоидным и миелоидным путями развития (Gaipa et al., 2002).
Неоднозначной является экспрессия клетками данного уровня дифференцировки молекулы трансферринового рецептора CD71. Классически принято относить данный антиген к клеткам-предшественникам эритроидного ростка (van Dongen et al., 2012), но экспрессия данного антигена возможна на активно пролиферирующих кроветворных клетках ранних этапов дифференцировки.

