
Полная версия
Сборник статей по организации водно-химического режима теплоэнергообъектов
Кислород содержится в подпиточной воде, и его количество определяется (для «чистой» воды) в зависимости от температуры воды. При нуле градусов в воде содержится 14 мг/л О2. Это справедливо для воды, имеющей достаточно длительный контакт с атмосферой и находящейся с ней в равновесии по кислороду. Артезианские воды, не имеющие длительного контакта с атмосферой и не подвергаемые аэрации, могут содержать значительно меньше кислорода.
Таким образом, подпиточная вода всегда содержит достаточное количество кислорода для протекания коррозионных процессов. Кислородная коррозия чрезвычайно быстро протекает при вскипании воды и конденсации пара в воду, которая находится в состоянии насыщения.
Коррозия с водородной деполяризацией протекает при наличии в воде иона водорода, иначе говоря, кислоты. При растворении в воде диоксида углерода образуется угольная кислота H2CO3, которая диссоциирует на ионы водорода H+ и бикарбоната HCO-3. Ион водорода и вызывает активные коррозионные процессы.
Следует отметить, что подвижность ионов водорода и молекулы кислорода в воде различается на порядок. Ион водорода гораздо более подвижен. Поэтому кислотная коррозия протекает значительно быстрее, чем кислородная и практически не зависит от гидродинамических условий. Необходимо сказать, что если имеются условия для протекания коррозии с кислородной и водородной деполяризацией одновременно, то общая скорость коррозии значительно больше, чем для коррозии только с кислородом или водородом.
При этом замечено, что вода, находящаяся в состоянии насыщения (кипения), проявляет активную коррозию именно с кислородной деполяризацией, т.к. кипящая вода способствует значительному увеличению подвижности кислорода. Водородная коррозия, наоборот, уменьшается с увеличением температуры воды. Данное обстоятельство характерно для вод типа конденсата. Автору известны случаи, когда трубопровод возврата конденсата с температурой 40 0С требовал полной замены раз в полгода. При этом трубопроводы конденсата, возвращаемого с температурой 100 0С и больше, не требовали такого частого ремонта, хотя содержание железа в конденсате было более 1 мг/л (довольно существенно). Вероятно, это связано с тем, что при увеличении температуры воды происходит постепенный переход угольной кислоты в газообразный диоксид углерода. При этом наибольший эффект выделения углекислоты из воды происходит при кипении воды.
Для удаления растворенных газов из воды в настоящее время используются две технологии. Термическая дегазация воды и химическая деаэрация и подщелачивание воды.
Строго говоря, удаление газов из воды происходит только при термической дегазации. При химической деаэрации и подщелачивании воды происходит только связывание растворенных газов.
Связывание кислорода происходит по реакциям:
1. При использовании сульфита натрия
2Na2SO3+O2 → 2Na2SO4 ⠀⠀ (2)
2. При использовании гидразингидрата
N2H4*H2O+O2 → 3H2O+N2 ⠀ (3)
Связывание углекислоты в бикарбонат-ион происходит по реакции:
NaOH+H2СO3 = NaHCO3+H2O ⠀ (4)
Поэтому химическая деаэрация и подщелачивание имеют ряд существенных недостатков:
1. При проведении химической деаэрации значительно увеличивается солесодержание питательной воды. При наличии в воде кислорода в количестве 8 мг/л количество бисульфита натрия, расходуемого для его связывания, будет равно 100 мг/л (с учетом неэффективного перемешивания). Соответственно, на 100 мг/л вырастает солесодержание питательной воды и также растет непрерывная продувка парового котла. Необходимо отметить, что при использовании гидразингидрата солесодержание воды не увеличивается, но сам реагент чрезвычайно токсичен (относится к первому классу опасности), пожароопасен и требует специфических условий хранения, что исключает его применения для паровых котельных, особенно работающих на пищевых производствах.
2. При проведении химической деаэрации в воде остаются сульфиты, что связано с их избыточным дозированием для гарантированного связывания кислорода. Как правило, производители котлов достаточно жестко регламентируют содержание сульфитов в котловой воде (5—10 мг/л), что представляет значительную сложность в организации процесса дозирования сульфита натрия в питательную воду. Сульфит-ион (SO3) является сильным восстановителем и значительно усиливает коррозионные процессы, протекающие в котле и пароконденсатном тракте путем разрушения пассивирующего слоя на поверхности металла.
3. Еще одним не всегда учитываемым моментом является то, что при дозировании сульфита натрия в воде образуется сульфат натрия Na2SO4, который, по сути, увеличивает содержание сульфат-иона в питательной воде, и при проскоке жесткости или постоянно повышенной жесткости в питательной воде в котле возможно образование нерастворимого сульфата кальция СaSO4 (гипса). Типичным примером может служить питание водогрейного котла с жесткостью 0,7 мг-экв/л (допускается для котлов с температурным графиком 95/70). В этом случае значительное увеличение сульфатов в подпиточной воде может привести к образованию гипса, что впоследствии будет требовать механической очистки котла. Второй пример – это некачественная работа системы водоподготовки парового котла. В паровой котельной наблюдался постоянный проскок по жесткости питательной воды и при этом в большом объеме дозировался сульфит натрия для связывания кислорода. Зная о постоянном проскоке солей жесткости, раз в год проводилась кислотная промывка парового котла. В год после введения в технологию подготовки воды химической деаэрации, при внутреннем осмотре котла после кислотной промывки, обнаружились нерастворенные белые отложения в значительном количестве. Анализ отложений показал, что это сульфат кальция. После этого было принято решение о прекращении дозирования сульфита натрия.
4. Подщелачивание питательной воды каустической содой всего лишь связывает угольную кислоту в бикарбонат (4), который в котле снова перейдет в угольную кислоту, которая испарится с паром и впоследствии перейдет в конденсат, вызывая понижение рН конденсата и значительно увеличивая его коррозионные свойства. Таким образом, подщелачивание питательной воды всего лишь позволяет избежать углекислотной коррозии питательного тракта парового котла, но при этом увеличивает коррозионные свойства конденсата.
Термическая дегазация воды позволяет не только удалить из воды кислород и углекислоту, но и значительно уменьшить коррозионные свойства возвращаемого конденсата.
Составим материальный баланс по углекислоте тепловой схемы котельной (рис. 1, 2).
Перед составлением баланса по углекислоте необходимо обстоятельно разобраться с понятиями так называемой свободной, связанной и полусвязанной углекислоты, содержащейся в воде.
Проведем простой мысленный эксперимент. Имеется определенный объем воды. Вода условно чистая, содержит только молекулы H2O. Значение рН такой воды 7,0. Т.е. количество ионов водорода равно количеству ионов гидроксила. Допустим, что данная вода контактирует с твердым карбонатом кальция. Карбонат кальция растворим только в воде, имеющей кислую реакцию. Другими словами, в воде, имеющей большее количество ионов водорода по отношению к ионам гидроксила. Ионы водорода могут быть введены в воду как с сильными кислотами, такими как соляная кислота, так и слабыми, такими как угольная кислота. Существует принципиальное отличие между сильными и слабыми кислотами. Так, в сильных кислотах ион водорода, отвечающий за кислую реакцию, привносится или уже существует в воде с собственным анионом (Cl, SO4), то слабая угольная кислота, растворенная в воде, образуется из углекислого газа путем связывания гидроксил-иона молекулы воды в бикарбонат-ион, соответственно, с получением кислого остатка в виде иона водорода.
Запишем уравнение реакции растворения в воде твердого карбоната кальция (CaCO3) при использовании угольной кислоты, поступающей в воду из воздуха от различных процессов окисления органического углерода либо от геологических процессов:
CaCO3+H2CO3 = Ca (HCO3) 2⠀⠀ (5)
Протекает обратимая реакция, при которой твердый карбонат кальция (CaCO3) переходит в растворенную форму бикарбоната кальция (Ca (НCO3) 2). Угольная кислота в виде карбоната, ассоциированная с кальцием, и есть связанная форма углекислоты, эквивалентно равная половине бикарбоната кальция, растворенного в воде. Вторая половина бикарбоната кальция, образовавшаяся не из твердого бикарбоната кальция, а из угольной кислоты, называется полусвязанной углекислотой.
Свободная углекислота в воде находится в форме именно угольной кислоты (H2CO3), т.е. не связана напрямую ни с одним катионом в воде. Тем не менее именно свободная угольная кислота, являющаяся частью буферной углекислотной системы воды, и определяет текущее значение рН воды.
Вернемся к нашему эксперименту. Получается, что, пропуская через наш объем воды углекислый газ (СО2), в воде образуется свободная углекислота (H2CO3), которая, реагируя с карбонатом кальция (известняком) по уравнению (5), растворяет его с образованием бикарбоната кальция, причем половина бикарбонат-иона, выраженного в эквивалентных концентрациях, относится к связанной форме углекислоты, а вторая половина к полусвязанной (пришедшей из углекислого газа). Растворение известняка будет проходить до тех пор, пока через воду будет пропускаться углекислый газ. Причем увеличение содержания в растворе бикарбонат-иона будет требовать увеличения концентрации углекислого газа в воде для поддержания процесса растворения.
После окончания пропускания углекислого газа через воду система начнет приходить в новое равновесное состояние. Закончится растворение известняка и начнется постепенное выделение растворенной свободной углекислоты в окружающий воздух. В атмосфере Земли средняя концентрация углекислого газа составляет примерно 0,4 мг/л. Соответственно, в идеальных условиях концентрация углекислого газа в воде должна достичь такой же концентрации. Но в природе в открытых проточных водоемах концентрация свободной углекислоты составляет от 2 до 5 мг/л, что соответствует значению рН 7,7—7,9. Вероятно, это связано с определенными биологическими и геологическими процессами, обеспечивающими поступление углекислого газа в воду не из атмосферы.
Таким образом, при выделении углекислоты из воды в атмосферу реакция по уравнению (5) протекает в сторону образования твердого карбоната кальция. В конце концов достигается «конечное» равновесие и вода начинает обладать ионным составом, свойственным для геологических и биологических условий данной местности. В нашем эксперименте это контакт с известняком и атмосферным воздухом.
Понимая, что такое связанная, полусвязанная и свободная углекислота в воде, рассмотрим уравнение реакций, протекающих при термической деаэрации Na-катионитовой воды. Классический подход выделяет три стадии удаления всех видов углекислоты из воды:
1. Выделение свободной СО2 за счет кипения и отвода с паром. Данный процесс должен происходить (начинать и завершаться) в деаэрационной колонке. При условии начала кипения подпиточной воды на тарелках. Для этого должен быть обеспечен подогрев подпиточной воды перед деаэрационной колонкой. Чем выше подогрев подпиточной воды, тем раньше начинается кипение в деаэрационной колонке, тем эффективнее и полнее осуществляется отвод свободной углекислоты из подпиточной воды. В случае отсутствия кипения или позднего начала кипения подпиточной воды в деаэрационной колонке свободная углекислота может попасть в деаэраторный бак, где будет связана в бикарбонат натрия карбонатом натрия, образовавшегося там при разложении предыдущего бикарбоната натрия (по уравнению 6 процесс справа налево), и тем самым процесс выделения полусвязанной углекислоты значительно затормозится. Будет требоваться гораздо большее время пребывания воды в деаэраторном баке и гораздо больше пара придется подавать на барботаж воды.
2. На второй стадии происходит разрушение бикарбонат-иона за счет продолжающегося интенсивного отвода углекислоты из воды с образованием карбоната (6). Данный процесс происходит, как правило, в деаэраторном баке при интенсивном барботаже воды паром.
2NaHCO3 = Na2CO3+Н2CO3свобод = Na2CO3+CO2газ+ Н2О (6)
Полноту протекания данного процесса в деаэраторе можно оценить по значению рН воды после деаэратора. Значение рН воды после деаэратора будет определяться по отношению содержания карбонат-иона к гидрокарбонат-иону (уравнение Хендерсона-Хассельбальха для разложения бикарбоната HCO3=H+CO3)

К примеру, вода, содержащая 2 моля бикарбоната натрия (6), подвергается барботированию в деаэраторе. В результате отвода СО2 бикарбонат-ион переходит в карбонат-ион. В зависимости от интенсивности отвода СО2 на выходе из деаэратора в воде устанавливается равновесие между карбонатом и бикарбонатом, при этом происходит только разложение половины бикарбоната. Соответственно, в результате парового барботажа воды получаем содержание в ней 1 моля бикарбоната натрия, 0,5 моль карбоната натрия и 0,5 моль углекислого газа. Углекислый газ был отведен в атмосферу. Тогда в соответствии с (7) получаем:

Значение рН дегазированной воды после деаэратора получается 9,99. При этом в деаэраторе произведена отгонка только свободной углекислоты и разрушение и отгонка половины полусвязанной углекислоты (четвертая часть исходного бикарбоната).
Предположим, в деаэраторе разрушается не половина, а ¾ бикарбоната натрия. Тогда, получаем в результате отгонки углекислоты, остается одна четверть бикарботана, или 0,5 моля бикарбоната, и, соответственно, на 0,5 моля на карбонат, 0,5 моля на гидрат и 1 моль на углекислоту (которую отогнали в деаэраторе). В данном случае половину углекислоты удалили в деаэраторе от исходного количества бикарбоната. В данном примере в воде появляется гидрат в результате процесса гидролиза карбонатов. В данном случае уравнение (7) запишется следующим образом:
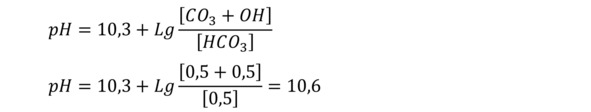
Процесс гидролиза бикарбонатов и карбонатов подробно рассмотрен в статье «Определение количества бикарбонатов, карбонатов и гидратов в воде в зависимости от значения рН воды».
Рассчитаем значение рН воды, которое необходимо получить на выходе из деаэратора, соответствующее равному (одинаковому) содержанию бикарбоната и карбоната, т.е. бикарбоната, карбоната и угольной кислоты будет равное количество – по 0,665 моля. 0,665*3= 2 моля исходного бикарбоната. Соответственно,

Значение рН=10,3 соответствует константе диссоциации бикарбоната по уравнению HCO3 <-> H+CO3. Т.е. количество бикарбоната равно количеству карбоната. Можно сказать, что при данном рН воды половина бикарбоната подпиточной воды разложилась в деаэраторе, но при этом отогналась только третья часть общей суммы всех форм диоксида углерода (8).
0,665NaHCO3= 0,665Na2CO3+0,665CO2газ+Н2О ⠀⠀ (8)
– Третья стадия – продолжение отвода углекислоты из воды при интенсивном кипении, за счет чего карбонат гидролизируется с образованием углекислого газа и высвобождением гидроксил-иона из молекулы воды (9). Данный процесс не требует отвода углекислоты из воды. Это обычная реакция гидролиза технической соды в воде. Поэтому, вероятно, неправильно говорить о разрушении связанной углекислоты (карбоната) за счет отвода газообразной углекислоты. Скорее надо говорить о гидролизе технической соды в воде. Данные условия обеспечиваются как в деаэраторе, так и тем более в котле. Можно сказать, что скорость протекания реакции (9) лимитируется остаточным содержанием бикарбоната в воде, а не скоростью отвода углекислого газа в (9). А уже концентрация бикарбоната зависит от эффективности отвода растворенной углекислоты (6).
Na2CO3+ H2O=2NaOH+ CO2газ ⠀⠀ (9)
Na2CO3+ H2O=NaOH+ NaHCO3 ⠀⠀ (10)
Считается, что чем выше температура и давление в котле, тем полнее происходит разложение карбонатов в котловой воде за счет условий, обеспечивающих чрезвычайно эффективный отвод углекислоты из воды. Полное разложение карбонатов получается в котлах при давлении 5 МПа [1]. Тем не менее автор считает, что разрушения карбонатов как такового нет. Происходит их гидролиз (9, 10). Соответственно, чем меньше бикарбоната в воде, тем полнее идет гидролиз карбонатов, и именно это определяет полноту разложения карбоната. Так, при работе парового котла на давлении 6 бар и подпитке котла обессоленной водой после обратного осмоса с щелочностью около 0,25 мг-экв/л в котловой воде фактически не обнаруживается бикарбонат и карбонат-ион. Только гидроксил (присутствует только фенолфталеиновая щелочность).
Обратите внимание, что после деаэратора при его нормальной работе вода имеет значение рН, как правило, около 8,5—10,0, что говорит об одновременном протекании в деаэраторе реакций (6) и (9, 10).
Таким образом, можно записать:
2NaHCO3=Na2CO3+Н2CO3=Na2CO3+CO2газ+Н2О =
2NaOH+CO2газ ⠀⠀ ⠀⠀ ⠀⠀ ⠀⠀ ⠀⠀ ⠀⠀ ⠀⠀ ⠀⠀ ⠀⠀ (11)
В результате в деаэраторе и деаэраторной колонке происходят следующие процессы. В воде ХВО, поступающей в деаэратор, как правило, содержится свободная углекислота, которая не позволяет осуществляться реакции (6), уравновешивая бикарбонат. Постепенно удаляя свободную углекислоту из воды, бикарбонат начинает переходить в карбонат. При этом карбонат гидролизируется в воде на гидроксид натрия и углекислый газ, который удаляется с паром. Гидроксид натрия повышает значение рН воды.
Итак, непосредственно в деаэраторе должна выделяться вся свободная углекислота и часть полусвязанной углекислоты. Как показано выше, при значении рН деаэрированной воды около 10 только половина полусвязанной углекислоты выделится в деаэраторе. Соответственно, оставшаяся часть перейдет в котел, где будет происходить выделение углекислоты в пар по одновременно протекающим реакциям (6) и (9, 10). В котле фактически полностью завершится переход бикарбонат-иона в карбонат (6) и, соответственно, образование гидроксида натрия из карбоната (9, 10). Полнота разложения бикарбонатов, а не как принято говорить карбонатов, в котле будет определяться величиной щелочности подпиточной воды, процентом возврата конденсата, давлением в котле.
Если предположить условия: что вся свободная углекислота выделится в деаэраторной колонке. Затем в деаэраторном баке выделится углекислота от разрушения половины полусвязанного бикарбоната; далее в котле выделится вторая половина полусвязанного бикарбоната, а также в деаэраторе и в котле будет происходить гидролиз карбоната натрия. То можно сказать, что в деаэраторе выделится количество углекислоты, равное четверти содержания бикарбонат-иона (щелочности) подпиточной воды, а в котле выделится количество углекислоты, численно равное трем четвертям значения щелочности подпиточной воды. Значение рН деаэрированной воды будет 9,99.
Запишем:
СО2пит=3/4*Щподп, ммоль/л ⠀⠀ (9)
где СО2пит – концентрация связанной и полусвязанной углекислоты в питательной воде;
Щподп – щелочность подпиточной воды, ммоль/л.
Запишем уравнение материального баланса по углекислоте для деаэратора (рис. 1).
(1-q) *CO2пит+q*СО2под=1*СО2пит ⠀⠀ (12)
где q – доля подпитки воды ХВО или доля потери конденсата;
СО2пит – концентрация углекислоты в питательной воде равна СО2пар.
Данная запись уравнения материального баланса углекислоты в деаэраторе предполагает, что концентрация углекислоты в паре равна концентрации углекислоты в питательной воде. Т.е. в котле происходит полное разложение бикарбонатов и карбонатов, и возврат конденсата осуществляется в деаэраторный бак (не деаэраторную колонку) (рис. 1).
Решив уравнение, получаем
СО2пит=СО2под=3/4*Щподп ⠀⠀ (13)
Получается, что в случае возврата конденсата без отгонки свободной углекислоты (в деаэраторный бак) содержание углекислоты в питательной воде не зависит от доли возврата конденсата. В производственной практике автора довольно часто встречаются подобные случаи. Даже при возврате 90% конденсата в котельную, при неправильной работе деаэратора конденсат содержит большое количество углекислоты и коррозионно агрессивен.
Т.е. если щелочность подпиточной воды 2,5 ммоль/л и доля подпитки составляет всего 10%, содержание углекислоты в конденсате составит ¾*2,5=0,93 ммоль/л или 0.93*44=41мг/л, что превышает допустимое количество углекислоты в паре (20 мг/л) в 2 раза. Это говорит о том, как важно отгонять углекислоту из конденсата при возврате его в деаэратор.
Если производится отгон углекислоты из конденсата. Конденсат возвращают в деаэраторную колонку (рис. 2), тогда
(1-q) * CO2конд + q * СО2под =1 * СО2пит
CO2конд = 0
СО2пит = q * СО2под ⠀⠀⠀⠀ ⠀⠀⠀⠀ ⠀⠀ ⠀⠀ (14)
Тогда для вышеприведенных условий
СО2пит=0,1*3/4*2,5=0,093 ммоль/л или 4,1 мг/л.
Для значения щелочности подпиточной воды 2,5 ммоль/л в случае «идеальной» работы деаэратора, т.е. значительный подогрев исходной воды 80 0С и более; использование пара на «зеркало», продувку деаэрационной колонки; использование пара на барботаж, при этом температуру воды в баке лучше поддерживать не менее 108 0С; время нахождения воды в деаэрационном баке не менее 1 часа. При данном режиме работы можно получить значение рН деаэрированной воды около 10,3 (из собственного опыта эксплуатации). При этом ранее было показано, что в деаэраторе отгоняется 1/3 часть угольной кислоты. Соответственно, концентрация углекислого газа в питательной воде и, соответственно, в паре составит:
– При отсутствии возврата конденсата:
СО2пит=1/3*2,5=0,83 ммоль/л или 36,7 мг/л.
Концентрация СО2 в паре близка к нормативу (до 20 мг/л)
– При возврате конденсата 50%:
СО2пит=1/3*0,5*2,5=0,417 ммоль/л или 18,3 мг/л.
– При любом проценте возврата конденсата без отгонки углекислоты в деаэраторной колонке:
СО2пит=1/3*2,5=0,83 ммоль/л или 36,7 мг/л.
Даже при «идеальной» работе деаэратора возврат конденсата без предварительной отгонки углекислоты в деаэраторной головке приводит к повышенному содержанию углекислоты в паре.
Приведенные выше примеры и расчеты предполагают полное разложение бикарбонатов и гидролиз карбонатов в котле. Тем не менее считается, что в реальных условиях, как уже было сказано, полное разложение не достигается. Для оценки степени разложения бикарбоната и гидролиза карбоната на работающем котле достаточно провести анализ на щелочность котловой воды по фенолфталеину и метилоранжу. Доля неразложившегося карбоната и бикарбоната в котле определяется долей метилоранжевой щелочности в общей щелочности котловой воды.
∂к =Щм. о/ (Щф/ф+ Щм. о) ⠀⠀ (15)
где ∂к – доля углекислоты, оставшаяся в виде бикарбоната и карбоната в котловой воде после отгонки части углекислоты;
Щм. о – щелочность по метилоранжу, моль/л;
Щф/ф – щелочность по фенолфталеину, моль/л.
Для пояснения рассмотрим несколько примеров.
Предположим, щелочность исходной воды составляет НСО3 = 10 ммоль/л. Производим отгонку углекислоты. Затем производим анализ воды на щелочность по фенолфталеину и метилоранжу. В результате получаем, что количество кислоты на титрование по фенолфталеину равно 1 мл, по метилоранжу 9 мл.
Запишем схему разложения бикарбоната (процесс разложения бикарбоната описан в статье «Определение количества бикарбонатов, карбонатов и гидратов в воде в зависимости от значения рН воды»):
8,0NaHCO3 ⇿ 1,0Na2CO3+1,0CO2газ+Н2О
Т.е. концентрация бикарбоната 8,0 ммоль/л, карбоната – 1 ммоль/л. Количество выделившегося углекислого газа составит 1,0 ммоль/л. Исходное количество бикарбоната было 10 ммоль/л.
Получаем:
∂к =Щм. о/ (Щф/ф+ Щм. о) =9/ (9+1) =0,9
0,9 – доля углекислоты, оставшаяся в виде бикарбоната и карбоната в воде.
Т.е. только 10% углекислоты было удалено, что соответствует схеме разложения бикарбоната. Исходного бикарбоната 10 ммоль/л, количество удаленного углекислого газа 1,0 ммоль/л.
Продолжаем отгон углекислоты из воды и получаем следующие показатели.
По результатам анализа: количество кислоты по фенолфталеину – 6 мл, по метилоранжу – 4 мл.
Запишем схему разложения бикарбоната:







