Полная версия
Эволюция. Классические идеи в свете новых открытий
Биологам из Канады и Германии удалось получить экспериментальное подтверждение этой идеи в ходе экспериментов с коловратками Brachionus calyciflorus. Подопытные коловратки были выведены из яиц, собранных в одной природной популяции. Ранее было показано, что в этой популяции есть наследственная изменчивость по склонности к сексу, а раз есть наследственная изменчивость, то возможна и эволюция под действием отбора.
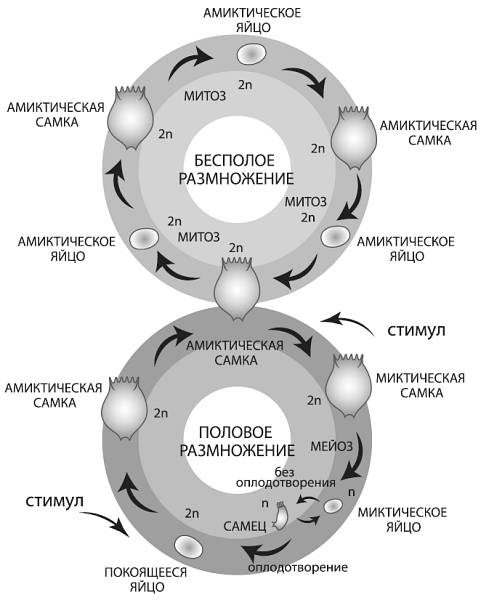
Жизненный цикл коловраток класса Monogononta. Из Becks, Agrawal, 2010.
Ученые вывели из собранных яиц 120 лабораторных популяций, изначально одинаковых по своим свойствам и уровню изменчивости. Часть популяций затем выращивали в однородных, часть – в разнородных условиях в течение 14 недель, что соответствует примерно сотне поколений. Численность каждой популяции поддерживалась на уровне около 10 тыс. особей.
Разнородные условия были смоделированы следующим образом. Популяцию делили на две части (субпопуляции). Одну часть помещали в богатую питательную среду, а другую – в бедную. Богатство среды определялось количеством одноклеточных водорослей, которыми питаются коловратки, а количество водорослей – концентрацией азота в воде. Время от времени в каждом аквариуме часть воды заменяли на свежую питательную среду, чтобы количество пищи оставалось примерно постоянным. Миграции между субпопуляциями осуществлялись путем еженедельного пересаживания части коловраток и их яиц из одного аквариума в другой. Использовали два разных уровня миграции: 1 % и 10 % особей за поколение.
В «однородных» экспериментах все делалось точно так же, за исключением того что среда в обоих аквариумах была одинаковая: либо богатая, либо бедная.
Исследователи следили за изменениями частоты полового размножения и «наследственной склонности» к нему в каждой популяции. Реальную частоту определяли по соотношению амиктических (неоплодотворенных) и покоящихся (оплодотворенных) яиц. Изменения «наследственной склонности» (частот аллелей, регулирующих склонность к половому размножению) определяли при помощи индивидуального тестирования клонов коловраток. Из каждой популяции брали по 84 самки и выводили из них небольшие партеногенетические клоны. Затем в воду, где жили эти клоны, добавляли немного воды из аквариума с высокой плотностью самок (как уже говорилось, это стандартный способ сексуальной стимуляции коловраток) и подсчитывали число клонов, перешедших к половому размножению.
В начале эксперимента подопытные популяции продемонстрировали высокую готовность к сексу: более 80 % клонов переходили к половому размножению при стимуляции. Через шесть недель в популяциях, живших в однообразной среде, этот показатель упал до 60 %, еще через шесть недель – до 40 %. Таким образом, в однородной среде коловратки эволюционировали в сторону отказа от секса. Этот процесс шел с одинаковой скоростью как в бедной, так и в богатой среде.
В популяциях, живших в разнообразной среде, через 6 и 12 недель после начала эксперимента наблюдался более высокий уровень полового размножения. Он тоже снизился по сравнению с исходным, но совсем ненамного. По истечении 12 недель 70 % клонов в этих популяциях по-прежнему были готовы перейти к половому размножению в ответ на соответствующий стимул. Уровень миграции (1 % или 10 % мигрантов на поколение) не повлиял на результаты эксперимента.
Почему частота полового размножения все-таки снизилась даже в этих популяциях? Возможно, это объясняется тем, что природная популяция коловраток, из которой были выведены лабораторные, живет в еще более разнородных условиях, чем те, что были созданы в эксперименте.
По прошествии 14 недель авторы объединили все экспериментальные популяции, хорошенько перемешали и снова разделили на 120 изолированных линий. Склонность к сексу в этих линиях изначально была около 45–50 %. Их опять поместили в однородные или разнородные условия. В первом случае частота полового размножения продолжала снижаться, во втором – начала расти. Таким образом, содержание в разнородных условиях может не только замедлять снижение частоты полового размножения, но и приводить к ее росту.
По-видимому, для таких разнородных условий, которые были созданы в эксперименте, устойчивая или равновесная частота полового размножения находится где-то между 55 и 70 %. Если частота оказывается ниже равновесного уровня, «гены полового размножения» получают селективное преимущество над «генами асексуальности», и наоборот. В однородных условиях равновесный уровень составляет не более 25–30 % (до этой отметки упала склонность к сексу у подопытных популяций к концу 20-й недели), а может быть и вовсе равен нулю. Исследователи допускают, что если бы они продолжили эксперимент, то, наверное, смогли бы вывести коловраток, полностью утративших интерес к сексу, подобно тому как это произошло с бделлоидными коловратками.
Полученные результаты согласуются с идеей о том, что половое размножение помогает разбивать комбинации генов, подходящие для одних условий, но невыгодные в других. Это подтверждается, в частности, тем, что коловратки, жившие в течение 15 недель в однородной (бедной или богатой) среде, действительно адаптировались к этим условиям. Адаптированность оценивали по среднему числу потомков, производимых одной самкой в течение жизни. Коловратки, приспособившиеся к богатой среде, производят в ней в среднем около девяти потомков за жизнь, но, если их пересадить в бедную среду, их репродуктивный успех падает до пяти потомков. Самки, адаптировавшиеся к бедной среде, производят около шести потомков, а если их пересадить в богатую среду, их плодовитость падает до 5,5. Следовательно, разные условия действительно способствовали отбору разных аллелей.
По-видимому, разнообразие условий среды является важным фактором, не позволяющим большинству организмов отказаться от секса.
Дрожжи занимаются сексом не от хорошей жизни
Хотя вопрос о том, почему большинство живых существ предпочитают сложный процесс полового размножения простому бесполому, продолжает оставаться любимой головоломкой эволюционистов-теоретиков, в общем виде эта задача была решена, по-видимому, еще Августом Вейсманом в конце XIX века (Weismann, 1889). Вейсман предположил, что секс увеличивает разнообразие потомства, тем самым предоставляя материал для отбора и повышая его эффективность, что позволяет организмам быстрее адаптироваться.
Сегодня, по прошествии века с четвертью, можно сказать, что гипотеза Вейсмана при всей ее расплывчатости и неконкретности в целом подтвердилась. Правда, попытки ее конкретизировать породили новые проблемы. Появилось несколько конкурирующих теорий, которые по-разному оценивают влияние полового размножения на эффективность разных форм отбора. Одни модели, как мы уже знаем, видят в сексе прежде всего способ ускоренного накопления полезных мутаций (повышение эффективности положительного отбора). Другие подчеркивают роль секса в отбраковке вредных мутаций (отрицательный отбор). Поставить эксперимент, который позволил бы разделить эти два эффекта, трудно, потому что мы не умеем напрямую регулировать соотношение полезных и вредных мутаций у подопытных организмов. Можно, однако, регулировать его косвенно, меняя степень благоприятности среды. «Благоприятность» означает, что организмы хорошо приспособлены именно к такой среде, многие их гены подогнаны к ней оптимальным образом. Поэтому в идеальных условиях вероятность появления полезных мутаций минимальна. В неблагоприятной среде частота полезных мутаций должна быть выше: случайные перемены с большей вероятностью пойдут на пользу организму, если ему живется плохо. Что касается вредных мутаций, то они в обоих случаях должны возникать намного чаще, чем полезные. Однако их средняя «вредность», скорее всего, будет меньше, если условия благоприятны. Дело в том, что живые организмы, как правило, имеют «запас прочности». Например, у дрожжей из бооо генов только 1000 абсолютно необходимы для выживания в идеальных условиях. Все остальные нужны для борьбы с разного рода трудностями, т. е. для жизни в неоптимальной среде (Hillenmeyer et al., 2008). Ясно, что мутации, нарушающие работу этих «дополнительных» генов, будут в среднем более вредными в стрессовых условиях, чем в оптимальных.
Все эти соображения были учтены Джереми Греем и Мэттью Годдардом из Оклендского университета (Новая Зеландия) при планировании эволюционного эксперимента, в ходе которого они попытались сравнить влияние секса на эффективность положительного и отрицательного (стабилизирующего) отбора (Gray, Goddard, 2012).
В эксперименте использовались линии дрожжей, различающиеся по скорости мутирования и по способности к сексу. Наряду с обычными, «дикими» дрожжами, у которых средняя частота мутирования составляет 6,9×10−8 мутаций на пару нуклеотидов за поколение (в геноме дрожжей 1,2×107 пар нуклеотидов), использовались дрожжи с удаленным геном MSH2. Этот ген участвует в исправлении ошибок в ДНК, поэтому его удаление привело к десятикратному ускорению мутагенеза – до 7,3×10−7 мутаций на пару нуклеотидов за поколение.
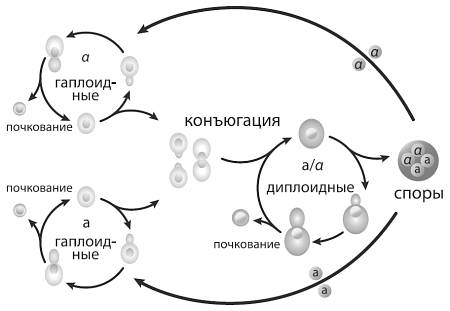
Жизненный цикл дрожжей Saccharomyces cerevisae.
Кроме того, чтобы лишить часть подопытных линий способности к сексу, авторы удалили у них два гена (SPO11 и SPO13), необходимых для мейоза. В результате получились «бесполые» дрожжи, не отличающиеся от обычных ни по скорости размножения, ни по другим существенным характеристикам. Дрожжи размножаются бесполым путем (почкованием), пока им хватает пищи. Голодание стимулирует мейоз, в результате которого диплоидная клетка превращается в четыре гаплоидные споры. Гаплоидные клетки подразделяются на два пола (a и α). Разнополые клетки сливаются попарно, образуя зиготу, после чего цикл повторяется. Генно-модифицированные бесполые дрожжи при голодании тоже пытаются превратиться в споры, но вместо четырех гаплоидных спор у них получаются две диплоидные, вполне жизнеспособные и не нуждающиеся в слиянии с кем бы то ни было.
Всего, таким образом, авторы получили дрожжевые клетки четырех типов:
1) способные к сексу, с низкой скоростью мутирования;
2) способные к сексу, с высокой скоростью мутирования;
3) бесполые, с низкой скоростью мутирования;
4) бесполые, с высокой скоростью мутирования.
Половину подопытных популяций выращивали в благоприятных условиях (при температуре 30 °C в несоленой среде), остальные поместили в стрессовые условия (37 °C, 1,17 % NaCl). В общей сложности в эксперименте приняли участие 24 подопытные популяции: по три популяции каждого из четырех типов эволюционировали в благоприятных и столько же – в стрессовых условиях. Эксперимент продолжался в течение 300 бесполых поколений, между которыми были равномерно распределены 11 раундов полового размножения. Все популяции одновременно подвергались голоданию, что стимулировало образование гаплоидных спор у обычных дрожжей и диплоидных – у бесполых.
Авторы следили за тем, как меняется приспособленность дрожжей по сравнению с предковым штаммом. Для этого подопытные дрожжи смешивали с предками в пропорции 1:1 и измеряли относительную скорость размножения эволюционировавшей популяции.
В благоприятных условиях ни способность к половому размножению, ни скорость мутагенеза не повлияли на ход эволюции. Приспособленность дрожжей всех четырех типов лишь слабо колебалась и спустя 300 поколений осталась на исходном уровне.
Это значит, что полезные мутации, по-видимому, почти не возникали (как и следовало ожидать в благоприятных условиях), и положительному отбору нечего было поддерживать. Результат соответствует общепринятому мнению, что в оптимальных условиях отрицательный отбор преобладает над положительным. Скорость мутирования, даже искусственно повышенная, вероятно, оказалась все же недостаточной, чтобы вызвать генетическое вырождение за 300 поколений.
В неблагоприятных условиях картина получилась другая. Наблюдался рост приспособленности у дрожжей, способных к сексу, – как у обычных, так и у «мутаторов». У бесполых дрожжей с низкой скоростью мутирования рост приспособленности был выражен намного слабее. Что же касается бесполых линий с повышенной скоростью мутирования, то их приспособленность снижалась: началось генетическое вырождение.
Рост приспособленности свидетельствует о накоплении полезных мутаций. Очевидно, в неблагоприятных условиях случайные мутации действительно оказываются полезными чаще, чем в оптимальных. Эксперимент подтвердил, что половое размножение повышает эффективность положительного отбора, помогая накапливать полезные мутации. Это видно из того, что обычные дрожжи приспособились к стрессовым условиям лучше, чем бесполые.
То, что в неблагоприятных условиях у бесполых дрожжей-мутаторов началось вырождение, говорит о том, что в такой ситуации отрицательный отбор уже не мог справиться с отбраковкой вредных мутаций, и они начали накапливаться. Тем временем точно такие же дрожжи, но только способные к сексу, в таких же условиях быстро повышали свою приспособленность. Из этого следует, что в неблагоприятных условиях важную роль играют обе формы отбора, причем половое размножение повышает эффективность обеих.
Микробам – горизонтальный перенос, высшим организмам – половое размножение
Рассмотренные примеры говорят о пользе скрещивания и перемешивания генов при половом размножении. Но у бактерий и архей вместо настоящего амфимиксиса работает горизонтальный перенос. Будет ли секс и в этом случае выполнять ту же функцию – быстро приспосабливать организмы к изменившимся условиям? Если это так, то ГПГ у микробов должен быть очень широко распространен и практиковаться не только между популяциями, но главным образом между особями одной популяции. Полезный аллель, который легко позаимствовать, скорее всего, окажется у близкого собрата.
Традиционно преобладала точка зрения, что отбор у бактерий все-таки в основном клональный, действующий на уровне целых геномов. Это значит, что ГПГ не играет существенной роли в повседневных «попытках» прокариот приспособиться к изменчивой среде. Эта гипотеза теперь, при нынешнем развитии биотехнологий, легко проверяема. Такой труд взяли на себя биологи из Массачусетского технологического института: они показали, что традиционная точка зрения неверна или верна только отчасти и что в своей повседневной переменчивой жизни микробы то и дело заимствуют гены у своих ближайших родичей – других микробов той же популяции (Shapiro et al., 2012).
Биологи работали с двумя популяциями морских планктонных бактерий Vibrio cyclitrophicus. Эти популяции, обозначаемые буквами L и S, находятся в процессе адаптации к разным экологическим нишам: часть бактерий приурочена к крупным (L), а другая – к мелким (S) частицам, отфильтрованным из морской воды. Результаты генетического анализа говорят о том, что разошлись они недавно (Hunt et al., 2008). По-видимому, популяции L и S приспосабливаются к жизни на разных представителях зоо– или фитопланктона[41].
Авторы решили выяснить, какой из двух процессов преобладает на начальных этапах экологической дифференциации – отбор отдельных генов с удачными мутациями, которые распространяются за счет ГПГ, или клональный отбор, работающий с целыми геномами.
Различить эти две ситуации можно, сравнив внутри– и межпопуляционный генетический полиморфизм (вариабельность) изучаемых популяций. Если преобладает отбор на уровне генов, две популяции должны четко отличаться друг от друга по небольшому числу генов – тех, от которых зависят экологические свойства популяций. При этом различающиеся участки генома должны иметь пониженный уровень внутрипопуляционного полиморфизма хотя бы в одной из двух популяций. Ведь на каждый такой участок действовал отбор, который поддерживал какой-то один вариант этого участка, вытесняя из генофонда другие его варианты (см. раздел «Следы естественного отбора» в главе 2). Напротив, те участки генома, которые у двух популяций сходны, должны быть более полиморфными в пределах каждой популяции, причем наборы вариантов (аллелей) могут быть одинаковыми в двух популяциях. Ведь отбор, связанный с приспособлением к новой нише, на них не действовал и они могли сохранить исходный полиморфизм, накопленный предками.
Если же в процессе расхождения популяций преобладал клональный отбор, то и уровень полиморфизма, и генетические различия между популяциями должны быть распределены по геному более равномерно.
Авторы отсеквенировали геномы 13 бактерий из популяции L и семи особей из популяции S. Сравнение геномов подтвердило первую версию: в недавней эволюции двух бактериальных популяций явно преобладал отбор на уровне отдельных генов. Следовательно, имел место интенсивный ГПГ между родственными микробами. Вот некоторые факты, на которых основан этот вывод.
Обнаружено 725 нуклеотидных позиций, в которых у микробов L всегда стоит какой-то один нуклеотид, а у микробов S – другой. Эти 725 позиций назвали «экоснипами» (ecoSNPs[42]), поскольку именно они, скорее всего, отвечают за приспособление к различающимся условиям. Экоснипы не рассеяны по геному хаотически, а сгруппированы в 11 кластеров. Внутри каждого кластера хотя бы у одной из двух популяций наблюдается пониженный уровень полиморфизма, что свидетельствует о недавнем действии положительного отбора.
Все прочие SNP (полиморфные нуклеотидные позиции), в числе 28 744 штук, равномерно рассеяны по геному и варьируют сходным образом и у L-экотипа, и у S-экотипа. Например, в какой-то позиции нуклеотид Ц может стоять у шести, а нуклеотид Г – у семи бактерий L, тогда как в популяции S нуклеотид Ц обнаружен у трех бактерий, а Г – у четырех.
Это соответствует предположению о том, что отбор в сочетании с ГПГ распространял отдельные участки ДНК с удачными мутациями, а не целые геномы. При этом в остальных участках генома сохранялся исходный полиморфизм, имевшийся у предковой популяции.
Другой важный вывод состоит в том, что генетический обмен между популяциями в последнее время происходит редко по сравнению с обменом внутри популяций. В прошлом, когда популяции еще не окончательно разошлись по экологическим нишам, межпопуляционный обмен происходил чаще.
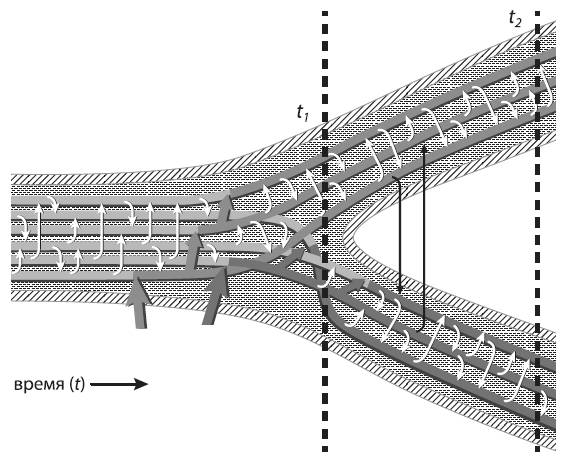
Модель экологической дифференциации двух популяций морской бактерии Vibrio cyclitrophicus. Тонкие белые и черные стрелки символизируют внутри– и межпопуляционный ГПГ. Толстые стрелки показывают появление (в результате мутации или ГПГ) адаптивных аллелей, облегчающих жизнь в двух разных местообитаниях. Из Shapiro et al., 2012.
Стало быть, пора пересмотреть некоторые устоявшиеся представления. Во-первых, выясняется, что на генетическом уровне эволюционные процессы у прокариот с их ГПГ и эукариот, размножающихся половым путем, различаются не так уж сильно. В обоих случаях отбор идет в основном на уровне отдельных фрагментов ДНК, а не целых геномов.
Во-вторых, стало ясно, что генетический обмен между родственными микробами (представителями одной и той же популяции) идет очень активно, фактически выполняя ту же функцию, что и половой процесс у высших организмов. При этом важнейшую роль играет гомологичная рекомбинация, благодаря которой заимствованные гены не добавляются к уже имеющимся, а заменяют собой свои «старые версии».
В-третьих, высокая частота внутрипопуляционного ГПГ по сравнению с межпопуляционным говорит о том, что у бактерий, приспосабливающихся к разным экологическим нишам, формируется частичная репродуктивная изоляция – совсем как у высших организмов в процессе симпатрического видообразования (см. главу 6). Эта изоляция основана не только на том, что микробы с разными адаптациями живут в разных местах и поэтому редко встречаются, но и на том, что по мере накопления нуклеотидных различий снижается вероятность гомологичной рекомбинации. По-видимому, прокариот все-таки нельзя считать «единым сверхполиморфным видом» (как предлагали некоторые теоретики, исходившие из предположения, что микробы обмениваются генами с кем попало независимо от степени родства). У прокариот, как и у высших организмов, могут существовать частично изолированные популяционные генофонды.
Что же касается случаев ГПГ между неродственными микробами, то они, по-видимому, представляют собой лишь вершину айсберга – легко обнаруживаемый и имеющий важные эволюционные последствия, но все-таки сравнительно редкий побочный эффект способности микробов заимствовать гены у своей ближайшей родни.
Получены и другие данные, указывающие на неожиданно высокие темпы внутривидового ГПГ и гомологичной рекомбинации у бактерий (Fell et al., 2000; Takuno et al., 2012; Yahara et al., 2012) и архей (Papke et al., 2004). Конечно, интенсивность генетического обмена у них все равно гораздо ниже той, что характерна для эукариот, практикующих амфимиксис. Главный вывод из этих работ состоит в том, что секс у прокариот играет, по-видимому, ту же роль, что и у эукариот. Он повышает адаптационные возможности организмов путем разрушения связей между полезными и вредными мутациями и позволяет отбору работать с отдельными генами, а не с целыми геномами. Более того, благодаря положительной корреляции между сходством последовательностей ДНК и вероятностью гомологичной рекомбинации (напомним, что это исходный, предковый механизм выбора брачного партнера) (Majewski et al., 2000; Dubnau, 1999; Thomas, Nielsen, 2005) у микробов формируются хорошо перемешанные видовые генофонды, к которым приложимы классические популяционно-генетические подходы (Jeltsch, 2003).
Даже родственные микробы, живущие в одних и тех же местообитаниях, могут подразделяться на популяции с полуизолированными генофондами, подобные «биологическим видам» эукариот. Это показано не только для морских бактерий Vibrio, но и для других микробов – например, для совместно встречающихся разновидностей архебактерий Ferroplasma[43] (Eppley et al., 2007).
От горизонтального переноса генов к половому размножению
Горизонтальный перенос генов был всегда. Как ни парадоксально, он мог появиться даже раньше самой жизни! На это указывают результаты исследований, проводимых в рамках теории РНК-мира (о ней рассказано в «Рождении сложности»).
Моментом зарождения жизни логично считать момент появления первого репликатора – сообщества молекул РНК, помогавших друг другу размножаться. Чем больше мы узнаем о свойствах рибозимов (молекул РНК, способных выполнять активную «работу» подобно белковым ферментам), тем яснее становится, что рибозимы – великие мастера по части разрезания, перекомбинирования и сшивания фрагментов РНК, т. е. по части рекомбинации. Репликация, или матричный синтез, – сборка комплементарных молекул РНК из отдельных нуклеотидов – дается им с гораздо большим трудом. Скорее всего, размножение первых репликаторов было основано не столько на матричном синтезе – репликации РНК, сколько на рекомбинации – сборке молекул, комплементарных матрице, из подходящих фрагментов – олигонуклеотидов (Vaidya et al., 2012).
Без постоянного обмена участками между рибозимами эволюция жизни, наверное, даже не смогла бы стартовать. Поэтому мы и сказали, что секс, возможно, появился раньше жизни! Но об этих увлекательных предметах можно написать еще одну книгу, поэтому сейчас мы только попробуем разобраться с происхождением «настоящего» полового размножения – эукариотического амфимиксиса.
Хотя параллели между ГПГ и амфимиксисом очевидны, эти явления обычно считают аналогичными, но не гомологичными. То есть сходными, но имеющими разное происхождение.
Однако есть основания предполагать, что половое размножение могло напрямую произойти от прокариотического ГПГ. Возможно, амфимиксис является закономерным итогом эволюции механизмов ГПГ. Попробуем обосновать эту гипотезу.
Прежде всего нужно выяснить, когда появился амфимиксис. Традиционно считалось, что первые эукариоты были бесполыми (апомиктическими) и размножались простым делением. Иными словами, постулировалось существование предковых апомиктических эукариот, которые затем постепенно приобрели амфимиксис, пройдя через те или иные промежуточные этапы (Margulis, Sagan, 1986; Kondrashov, 1994).
Среди современных одноклеточных эукариот есть группы (воротничковые жгутиконосцы – предки животных, обыкновенные амебы и другие), представители которых никогда не размножаются половым путем – только простым делением. Думали, что по крайней мере часть этих бесполых групп являются первично-бесполыми, т. е. не утратившими половое размножение, а никогда его не имевшими. Однако в геномах всех этих групп нашлись «генетические рудименты» – следы наличия амфимиксиса в прошлом (Schurko et al., 2009). Похоже, все современные эукариоты происходят от предков, практиковавших амфимиксис. Это позволяет предположить, что появление амфимиксиса предшествовало появлению эукариот или, может быть, оба события произошли одновременно.