Полная версия
Эволюция. Классические идеи в свете новых открытий
Нестандартные репликаторы: дарвиновская эволюция без участия генов
Земная жизнь основана на размножении репликаторов определенного типа – полинуклеотидов РНК и ДНК. Но это не единственный тип репликаторов, существующий в природе. Многие философы и социологи считают, что в культурной эволюции важную роль играют мемы – единицы культурной информации, которые используют наш разум для собственного выживания и размножения примерно так же, как гены используют клетку. Предполагается (хотя и не доказано), что мемы, как и гены, обладают всеми свойствами, необходимыми для дарвиновской эволюции: наследственной изменчивостью и дифференциальным размножением. Если объект обладает этими свойствами, то он является репликатором, и он будет автоматически эволюционировать, приспосабливаясь к среде своего обитания.
Прионы – нестандартные репликаторы, представляющие собой особым образом свернутые молекулы белка PrP (называемого также прионным белком). Этот белок в норме присутствует на мембранах нейронов и выполняет какие-то полезные функции, связанные с передачей сигналов. Какие именно – пока не совсем ясно (Chiesa, Harris, 2009). Безобидный прионный белок превращается в смертоносный прион в результате «неправильного сворачивания».
Прион обладает двумя удивительными свойствами. Во-первых, он заставляет нормальные прионные белки сворачиваться неправильно, превращая их в свои копии. Так прион размножается: он катализирует синтез собственных копий, используя в качестве «пищи» (материала для построения этих копий) нормальные, правильно свернутые молекулы белка PrP. Во-вторых, прион устойчив к действию протеолитических ферментов, задача которых состоит в уничтожении отслуживших белковых молекул. Оба свойства связаны со способностью прионов слипаться в большие комки из множества молекул. Первые несколько слипшихся прионов становятся «центром кристаллизации», к которому прилипают все новые и новые молекулы. В конце концов это приводит к нарушению работы нервной клетки.
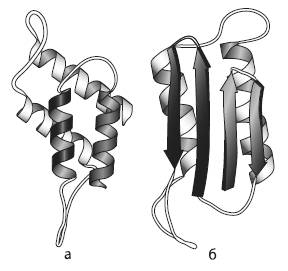
Два варианта пространственной конфигурации прионного белка: a – нормальная конфигурация (преобладают так называемые альфа-спирали); б – патологическая конфигурация (преобладают «бета-листы»). Стрелки – условные, они показывают направление от N-конца белковой молекулы (где находится аминогруппа) к C-концу (где находится карбоксильная группа).
Самое неприятное, что нейрон, в котором «завелись» прионы, заражает ими соседние нейроны. В результате прионная инфекция распространяется по нервной системе. Способность к размножению, устойчивость к протеолитическим ферментам и заразность делают прионы опасными инфекционными агентами, похожими по своим свойствам на вирусы. Как и вирусы, прионы могут размножаться только за счет ресурсов, предоставляемых хозяйской клеткой. Вирусу необходимо, чтобы клетка синтезировала для него вирусные белки согласно инструкциям, записанным в вирусной ДНК или РНК. Приону необходимо, чтобы клетка синтезировала для него нормальные молекулы прионного белка PrP, а прион уже сам превращает их в свои копии. Разница между вирусом и прионом существенна для молекулярного биолога, но совсем не так заметна для эпидемиолога или тем более заболевшего животного. Прионы вызывают смертельные нейродегенеративные заболевания у человека и других млекопитающих, в том числе коровье бешенство и куру.
То, что прионы умеют размножаться, сомнений не вызывает. Но до недавних пор было неясно, являются ли они полноценными репликаторами. Иными словами, есть ли у них весь необходимый «джентльменский набор» для дарвиновской эволюции. Способны ли прионы мутировать и передавать мутации по наследству, и если да, то влияют ли эти мутации на эффективность размножения прионов? Действует ли на прионы естественный отбор? Могут ли они приспосабливаться к изменениям среды, например к лекарствам, применяющимся для борьбы с прионными инфекциями? Эксперименты, проведенные американскими биологами, дали положительные ответы на эти вопросы (Li et al., 2010).
В нейронах одного и того же вида животных встречаются разные штаммы (разновидности) прионов. Например, у мышей из одной и той же лабораторной линии, имеющих одинаковые прионные белки PrP, может встречаться до 15 разных прионных инфекций, различающихся по скорости развития болезни и неврологическим симптомам. Было замечено, что если взять штамм прионов у одного вида животных, заразить им другой вид, а потом взять прионы у второго вида и снова заразить ими первый, то симптомы в некоторых случаях оказываются уже другими.
Это позволило предположить, что у белка PrP есть несколько разных вариантов неправильного сворачивания и превращения в прион. При этом каждый из вариантов наследуется, т. е. сохраняется в ряду «поколений» прионов. Возможно, прионы могут «мутировать» и передавать свои мутации по наследству. Мутации прионов, конечно, не связаны с изменениями аминокислотной последовательности белка, а представляют собой изменения его пространственной структуры (способа сворачивания).
Чтобы проверить эти предположения, ученые провели эксперименты с разными штаммами прионов и разными клеточными культурами. Выяснилось, что свойства прионов закономерным образом меняются, когда их пересаживают из одних клеток в другие, причем изменения происходят не сразу, а постепенно.
Для начала исследователи заразили клеточную культуру под условным названием PK1 прионами штамма 22L из мозга больной мыши. Оказалось, что чем дольше прионы живут и размножаются в клетках PK1, тем сильнее они отличаются по своим свойствам от исходных прионов из мозга мыши. Исходные прионы 22L успешно заражают другую клеточную культуру (R33) и нечувствительны к действию алкалоида сваинсонина, который замедляет размножение некоторых прионов в клетках. Однако по мере жизни прионов в клетках PK1 они постепенно утрачивают способность заражать клетки R33 и становятся все более чувствительными к сваинсонину.
Простейшее объяснение состоит в том, что популяция прионов в мозге больной мыши исходно была гетерогенной (разнородной), и в ней преобладали прионы, устойчивые к сваинсонину и заразные по отношению к R33. Однако жизнь в клетках PK1 приводит к тому, что в популяции растет доля прионов, чувствительных к сваинсонину и не способных заражать R33. Прионы с этими свойствами быстрее размножаются в клетках PK1, т. е. налицо вытеснение одних прионов другими под действием отбора[11].
Способны ли прионы восстанавливать утраченную устойчивость к лекарству? Чтобы выяснить это, ученые пересаживали прионы, чувствительные к сваинсонину, из клеток PK1 в мозг мышей. К тому времени, когда заболевание достигло терминальной стадии (через 147 дней после заражения), прионы полностью восстановили устойчивость к сваинсонину. Значит, они действительно эволюционируют!
Более того, оказалось, что если выращивать прионы, чувствительные к сваинсонину, в клеточной культуре в присутствии небольших концентраций этого алкалоида, то прионы быстро вырабатывают устойчивость к нему. Таким образом, эти необычные репликаторы приспосабливаются к меняющимся условиям совсем как вирусы или бактерии.
Выработка устойчивости в экспериментах могла происходить либо за счет преимущественного размножения устойчивых разновидностей прионов, которые уже существовали в исходной популяции (хоть и в малом количестве), либо за счет появления новых мутаций в ходе эксперимента. Дополнительные эксперименты показали, что прионы-мутанты, устойчивые к сваинсонину, возникают спонтанно. Это происходит даже в отсутствие сваинсонина, т. е. когда в такой мутации нет необходимости. Частота мутаций – примерно один случай на миллион клеточных делений. Напомним, что «мутация» приона не связана с изменением последовательности аминокислот – это просто другой способ сворачивания белковой молекулы. Мутация наследуется, потому что прион, свернутый определенным образом, заставляет «исходный материал» (прионный белок PrP) сворачиваться точно так же.
Итак, прионы мутируют, передают мутации по наследству, и эти мутации влияют на эффективность их размножения. У прионов есть все необходимое, чтобы эволюционировать под действием отбора.
Ключевой вопрос, ответа на который пока нет, состоит в том, как далеко может зайти такая эволюция. По идее, у прионов должно быть гораздо меньше эволюционных возможностей, чем у тех же вирусов, потому что число возможных пространственных конфигураций белка PrP вряд ли может сравниться с невообразимо громадным числом возможных последовательностей нуклеотидов в геноме вируса. Неясно, может ли отбор у прионов быть «накопительным» – может ли он создавать новые свойства путем последовательного закрепления множества изменений. Скорее, отбор у прионов все-таки «одноразовый», работающий с единичными мутациями, причем набор возможных мутаций невелик.
Практический вывод состоит в том, что при разработке лекарств от прионных болезней лучше не бороться с конкретными штаммами прионов – к таким лекарствам прионы могут приспособиться, – а пытаться повысить устойчивость нормального прионного белка, чтобы он всегда сворачивался правильно. Самым радикальным средством было бы полное отключение гена, кодирующего белок PrP. Правда, пока неясно, к каким побочным последствиям это приведет. Мыши с отключенным геном прионного белка выживают и даже не имеют каких-то особо тяжелых дефектов, но у них много мелких странностей: от нарушенного суточного ритма до склонности к ишемии и судорогам.
Белковая вселенная
Прионы – это, конечно, экзотика и редкость. Мы познакомились с ними, чтобы лучше разобраться в свойствах репликаторов. А еще для того, чтобы понять: не всякий репликатор способен обеспечить длительное и интересное эволюционное развитие.
Эволюция земной жизни основана в первую очередь на изменениях белков, инструкции по созданию которых записаны в белок-кодирующих участках ДНК. Сами по себе белки не являются репликаторами. Но они могут эволюционировать «по Дарвину», потому что их строение определяется информацией, записанной в молекулах ДНК – подлинных репликаторах, на эффективность размножения которых влияют свойства кодируемых ими белков. Фенотип[12] организма определяется в первую очередь белками. Поэтому если мы хотим оценить эволюционный потенциал земной жизни, то для начала необходимо выяснить, в каких пределах способны меняться – под действием мутаций и отбора – структура и функции белков.
В рассказе Борхеса «Вавилонская библиотека» описана невообразимо огромная библиотека, содержащая абсолютно все возможные тексты определенной длины. При этом в библиотеке нет двух одинаковых книг. Схожий образ громадного, но все же конечного пространства последовательностей используют биологи, изучающие эволюцию белков (Maynard Smith, 1970)[13]. Это воображаемое пространство включает все возможные «тексты», записанные 20-буквенным аминокислотным «алфавитом». Например, для белка длиной в 300 аминокислот существует 20300 возможных последовательностей. По сравнению с этим числом количество атомов во Вселенной (примерно 1080) пренебрежимо мало.
Каждая точка в пространстве последовательностей соответствует одному белку, а расстояние между точками отражает степень различий между двумя белками. Эволюцию белковой молекулы можно представить как движение в пространстве последовательностей.
Каждой функции, выполняемой белками, соответствует некая область в пространстве последовательностей, в пределах которой любая точка – это белок, способный справиться с данной функцией. До тех пор пока эволюция белка идет без смены функции, его движение ограничено этой областью.
Главный вопрос в том, насколько велики такие области и какова их структура. Теоретически они могут быть как сплошными полями, так и лабиринтами узких тропинок, разделенных «запретными зонами».
Полезным дополнением к образу пространства последовательностей является образ ландшафта приспособленности, введенный в употребление в 1932 году выдающимся американским генетиком Сьюэлом Райтом (1889–1988). Каждой точке пространства последовательностей соответствует та или иная величина приспособленности. Если речь идет об аминокислотной последовательности белка, то приспособленность можно понимать как эффективность выполнения белком своей функции. Если речь идет о нуклеотидной последовательности генома, то приспособленность – это эффективность размножения организма с таким геномом. Принято представлять области высокой приспособленности в виде возвышенностей, низкой – в виде долин или ям. При этом вышеупомянутые «поля» приобретают вид горных плато, «тропинки» становятся хребтами, а «запретные зоны» – долинами и пропастями.

Примерно так представляют себе биологи «ландшафт приспособленности». Два горизонтальных измерения символизируют «белковую вселенную», т. е. все возможные аминокислотные последовательности белка (или нуклеотидные последовательности ДНК, если речь идет о «генетической вселенной»). Вертикальное измерение отражает приспособленность. Эволюционируя путем накопления нейтральных или полезных аминокислотных замен, белок может двигаться по этому ландшафту горизонтально или вверх. Спуск в долины запрещен, потому что мутации, снижающие эффективность работы белка, отсеиваются отбором. В результате белок может оказаться в «ловушке локального максимума», т. е. застрять на одной из второстепенных вершин. Однако реальные ландшафты приспособленности, по-видимому, представляют собой не множество одиноких пиков, а лабиринты горных хребтов. Двигаясь по гребням, белок может обходить пропасти, но на это уходит много времени. Именно поэтому некоторые белки, унаследованные современными организмами от последнего общего предка всего живого, до сих пор так и не достигли предельного уровня несхожести и продолжают медленно расходиться в пространстве «белковой вселенной».
Вредные мутации – это движение вниз по склону, полезные – путь наверх. Мутации нейтральные, не влияющие на приспособленность, соответствуют движению вдоль горизонталей – линий одинаковой высоты. Отбраковывая вредные мутации, естественный отбор мешает эволюционирующей последовательности двигаться вниз по ландшафту приспособленности. Поддерживая мутации полезные, отбор пытается загнать последовательность как можно выше[14].
Отбор – игра по правилам
Методом случайного поиска (случайных блужданий) найти в необозримой «белковой вселенной» одну конкретную точку, соответствующую оптимальному выполнению белком данной функции, совершенно нереально. К счастью, такие оптимумы, как правило, – не точки, а обширные области. А главное, поиск оптимума в ходе эволюции осуществляется вовсе не методом случайных блужданий. Он идет методом направленного отбора. Направленность возникает благодаря тому, что случайные отклонения в «неправильную» сторону, ухудшающие рабочие качества белка, отбраковываются, отменяются и забываются, тогда как случайные отклонения в «правильную» сторону запоминаются и сохраняются.
Если исходная последовательность уже находится у подножия некоей возвышенности на ландшафте приспособленности – там, где уже есть хотя бы небольшой наклон (это значит, что белок хотя бы в минимальной степени, но уже выполняет какую-то функцию), отбор загоняет последовательность на вершину горы с поразительной эффективностью. Это можно показать с помощью компьютерной программы, впервые описанной Ричардом Докинзом в книге «Слепой часовщик». Пусть в роли исходной последовательности выступает произвольный набор букв, например, такой:
weiusdhsdklj dfg dfgghkjhjh qnlsvtnxuvsf qw kjhgj jfdjkfflmc
Программа размножит эту последовательность в тысяче экземпляров, внося в нее случайные мутации с заданной частотой. Например, пусть каждая буква в каждой копии с вероятностью 0,05 мутирует, т. е. заменяется другой случайной буквой. В результате каждая двадцатая (в среднем!) буква у каждого потомка будет отличаться от родительской. Зададим оптимум, к которому нужно стремиться, – некую осмысленную фразу. Попробуем сначала прийти к оптимуму без помощи отбора, методом случайных блужданий. Для этого из 1000 потомков выберем одного наугад и снова размножим в 1000 экземпляров с мутациями. И еще раз, и еще.
Вот что у нас получилось. Справа указаны номер поколения и степень отличия от целевой последовательности, т. е. удаленность от оптимума:
weiusdhsdklj efg dfgghkjhjh qnlsvtnxuvsfuqt kjhgj jfdjkfflmc 1 1101
weiusdhshklj efg dfgghkchjh qnlsvtxxuvmfuqt kjhgj jfdjkfflmc 2 1102
weiusdhshqxj efg dfgghkchjh qnudvtxxuvnfuqt kjhgj jfdjkfflmc 3 1073
weiusdhshqxj efg dfgghkchjh pnudvnxxuvnfuqt kjhgj jfdjkfflmc 4 1068
weiuydhshqxjmefg dfgghgchjh pnudvnxxuvnfuqt kjhgj jfdjkfflmc 5 995
…
miokytvohujkuefhjefghhgcajtrjnfdqnxxutdzuftfihfgz ufdjkfszyc 21 1179
miokytvohuwtuefhjefghhgcajyrjnfdqnxxutdzuftfiufgz ufdjkfszyc 22 1173
…
jzvsztfxtuggublusgidhpgxauyranrwqbwsjtdoxykfinfzvyufdoluszyh 51 1152
jzvsztfxtuggublusgidhpgxauyranrwqjwsjtdoxykfinfzvyufdoluszyh 52 1144
…
pkvlrqsxoqrewqoidyofypjlsjvwcjxdjlkhbzdyonhdeyuydlusjzbmeeiu 99 1078
pkvlrqsxoqoewqoidyofysjlsjvwcjxdjlkhbzdyonhdeyuydlusjubmeeiu 100 1073
Бесполезно! За 100 поколений – ни малейшего прогресса, никакого приближения к оптимуму. Фраза осталась такой же бессмысленной, какой и была. Случайное блуждание в пространстве последовательностей, которое мы сейчас смоделировали, практически не дает шанса найти конкретную точку в белковой вселенной.
Нет, конечно, будь у нас бесконечный запас времени, когда-нибудь мы все же наткнулись бы на оптимум. Когда, вот в чем вопрос. Мы использовали 26 букв латинского алфавита и пробел, итого 27 знаков. Длина фразы – 60 знаков. Оптимум – это одна комбинация из 2760 (~7,6×1085) возможных. Вариантов больше, чем атомов во Вселенной. Примерно столько поколений нам и потребуется, чтобы случайно наткнуться на нужную точку.
К такому способу поиска вполне приложимы известные рассуждения об урагане, пролетевшем над свалкой, который ни за что не соберет из мусора «боинг-747», и об обезьяне, которая, бессмысленно стуча по клавиатуре, никогда не напишет «Войну и мир». Таким способом – и впрямь не напишет. К счастью для нас, эволюция идет вовсе не этим способом. Или, если быть совсем уж точными, не только этим способом.
Мы все-таки не зря моделировали случайные блуждания – у них тоже есть аналог среди эволюционных процессов. Именно так идет нейтральная эволюция. Так меняются последовательности (аминокислотные или нуклеотидные), от которых приспособленность организма не зависит и которые поэтому не находятся под действием отбора.
Между прочим, хоть блуждания и случайные, некие закономерности можно заметить и в этом случае. Обратите внимание, что эволюционирующая последовательность постепенно становилась все менее похожа на исходную. Фраза из поколения № 1 отличается от исходной только тремя знаками, в поколении № 2 мы видим уже семь отличий, в поколении № 4–13, в пятом поколении – 16 отличий. К 50-му поколению никакого сходства с исходной последовательностью не осталось. Но в течение первых 20–25 поколений сходство сохранялось, постоянно уменьшаясь. Поэтому мы могли по степени этого сходства примерно определить номер поколения, к которому принадлежит данная фраза. Мы могли, сравнив данную фразу с исходной и зная скорость мутирования, примерно оценить, сколько поколений разделяет эти две фразы! На этом принципе основан замечательный метод молекулярных часов, с которым мы познакомимся в следующем разделе. А пока вернемся к отбору.
Изменим немного нашу программу. Пусть теперь для размножения выбирается не любая из 1000 последовательностей наугад, а лучшая – наиболее похожая на «оптимальную». Все прочее оставим как было. Запускаем программу и получаем следующее:
wbiusdhsdkljvdfgfdbgghkjhjh qnlsvtnxuvsf qw kjhgjajfdjkfflmc 1 992
jfiusdhsd ljvqfgfdbggbkjhjh qnlsvtnxuvsfyqw kjhgjajfdjkfflmc 2 844
jfiusdhsd ljvqfgfdbggnkjhjh qnl vtnxuvsfyqw djhgjajfdjkfflmc 3 756
jfiusdhsd ljvqqgfdbggnkjhjh qnj vtnx vsfyqw djhgjajfdjkfflmc 4 684
jfiusdhsd ljrr gfdbggnkjhme qnj vtnx vsfyqw djhgjajfdjkfflmc 5 594
…
tdkfdrhsm vjlr nfdbgmu jhoe anw crbm hs ygj vqptjam vjjzbpnc 21 113
tdkfdrhsm vjlr nfdbgku jhoe anw crbm hs ygj vqpteam vjjvbprc 22 104
…
tekfdrhom vjll rfaeiky jhoe any fobm hm tgd oqptehm vmjvepse 41 37
tekfdriom vjll rfaeiky fhoe any fobm hm tgd oqptehm vmjvepse 42 32
…
tekectiom will readily fime any gobl hn thd oroteim universe 61 10
tekectiom will readily fime any gobl in thd oroteim universe 62 9
…
selection will readily fime any goal in the orotein universe 73 3
selection will readily fimd any goal in the orotein universe 74 2
…
selection will readily fimd any goal in the protein universe 87 1
selection will readily fimd any goal in the protein universe 88 1
selection will readily find any goal in the protein universe 89 0
selection will readily find any goal in the protein universe 90 0
Ну вот, совсем другое дело! Под действием отбора наша последовательность уверенно двигалась к оптимуму – взбиралась на пик ландшафта приспособленности – и достигла его в 89-м поколении, с чем мы ее и поздравляем.
Главный урок из этих упражнений состоит в том, что эволюция под действием отбора совсем не похожа на попытки напечатать «Войну и мир», случайным образом нажимая на клавиши. Отбор – мощная организующая сила, которая придает эволюции направленность, формируя из хаоса случайных мутаций закономерный, упорядоченный результат.
Но позвольте, не отступили ли мы от реальности, произвольно задав оптимальную последовательность – фразу, к которой нужно было стремиться? Не похоже ли это на «божественное вмешательство»?
Вовсе нет. Для любой полезной функции, выполняемой белком при данных условиях (температуре, составе среды и т. д.) действительно существует одна или несколько оптимальных аминокислотных последовательностей, которые справятся с этой функцией лучше всего. Возможно, реального белка с такой последовательностью еще нет в природе – эволюция не успела его создать, – но ведь идеальная последовательность все равно существует, подобно тому как потенциально существовал химический элемент углерод со всеми своими свойствами еще до того, как первые атомы углерода начали синтезироваться в недрах звезд, вспыхнувших в молодой Вселенной. Отбор будет двигать эволюционирующую последовательность к этому идеалу независимо от того, есть уже на свете такие белки или им еще только предстоит появиться.
В чем мы действительно погрешили против истины, так это в том, что в неявном виде ввели в модель несколько допущений о форме ландшафта приспособленности, сильно упрощающих реальность. Мы допустили, что ландшафт – это одна большая гора с гладкими склонами и единственной вершиной, причем любая случайная последовательность, с которой начинается эволюция, уже находится на склоне этой горы, так что движение «вверх» (к идеалу) повышает ее приспособленность. Нахождение на склоне означает, что исходная последовательность хоть чуть-чуть, хоть совсем плохо, но все-таки уже справляется с данной функцией.
Рассмотренная модель справедлива лишь для ситуации, когда отбору уже есть за что «зацепиться», когда эволюционирующая последовательность уже на что-то годна.
Как удается эволюционирущим последовательностям переходить с одной горы на другую и со склона на склон? Иными словами, как белок, уже приспособившийся выполнять какую-то функцию – начавший взбираться по склону одной из гор, – может приобрести другую функцию, т. е. перейти на другую гору? Как он преодолеет разделяющую их низменность?
Это важный вопрос, и мы к нему еще вернемся. Ну а пока ограничимся несколькими замечаниями.
Во-первых, действительно, чем выше белок забрался по одному склону, тем меньше у него шансов перейти на другой. Глубокие низины между горными массивами, соответствующими основным группам белковых функций – так называемым надсемействам белков, – как правило, непроходимы. Крайне редко удается преодолеть пропасть одним отчаянным прыжком – макромутацией. В подавляющем большинстве случаев такие прыжки в горной местности кончаются понятно чем. Но все же бывают и удачные приземления. И тогда всем на диво какой-нибудь фермент, миллиарды лет занимавшийся превращением одного углевода в другой, вдруг превращается в кристаллин – белок хрусталика глаза, а пищеварительный фермент трипсин – в белок-антифриз, защищающий кровь антарктических рыб от замерзания[15].