Полная версия
От атомов к древу: Введение в современную науку о жизни
Водородные связи важны не только с точки зрения свойств воды. Они много где встречаются. Например, в главе 9 мы увидим, что без водородных связей невозможно представить себе структуру молекулы ДНК, от которой зависит хранение наследственной информации.
Любовь и ненависть воды
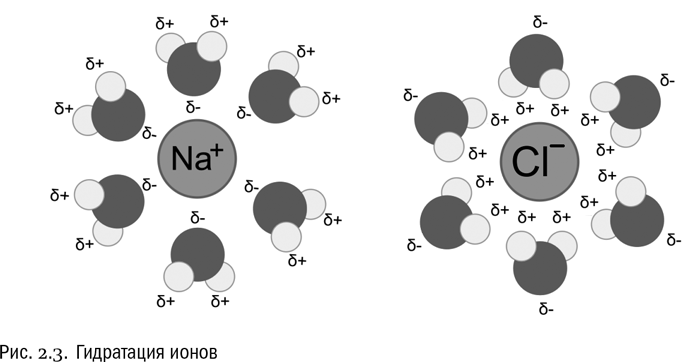
Любое вещество, растворенное в воде, так или иначе взаимодействует с ней, и способ этого взаимодействия зависит, прежде всего, от электрических свойств молекул. Например, если растворить в воде поваренную соль (NaCl), она распадется на положительно заряженные ионы натрия (Na+) и отрицательно заряженные ионы хлора (Cl–). При этом к ионам натрия молекулы воды “прилипнут” своими атомами кислорода (несущими маленький отрицательный заряд δ–), а к ионам хлора – атомами водорода (несущими маленький положительный заряд δ+). В результате и те и другие ионы получат оболочку, состоящую из молекул воды (см. рис. 2.3). Образование таких оболочек называется гидратацией. Ионы натрия и хлора находятся в воде в гидратированном состоянии. Гидратация – процесс, сопутствующий растворению в воде любого вещества (если оно вообще в ней растворимо, конечно).
Молекулы, в которых много ковалентных полярных связей, тоже прекрасно взаимодействуют с водой – в первую очередь потому, что образуют с ней водородные связи, “цепляясь” за молекулы воды своими частичными зарядами. Такие вещества хорошо растворяются в воде и называются гидрофильными (“любящими воду”). К гидрофильным веществам относятся, например, спирты и углеводы (см. главу 1). Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте – основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева{18}. Правда, рецепта водки Менделеев, вопреки распространенной легенде, не разрабатывал. Его интересовало происходящее при растворении взаимодействие молекул спирта и воды – тот самый процесс, который мы только что назвали гидратацией. Менделеев убедительно показал, что растворение – это не физическое явление (простое смешивание), а химическое (включающее образование новых межмолекулярных связей). Тогда получается, что раствор – это, по сути, новое вещество.
Как правило, любое наугад взятое органическое соединение будет растворяться в воде тем лучше, чем больше в нем атомов кислорода. Это понятно: именно вокруг атомов кислорода обычно образуются водородные связи. Например, молекула глюкозы (C6H12O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Молекулы, в которых все связи неполярные, взаимодействуют с водой гораздо слабее, чем друг с другом{19}. Вещества, состоящие из таких молекул, плохо растворяются в воде и называются гидрофобными (“боящимися воды”). Типичные гидрофобные соединения – углеводороды. Как мы знаем, они по определению состоят только из углерода и водорода, связи между которыми неполярны. Если бросить в воду парафин (смесь твердых углеводородов, из которой делают свечи), он и не подумает там растворяться – ни при каких условиях. А если налить в воду бензин (смесь жидких углеводородов, которая служит моторным топливом), то он, скорее всего, отслоится от нее, образовав четкую поверхность раздела. Вода как бы “выталкивает” эти вещества.
Если в формуле органического соединения есть кислород, то оно, скорее всего, гидрофильное, разве что там присутствует какая-нибудь совсем уж огромная углеводородная цепочка. Гидрофильными бывают и некоторые бескислородные органические вещества – например, амины.
В биохимии значение различий между гидрофильными и гидрофобными веществами без преувеличения грандиозно (см. главы 3, 5, 6). Многие детали устройства клеток без учета этих различий просто невозможно понять. А все потому, что земная жизнь – водная.
Талассогены
А могут ли подойти для жизни какие-нибудь другие растворители, кроме воды? Ответ – да. Например, углекислота (ее формула O=C=O, или просто CO2) знакома людям, прежде всего, в виде углекислого газа, который мы выдыхаем. Но она может и замерзать, образуя так называемый сухой лед. Проблема в том, что при нагревании в условиях, характерных для Земли, сухой лед сразу испаряется в газ, минуя жидкую фазу. Потому мы и не видим в быту жидкой углекислоты. Однако при более высоких давлениях, чем наше атмосферное, углекислота может становиться жидкостью. И тогда она представляет собой хороший гидрофильный растворитель, аналогичный по свойствам воде (и легко смешивающийся с ней), в котором успешно идут многие биохимические реакции. В этом растворителе могут жить даже земные микробы: например, на дне Окинавского желоба в Восточно-Китайском море исследователи-океанологи нашли целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии{20}.
Некоторые исследователи считают, что океаны жидкой углекислоты могут существовать на так называемых “суперземлях” – планетах с массой, в несколько раз превосходящей массу Земли{21}. Суперземли – довольно многочисленная категория экзопланет, и возможность жизни на них сейчас активно обсуждается.
Другой перспективный кандидат на роль вмещающей среды для жизни – аммиак (NH3). Это гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом (их разница в электроотрицательности для этого вполне достаточна, см. рис. 2.2Г). Неудивительно, что по своим физико-химическим свойствам аммиак напоминает воду. На более холодных планетах, чем Земля, он находится в жидком состоянии и вполне может быть основой жизни. Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать. Просто так уж сложилось, что на нашей планете из всех растворителей преобладает вода – ну а от добра добра не ищут, и земной жизни осталось лишь развиваться в этих относительно благоприятных условиях.
Еще один гидрофильный растворитель, в котором теоретически допускают возможность жизни, – метиловый спирт, или метанол (CH3OH). Для человека это страшный яд, но тут все зависит от настройки биохимических систем: вообще-то никакие законы природы не мешают “сконструировать” живой организм, для которого метанол будет совершенно безобиден, а то и полезен. Метанол – одно из самых простых органических веществ, и неудивительно, что образуется он очень легко. Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни{22}. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Земля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Наконец, еще один кандидат на роль подходящего для жизни гидрофильного растворителя – сероводород, соединение водорода и серы с формулой H2S (она же H – S–H). Молекула сероводорода очень похожа на молекулу воды. Правда, водородные связи она образует несколько хуже. В Солнечной системе сероводорода много на Ио – спутнике Юпитера, который отличается невероятной геологической активностью. Поверхность Ио покрыта вулканами, выбрасывающими фонтаны лавы, а состоит эта лава в основном из разнообразных соединений серы, которые текут и застывают, ибо в системе Юпитера очень холодно. Ио – это настоящий “мир льда и пламени”{23}. Если бы на Ио была жизнь, она вполне могла бы быть основана на сероводороде, точно так же, как земная жизнь – на воде.
А может ли среда для жизни оказаться не гидрофильной, а гидрофобной? Исключить такое в принципе нельзя. Например, на крупнейшем спутнике Сатурна – Титане – есть углеводородные озера и даже моря, состоящие из метана (CH4), этана (C2H6) и пропана (C3H8). Это настоящий гидрофобный растворитель, в котором некоторые ученые допускают существование жизни, хотя прямых подтверждений этому пока что нет. Жидкой воды на поверхности Титана не бывает, там слишком холодно.
В целом, однако, сейчас кажется более вероятным, что главный растворитель для внеземной жизни окажется гидрофильным (но не обязательно водой). Во-первых, гидрофильных растворителей в природе просто больше. А во-вторых, все известные биохимические механизмы слишком уж сильно “заточены” под гидрофильную среду. Биохимию на гидрофобной основе вообразить гораздо труднее.
Из совсем уж экзотических альтернатив воде можно назвать, к примеру, фтороводород (HF, “аш-фтор”). Водный раствор фтороводорода – очень агрессивное вещество, которое называется плавиковой кислотой (в сериале “Во все тяжкие”, главный герой которого – химик, ставший преступником, этой кислотой растворяют трупы). Однако многие органические молекулы, например углеводороды, в ней совершенно стабильны. К тому же фтороводород прекрасно образует водородные связи, а это, как мы уже знаем, очень важное для растворителя свойство. Возможность фтороводородной жизни допускали некоторые ученые, например астроном Карл Саган. А в фантастической повести Ивана Ефремова “Сердце Змеи” описана планета с фтороводородным океаном и дышащими фтором разумными жителями, с которыми земляне вступают в контакт. “Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…”
Великий популяризатор науки Айзек Азимов – кстати говоря, биохимик по научной специальности – не раз задумывался над тем, из каких веществ могли бы образоваться океаны на других планетах. Он назвал такие вещества термином “талассогены”, что буквально значит “производящие море”. По определению Азимова, талассоген – это вещество, способное сформировать планетарный океан. В замечательной книге “Асимметрия жизни”{24} Азимов подробно разбирает проблему океанов, приходя к выводу, что самые вероятные талассогены – это вода, аммиак и метан. При этом для планет, расположенных примерно на таком расстоянии от звезд, как Земля, вода имеет преимущество, потому что она остается жидкой при более высокой температуре. “Вы можете представить метановые океаны на такой планете, как Нептун, или аммиачные океаны на планете типа Юпитера, однако вода, и только вода может создать океан на внутренней планете вроде Земли”. Это выглядит логичным, но тут есть по меньшей мере один важный нюанс. Азимов писал эту книгу больше 40 лет назад, когда о планетах других звездных систем не было известно совершенно ничего. Не было даже уверенности, что они вообще существуют. А сейчас астрономам известны тысячи экзопланет, и уже ясно, что, мягко говоря, далеко не все звездные системы похожи на Солнечную. Сочетания условий там могут быть совершенно другими. Поэтому от расширения списка возможных вариантов вреда, скорее всего, не будет.
Возвращаясь к земной (а вернее, водной) биохимии, будем иметь в виду, что она – не единственная теоретически возможная. Изучая природу, всегда полезно помнить любимую мысль Станислава Лема: “Среди звезд нас ждет Неизвестное”.
3. Белки
– А вот товарищ Амперян говорит, что без белка жить нельзя, – сказал Витька, заставляя струю табачного дыма сворачиваться в смерч и ходить по комнате, огибая предметы.
– Я говорю, что жизнь – это белок, – возразил Эдик.
– Не ощущаю разницы, – сказал Витька. – Ты говоришь, что если нет белка, то нет и жизни.
АРКАДИЙ И БОРИС СТРУГАЦКИЕ.ПОНЕДЕЛЬНИК НАЧИНАЕТСЯ В СУББОТУВ разговорах о современной биологии слово “белок” звучит очень часто. Все знают, что белки – важнейшие питательные вещества. Но одновременно это еще и сложные биохимические машины, выполняющие в организме множество самых разных функций: дыхание, пищеварение, считывание наследственной информации, сокращение мышц, защита, восприятие света, передача сигналов… проще сказать, чего белки не делают. Что же это, в конце концов, такое?
Начнем с того, что белки, или протеины, – это огромные молекулы, входящие в состав абсолютно всех современных живых организмов. История их названия, честно говоря, довольно запутанна. Сам термин “белок” (albumin) вошел в употребление еще в XVIII веке, и относился он тогда к веществам, подобным всем известному белку куриного яйца. Что касается термина “протеин” (protein), то его придумал знаменитый шведский химик Йёнс Якоб Берцелиус. Кроме этого, Берцелиус открыл несколько новых химических элементов, установил формулы ряда органических кислот, разобрался в явлении электролиза и сделал еще много другого. В частности, именно Берцелиус открыл явление изомерии и ввел само понятие “изомеры”, уже нам знакомое (см. главу 1). Да и термин “органическая химия” тоже принадлежит ему.
Так вот, в 1838 году Берцелиус предложил назвать некоторые органические вещества “протеинами”{25}. Слово это произведено от греческого πρώτειος, “первичный”. Придумывая свой термин, Берцелиус предполагал, что “протеины” – это некие первичные строительные блоки живых организмов, и был, как мы сейчас знаем, совершенно прав.
В русском языке “белок” и “протеин” – строгие синонимы. По буквальному смыслу “протеин”, конечно, точнее, чем “белок”. Но как-то уж так сложилось, что в нашей научной литературе слово “белок” употребляется гораздо чаще, и мы будем этому следовать. Скорее всего, дело тут просто в том, что слово “белок” проще для восприятия и привычнее на слух.
Полимеры
В состав белков входят углерод, водород, кислород, азот и, как правило, еще сера. Ничего особенного в таком химическом составе нет. Гораздо удивительнее другое. Еще в XIX веке химики обнаружили, что молекулы белков буквально гигантские. По размеру, то есть по количеству атомов, они в сотни раз превосходят молекулы большинства других органических веществ. Дело в том, что белки относятся к полимерам – молекулам, состоящим из множества однотипных (но не обязательно совершенно одинаковых) повторяющихся звеньев, ковалентными связями соединенных друг с другом (см. рис. 3.1А). Такие звенья называются мономерами. Полимеры могут распадаться на отдельные мономеры, а могут и собираться из них вновь. Эти процессы играют огромную роль в биологическом обмене веществ, в ходе которого то и дело одни полимеры расщепляются, а другие строятся из мономеров заново. Иногда полимеры называют макромолекулами, то есть попросту “большими молекулами”.
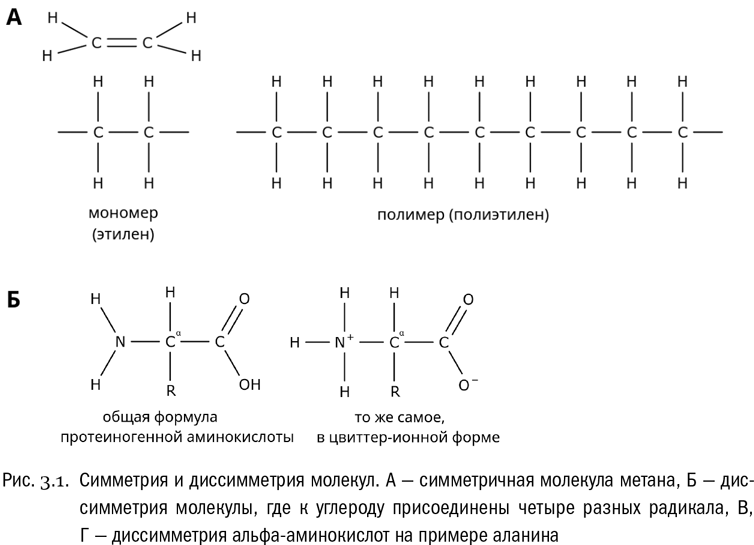
Очень простой пример полимера – полиэтилен, тот самый, из которого делают упаковочную пленку, пакеты, изоленту и тому подобные вещи. Это обычный углеводород, имеющий, однако, очень длинные молекулы (гораздо более длинные, чем все, что мы видели до сих пор). Формула полиэтилена следующая: CH3–CH2–CH2–CH2–CH2–CH2–CH2–CH2–CH2–CH2–CH2–CH2–… За многоточием тут может скрываться цепочка из нескольких тысяч атомов углерода (разумеется, с присоединенными к ним атомами водорода, которые всегда заполняют все валентности, не заполненные другими атомами). Повторяющимся звеном в полиэтилене является группа – CH2–CH2– (с двумя атомами углерода, а не с одним, потому что при получении полиэтилена он “сшивается” именно из двухуглеродных молекул). Это и есть его мономер.
И в живой, и в неживой природе есть много всевозможных полимеров, состоящих из самых разных типов мономерных звеньев. И как правило, эти звенья гораздо сложнее, чем в полиэтилене. Например, во многих биологических полимерах мономерами являются сахара (см. главу 6). В белках же мономеры особые, свойственные только им. Это – аминокислоты.
Альфа, бета, гамма…
Аминокислота, как мы знаем, – это вещество, в молекуле которого одновременно есть карбоксильная группа и аминогруппа (см. главу 1). Особенность аминокислот, входящих в состав белков, в том, что эти две группы обязательно присоединены к одному и тому же атому углерода. Такие аминокислоты называются альфа-аминокислотами (см. рис. 3.1Б). Если в какой-нибудь аминокислоте карбоксильная группа и аминогруппа связаны с разными атомами углерода, то это не альфа-аминокислота и в состав белков она входить не может.
Почему альфа-аминокислоты называются “альфа” и при чем тут вообще греческие буквы? Дело вот в чем. Атомы углерода, образующие аминокислоту, принято обозначать греческими буквами по порядку, считая от карбоксильной группы (сама она в счет не идет). Таким образом, первый атом углерода после карбоксила – это альфа-атом, второй – бета-атом, третий – гамма-атом и т. д. И в зависимости от того, к какому атому углерода у них присоединена аминогруппа, аминокислоты делятся на альфа-аминокислоты, бета-аминокислоты и прочие.
Например, представим себе аминокислоту с формулой NH2–CH2–CH2–CH2–COOH (см. далее рис. 3.8). Аминогруппа тут присоединена к третьему атому углерода, считая от карбоксильной группы, то есть к гамма-атому. Значит, это гамма-аминокислота. В данном случае она называется гамма-аминомасляной кислотой (ГАМК). Эта аминокислота есть в организмах большинства животных. Во-первых, она является промежуточным продуктом обмена веществ, а во-вторых, служит нейротрансмиттером, то есть веществом, передающим сигнал между нервными клетками. Именно с нарушением ГАМК-эргической (то есть обусловленной ГАМК) передачи нервных импульсов связано действие одного из самых сильных растительных ядов – яда цикуты, которым в свое время отравили Сократа. Но вот в состав белков ГАМК, в отличие от альфа-аминокислот, никогда не входит.
Пептидная связь
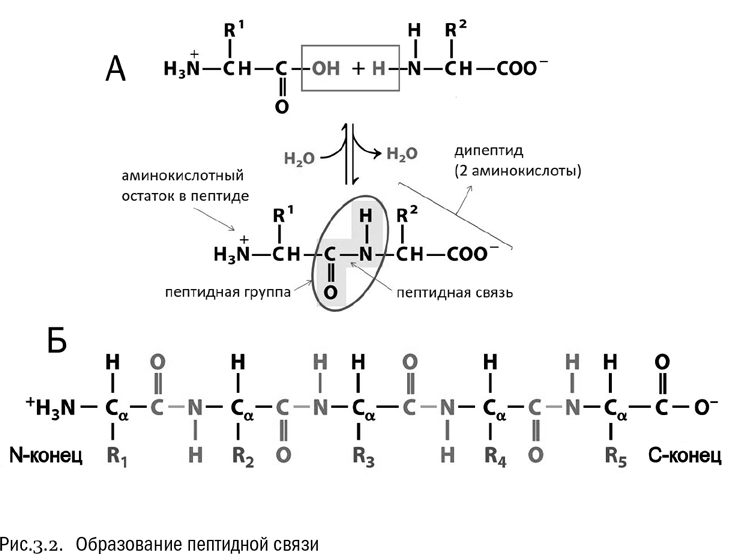
Как альфа-аминокислоты объединяются в белок? Очень просто: карбоксильная группа одной аминокислоты связывается с аминогруппой другой (см. рис. 3.2А). От карбоксильной группы отщепляется гидроксил (–OH), а от аминогруппы – водород (–H). Эти отщепленные фрагменты тут же соединяются и дают воду (H – O–H), а остатки карбоксильной группы и аминогруппы замыкаются по освободившимся валентностям друг на друга, образуя новую группу – CO – NH–. Вот через нее-то две аминокислоты и соединяются между собой.
Группа – CO – NH– называется пептидной группой, а связь между углеродом и азотом в ней – пептидной связью. Цепочка аминокислот, соединенных пептидными связями, называется пептидом (см. рис. 3.2Б). Это более широкое понятие, чем белок. Все белки – пептиды, но не все пептиды – белки.
Реакция образования пептида в принципе обратима: он может как синтезироваться, так и распадаться обратно на отдельные аминокислоты. На одном конце пептида находится свободная аминогруппа, на другом – свободная карбоксильная группа. Для краткости конец пептида со свободной аминогруппой принято называть N-концом, а конец со свободной карбоксильной группой – C-концом.
Короткие пептиды называют или по числу аминокислотных остатков (два остатка – дипептид, три – трипептид, четыре – тетрапептид…), или собирательно – олигопептидами. Длинные пептиды с многими десятками аминокислотных остатков называют полипептидами. Все белки – полипептиды. Аминокислотных остатков в них обычно даже не десятки, а сотни. “Средний” белок, типичный для живой природы, включает примерно 300–350 аминокислот. Белок из 200 аминокислот считается небольшим. Неудивительно, что белковые молекулы поразили когда-то химиков своими размерами.
Разнообразие и единство
В состав белков входит 20 стандартных аминокислот, одних и тех же у всех живых организмов. Как мы уже знаем, все они – альфа-аминокислоты, а это значит, что их общую формулу можно записать вот как: R – CH(NH2) – COOH. Буква R тут, как всегда, обозначает радикал, то есть изменяемую часть молекулы.
Аминокислоты, образующие белки, называют протеиногенными, от уже знакомого нам слова “протеин”. Две самые простые протеиногенные аминокислоты – глицин (где радикал – атом водорода) и аланин (где радикалом служит метильная группа – CH3). У других аминокислот радикалы сложнее. Для читателей-эрудитов добавим, что все нестандартные аминокислоты (селеноцистеин, пирролизин, гидроксилизин, гидроксипролин) так или иначе являются производными стандартных и нас пока не интересуют. А стандартных – ровно 20.
Свойства любого пептида зависят не только от того, какие аминокислоты в него входят, но и от того, в каком порядке они там расположены. Например, представим себе дипептид, состоящий из глицина и аланина. Как он будет выглядеть? Если в создании пептидной связи примут участие карбоксильная группа глицина и аминогруппа аланина, дипептид будет таким: NH2–CH2–CO – NH – CH(CH3) – COOH. Но возможен и другой случай, когда пептидную связь образуют, наоборот, карбоксильная группа аланина и аминогруппа глицина. Тогда пептид получится вот таким: NH2–CH(CH3) – CO – NH – CH2–COOH. Как видим, это два разных соединения. В белках, состоящих из сотен аминокислот, порядок расположения этих аминокислот не менее важен – только вот возможных вариантов там намного больше.
Глядя на формулы, легко убедиться, что два наших дипептида – не что иное, как изомеры (см. главу 1). То же относится к любым пептидам, отличающимся друг от друга порядком расположения одних и тех же аминокислотных остатков. И число таких изомеров в случае с длинными пептидами может быть огромным. Например, можно вычислить, что для декапептида, состоящего из 10 разных аминокислот, число возможных изомеров равно 3 628 800. А ведь декапептид – это даже не белок. Для любого крупного белка число изомеров будет в буквальном смысле астрономическим. Вот почему разных белков так много.
Порядок расположения аминокислот крайне важен для того, чтобы белок правильно выполнял свою функцию. Он должен быть таким же точным, как порядок букв в напечатанной фразе. Единственная замена или перестановка вполне может сделать белок совершенно “бессмысленным”, то есть бесполезным для организма. Между тем никакими чисто химическими средствами такую точность синтеза белка обеспечить невозможно. Первым, кто над этим всерьез задумался, был выдающийся русский биолог Николай Константинович Кольцов. “Молекула октокайдекапептида, состоящая из 18 аминокислот, может иметь около триллиона изомеров, а изомеры сложных белковых молекул должны исчисляться центильонами (число из 600 цифр). Представляется совершенно невероятным, чтобы синтез определенного изомера белков определялся исключительно внешними условиями реакции”, – писал Кольцов еще в 1927 году{26}. Из этого следовал важнейший вывод: информация, задающая порядок аминокислот в белке, непременно должна храниться где-то в организме. Она должна копироваться, передаваясь из поколения в поколение, и считываться по первому запросу, когда тот или иной белок понадобится создать. Все это, как мы сейчас понимаем, совершенно верно. О том, как в действительности работают эти механизмы, мы узнаем из главы 9.
В отличие от некоторых других полимеров, белки никогда не ветвятся. Любой белок – это строго линейная цепочка аминокислот. Сами аминокислоты, входящие в состав белка, принято обозначать буквами: например, глицин обозначается буквой G, аланин – буквой A и т. д. Поэтому формулу любого белка можно записать в виде простой последовательности букв, соответствующих аминокислотам. На самом деле так обычно и делают.
“Кирпичики”, из которых состоит жизнь
Итак, мы видим, что аминокислоты, входящие в состав белков, построены по одной схеме. В любой из этих аминокислот есть карбоксильная группа и аминогруппа, присоединенные к центральному атому углерода (тому, который мы назвали альфа-атомом). Кроме того, к центральному атому углерода всегда присоединен атом водорода. Таким образом, из четырех валентностей альфа-углеродного атома три всегда заняты одними и теми же группами – карбоксильной, аминогруппой и атомом водорода. В этих частях молекул никакого разнообразия нет.
А вот четвертая валентность альфа-атома углерода занята изменчивой группой, которую мы для удобства назвали радикалом (–R). По ней-то аминокислоты и различаются (см. рис. 3.3).
Есть несколько аминокислот, у которых радикалы чисто углеводородные: аланин, валин, лейцин, изолейцин, фенилаланин. Две из них – лейцин и изолейцин – являются изомерами друг друга, потому так и названы. Они отличаются всего лишь положением одной метильной группы (–CH3). Чисто углеводородные радикалы плохо взаимодействуют с водой, но хорошо друг с другом. Иначе говоря, эти радикалы – гидрофобные.