
Полная версия
Фармакотерапия гестоза
Известно, что кортизол и прогестерон могут замещать друг друга в метаболических процессах, если имеется недостаток одного из них. Удаление коры надпочечников у экспериментальных животных обычно заканчивается смертельным исходом в течение 5 – 7 дней. Но этого, например, не происходит у 13-ringer бурундука, у которого полное удаление коры надпочечников имеет незначительные последствия, так как ее функции берут на себя яичники.
В яичниках развивается ткань, подобная ткани коры надпочечников. Прогестерон продлевает продолжительность жизни у животных с удаленной корой надпочечников, и некоторые из них могут сохранять удовлетворительное состояние неограниченно долгое время. Эстрогены и тестостерон не оказывают подобного эффекта. Экспериментальные животные после удаления коры надпочечников остаются в удовлетворительном состоянии, если имеется беременность или функционирует желтое тело, вплоть до окончания беременности или удаления желтого тела.
В случае недостатка прогестерона, что наблюдается при дегенерации плаценты, восстановительные механизмы вызывают увеличение выработки гормонов, которые стимулируют синтез прогестерона в тех железах, на которые они воздействуют. Кора надпочечников начинает синтезировать больше прогестерона. Взамен синтезируется больше кортизола и альдостерона из прогестерона, которые обладают способностью секретироваться. В более поздние сроки беременности, при продолжающейся плацентарной дегенерации, недостаток прогестерона еще более усиливается. Кора надпочечников продолжает подвергаться стимуляции вплоть до ее истощения, и может наступить ее некроз. Общий вес коры надпочечников матери и плода составляет примерно 20 г, а вес плаценты 400 – 800 г; ясно, что способность коры надпочечников продуцировать прогестерон мала по сравнению с плацентой. Удельная продукция кортизола (по отношению к весу и размерам тела) у плода соответствует таковой у взрослого. Относительное количество свободного кортизола по сравнению со связанными протеинами плазмы крови гораздо больше у плода (36 %), чем у матери (12 %). Поэтому существует градиент свободного кортизола от плода к матери. Вследствие наличия этого градиента и в результате замещения прогестерона кортизолом в случае дегенеративных изменений в плаценте регуляторные механизмы, воздействуя на гипофиз плода, вызывают усиление секреции АКТГ. За этим вскоре следует гиперплазия коры надпочечников плода, и это оказывается причиной «фетальной зоны», которую часто (но не всегда) находят при рождении у человека и у некоторых видов млекопитающих.
2. Некроз коры надпочечников.
Обнаруживаются некрозы и геморрагические инфаркты в участках коры надпочечников, взятых на биопсию при гестозе [Attia et al., 1970], а также в коре надпочечников в случае летального исхода. Продукция больших количеств цАМФ в коре надпочечников, когда они истощаются, должна прекратиться при наступлении некроза. Клиническая картина убедительно это доказывает. При нормальной беременности содержание цАМФ в моче, крови и амниотической жидкости повышается в III триместре беременности, а при гестозе оно достигает примерно лишь половины значений при нормальной беременности и приближается к средним значениям у небеременных. Когда эти значения определяются выше нормальных на сроках 16 – 24 нед. беременности, тогда развивается гестоз. Низкое содержание ренин-ангиотензина и альдостерона в тяжелых случаях гестоза можно объяснить низким уровнем цАМФ после некроза коры надпочечников.
3. Прогрессирующий недостаток Са.
По мере развития беременности потребность в Са возрастает. Во II половине беременности объем общего метаболизма повышается примерно на 1/3 и требуется больше Са, который участвует во многих метаболических процессах. Большие количества Са необходимы для быстро растущего организма (скелета) плода. Многие беременные женщины получают менее 1000 мг Са в день, в то время как исследования показывают, что они нуждаются в бо́льшем количестве. Duggin et al. (1974) установили, что если беременная получает 2000 мг Са в день, то ею абсорбируется и удерживается кальция больше, чем у тех, кто получает 1000 мг. В обеих группах выделяется одинаковое количество Са в моче. У тех беременных, которые получают 1000 мг Са, его позитивный баланс составляет 142 мг в день, а у тех, кто получает 2000 мг, позитивный баланс – 305 мг.
Недостаток поступления Са с пищей может привести к гипокальциемии в межклеточной жидкости. В этом случае регуляторные механизмы приводят к увеличению выработки паратиреоидного гормона, способствующего высвобождению Са из костей. Этот механизм может поддерживать содержание Са в межклеточной жидкости на уровне, близком к норме, если недостаток Са невелик и непродолжителен. Некоторое количество Са костей существует в мобильной форме, которая может быстро абсорбироваться в случае недостатка поступления Са извне. Тем не менее большая часть Са костей находится в форме устойчивых соединений и весьма медленно подвергается реабсорбции в случае недостатка поступления Са. Этот процесс оказывается неспособным поддерживать нормальный уровень Са в межклеточной жидкости, если во время беременности, когда потребности в Са остаются высокими в течение длительного времени, поступление Са извне недостаточно.
• Гипокальциемия в межклеточной жидкости ведет к повышенному содержанию ацетилхолина и α-адренергических катехоламинов, спазму гладкомышечных клеток сосудов и гипертензии. Гипокальциемия в межклеточной жидкости деполяризует клеточные мембраны преганглионарных симпатических нервов, относящихся к гладкомышечным клеткам сосудов, и повышает активный потенциал. Са проходит в клетку через канал, управляемый потенциалом. Активный потенциал проходит вдоль нейронного аксона к двигательному окончанию и вызывает высвобождение ацетилхолина посредством экзоцитоза, причем количество высвобождаемого ацетилхолина определяется количеством поступившего Са. Затем в постганглионарных адренергических нейронах ацетилхолин запускает высвобождение катехоламинов, которые посредством α-рецепторов приводят к повышению содержания Са в клетках гладкой мускулатуры сосудов, вызывая сокращение и спазм.
Если это воздействие продолжительно, то развивается гипертензия. Свидетельством в пользу данного механизма развития гестоза является то, что содержание адреналина и норадреналина в моче и в крови гораздо выше у тех, у кого развился гестоз, чем в контрольной группе. Кроме того, у больных с гестозом повышено содержание норадреналина и дофамина в мышечной ткани матки. При стимуляции мышечных клеток Ca2+ поступает в цитоплазму клетки из резервуаров Са в мембране и эндоплазматической сети, а в гладкой мускулатуре дополнительный Cа2+ поступает в цитоплазму из межклеточной жидкости для того, чтобы начать сокращение.
В гладкомышечных клетках нервные импульсы не начинают сокращение, а только регулируют его. Высокое содержание Cа2+ повышает активность киназы легких цепей миозина в клетках гладкой мускулатуры, от чего зависит объем фосфорилирования легких цепей миозина. Состояние длительного сокращения гладкой мускулатуры сосудов находится в прямой зависимости от степени фосфорилирования легкой цепи миозина таким образом, что избыток Са в цитоплазме клеток гладкой мускулатуры приводит к длительному (хроническому) сокращению и спазму. Продолжающийся спазм артериальной мускулатуры приводит к разрастанию фиброзной и мышечной ткани в интиме и средней оболочке сосуда, к фибринозной дегенерации стенки сосуда, к тяжелому артериосклерозу и гипертонии.
При фибринозной дегенерации в сочетании с холестериновым эндартериитом просвет сосуда может уменьшиться более чем вдвое, и затем может наступить закупорка тромбом. При гестозе отмечается такое же поражение спиралевидных артерий матки и плацентарных артерий. Если в какой-нибудь из них образуется тромб, то инфаркт плаценты неминуем. Если гестоз заканчивается летальным исходом, то при аутопсии выявляется генерализованное поражение артерий, особенно артерий гипофиза, коры надпочечников, печени, околоклубочкового аппарата.
• Гипокальциемия в межклеточной жидкости ведет к спастическим сокращениям поперечно-полосатой мускулатуры и к экламптическим судорогам. Пониженное содержание Са в межклеточной жидкости деполяризует мембраны клеток скелетной мускулатуры и вызывает повышение активного потенциала, что ведет к избыточному поступлению Cа2+ в цитоплазму. Процесс может затрагивать также и нервы, относящиеся к этим мышцам. Это ведет к патологическому сокращению скелетных мышц, проявляющемуся в виде подергиваний, тонических и клонических конвульсивных сокращений. Артериолы головного мозга также вовлекаются в процесс, наступает их спазм, что ведет к гипоксии головного мозга и еще большему усилению судорог (рис. 3).
Проведенные в последнее время исследования показывают, что причиной повышения артериального давления является увеличение нормы содержания Са в цитоплазме гладкомышечных клеток сосудов.
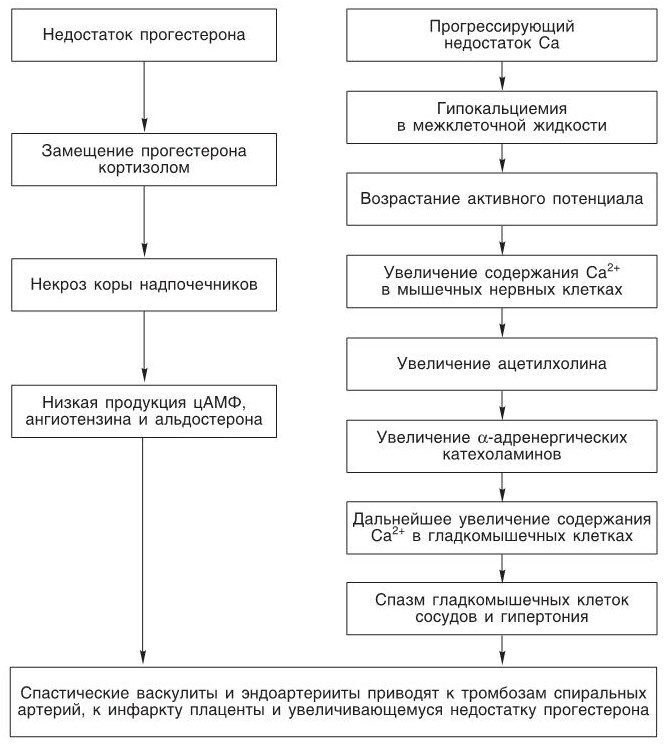
Рис. 3. Схема патофизиологии гестоза во II половине беременности
Парадокс заключается в том, что согласно исследованиям:
• высокая частота развития гипертонии наблюдается в тех группах населения, где потребление Са понижено;
• у экспериментальных животных, получающих мало Са, развивается гипертензия, которая проходит при получении животными большего количества Са;
• у беременных женщин, потребляющих много Са, редко развивается гестоз, несмотря на плохие материальные условия и отсутствие пренатального наблюдения и ухода.
Что касается патофизиологии гестоза, то можно выделить две различные, но взаимосвязанные фазы: к 1 – й ф а з е относятся изменения, возникающие в I половине беременности и происходящие в результате истощения коры надпочечников; 2 – я ф а з а – это изменения, происходящие главным образом вследствие прогрессирующей недостаточности Са во II половине беременности.
Первичным нарушением в I половине беременности является в буквальном смысле слова наводнение большими количествами цАМФ, продуцируемыми в коре надпочечников после наступившего их истощения.
Вначале причинами истощения коры надпочечников служат: 1) плохое питание; 2) предшествующее заболевание; 3) синдром истощения; 4) эмоциональный стресс.
Избыток цАМФ ведет к: 1) синтезу избыточных количеств холестерола (холестерина) в коре надпочечников и холестеринемии и эндартериитам в сосудах матери, плода и плаценты; 2) избытку альдостерона, вызывающему общую задержку натрия и воды (отеки) во всех тканях, включая стенки сосудов; 3) избытку ренин-ангиотензина и спазмам сосудов ворсинок, что в соединении с холестериновыми эндартериитами ведет к дегенерации ворсинок; 4) вазопрессиноподобному эффекту в клетках почечных канальцев, что ведет к задержке воды и отекам.
Возникающий вследствие дегенеративных изменений плаценты недостаток прогестерона замещается кортизолом у матери и плода. Это усугубляет истощение коры надпочечников, что в конце концов ведет к геморрагиям, некрозу надпочечников и к прекращению продуцирования цАМФ.
Первичным нарушением во II половине беременности является спазм гладкой мускулатуры сосудов, вызываемый избыточным количеством ионов Са+ в клетках.
Недостаточность Са, которая в I половине беременности, наряду с другими факторами, приводит к истощению коры надпочечников, усугубляется во II половине беременности вследствие повышенной потребности в Са со стороны растущего скелета плода и вследствие повышения объема на 1/3 материнского метаболизма.
Недостаток Са ведет в организме к пониженному содержанию его в межклеточной жидкости, к деполяризации мембран нервных и мышечных клеток и к появлению их активного потенциала. Во время действия активного потенциала Са из межклеточной жидкости поступает в цитоплазму мышечных клеток сосудов, вызывая сокращение, а также поступает в постганглионарные симпатические нейроны, вызывая высвобождение избыточных количеств ацетилхолина. Поступление избыточных количеств ацетилхолина в постганглионарные адренергические нейроны вызывает гиперсекрецию α-адренергических катехоламинов, что ведет к еще большему поступлению Са в клетки, усугубляя спазм и гипертензию.
Поступающий в большом количестве Са2+ в клетки поперечно-полосатых мышц во время действия активного потенциала вызывает экламптические судороги.
КОНЦЕПЦИЯ АНТИОКСИДАНТНОЙ НЕДОСТАТОЧНОСТИ В ПАТОГЕНЕЗЕ ГЕСТОЗА
Абрамченко В. В., Баскаковым В. П., Соколовским В. В., Костюшовым Е. В. (1982, 1984, 1987, 1988) разработана новая концепция роли антиоксидантной недостаточности в патогенезе гестоза. Исследования, посвященные изучению клинических и теоретических аспектов патогенеза гестоза, имеют большое научное, практическое, а также социальное значение. Однако, как справедливо отмечалось проф. В. И. Бодяжиной (1987), направленность проводимых исследований ограничивается до сих пор накоплением фактических данных без углубленного их обобщения, что не позволяет создать своевременную концепцию патогенеза данной патологии и, следовательно, разработать перспективные пути ранней диагностики, своевременной профилактики и лечения.
В настоящее время мнение о существовании многих факторов, которые могут принимать участие в формировании гестоза, не утратило своего значения. Одни авторы отводят в генезе заболевания первостепенную роль экзогенным факторам: физическим, химическим, алиментарным, гелиобиологическим; другие – эндогенным: иммунологическим, гормональным, генетическим, гипоксическим и др. Вместе с тем трудно представить, что перечисленные факторы риска действуют на организм беременной каждый в отдельности, независимо друг от друга. По-видимому, состояние женщины в тот или иной период беременности определяется совместным влиянием большинства перечисленных факторов в различных комбинациях, и гестоз было бы логично рассматривать как своеобразное осложнение течения беременности, имеющее многофакторный генез.
Организм беременной через нейроэндокринные регуляторные механизмы отвечает на воздействие внешних и внутренних раздражителей общими неспецифическими реакциями. Биологический смысл этих реакций состоит в мобилизации функциональных резервов организма беременной для поддержания гомеостаза. Совокупность процессов, направленных на сохранение постоянства критических параметров внутренней среды организма во время беременности при действии разнообразных агентов, составляет механизм а д аптации, или неспецифической резистентности организма. Конечный результат мобилизации адаптационных механизмов (приспособление организма беременной к новым условиям среды или несостоятельность систем неспецифической защиты, имеющая следствием развитие болезни) зависит от ряда условий: силы и продолжительности действия раздражителя, индивидуальных генетических, возрастных особенностей организма и др.
Адаптационные неспецифические реакции, развивающиеся в ответ на действие экстремальных факторов, характеризуются наличием стадий (или фаз), имеют широкий диапазон изменений и затрагивают разные уровни структурной организации: субмолекулярный, молекулярный, надмолекулярный, субклеточный, клеточный, органо-тканевой и организменный.
От функциональной полноценности механизмов неспецифической резистентности (как в целом, так и отдельных звеньев) зависит состояние адаптационных процессов.
В связи с этим возникает принципиально важный для понимания патогенеза гестоза вопрос: за счет какого конкретного механизма адаптированный организм беременной при действии факторов риска превращается в неадаптированный?
Для получения ответа на вопрос целесообразно использовать при изучении патогенеза гестоза концепции современной биохимии. Подобный подход позволяет надеяться на успешное решение таких важных в практическом отношении задач, как оценка индивидуальной защитной «мощности» систем адаптации или разработка способов искусственного повышения неспецифической резистентности организма беременной с помощью немедикаментозных и медикаментозных средств для профилактики и лечения гестоза.
Одной из концепций, которая, по нашему мнению, может приблизить специалистов к пониманию сущности нарушений механизмов гомеостаза при гестозе, является концепция, рассматривающая антиоксидантную недостаточность организма беременной как пусковой механизм заболевания.
В соответствии с новой концепцией развития гестоза предполагается, что в ответ на действие экзогенных и эндогенных факторов риска в материнском организме возрастает интенсивность адаптивных биохимических реакций, результатом побочного действия которых является увеличение количества первичных свободных радикалов. Последние инициируют образование перекисных соединений. Эти соединения в силу высокой электрофильности способны вызывать окислительную модификацию различных биосубстратов и оказывать повреждающее действие на клетку. Проявлению патогенного действия перекисных соединений препятствует многокомпонентная антиоксидантная система организма (АОС), имеющая непосредственное отношение к молекулярным механизмам неспецифического гомеостаза.
В частности, АОС обеспечивает связывание свободных радикалов, предупреждает образование перекисей или вызывает их разрушение [Glaving, 1963]. По современным представлениям, АОС состоит из неферментативного звена – водорастворимых диализуемых (низкомолекулярные тиолы, аскорбиновая кислота – АК) и жирорастворимых (токоферол, витамины A, K, P, убихинон и др.) веществ и ферментативного звена, включающего оксидоредуктазные (глутатионредуктаза – ГР) и антиперекисные (глутатионпероксидаза, супероксиддисмутаза – СОД, каталаза и др.) ферменты. Важно подчеркнуть, что функционирование неферментативного и ферментативного звеньев АОС зависит от фонда доноров водорода. Последний поставляется за счет каталитического дегидрирования субстратов биологического окисления, осуществляемого в первой фазе пентозофосфатного цикла (ПФЦ), в процессе гликолиза, в цикле Кребса и β-окисления высших жирных кислот. Этим объясняется тесная взаимосвязь между уровнем биоантиоксиданта в тканях и активностью дегидрогеназ.
Предполагается, что экстремальные факторы риска, воздействуя на организм матери, могут провоцировать неадекватное напряжение, а затем и истощение АОС, что в конечном итоге может привести к срыву ее функционирования. Как считают авторы, патогенное воздействие факторов риска на АОС организма беременной осуществляется за счет модификации ряда биохимических и иммунохимических реакций, и, в частности, тех, которые имеют прямое или косвенное отношение к функционированию АОС. Это прежде всего окислительно-восстановительные реакции в тиол-дисульфидной и аскорбатной системах, процессы перекисного окисления липидов (ПОЛ), влияющие на уровень антиоксидантов липидной природы, активность антиперекисных ферментов и оксиредуктаз.
Правомерность высказанных суждений подтверждается результатами проведенных нами исследований.
Комплексное клиническое обследование с использованием современных клинико-физиологических и биохимических методов было проведено у 320 женщин с различными формами гестоза – отеками беременных, нефропатией I – III ст. тяжести, преэклампсией, эклампсией. Для сравнения было обследовано 46 здоровых небеременных женщин и 56 женщин с физиологически протекающей беременностью при сроке 28 – 40 нед.
Как показал анализ полученных данных, у женщин с физиологически протекающей беременностью по сравнению со здоровыми небеременными женщинами была повышена активность как неферментативного, так и ферментативного звена АОС. В частности, отмечалось увеличение содержания в крови восстановленных эквивалентов небелковой тиол-дисульфидной и аскорбатной окислительно-восстановительных систем (SH-групп и АК) и незначительное накопление их окисленных производных (SS-групп, дегидроаскорбиновой – ДАК и дикетогулоновой кислот – ДКГК). Следствием этого явилось увеличение коэффициентов SH/SS и АК/ОФ. Наряду с этим имело место повышение уровня α-токоферола на фоне умеренно выраженной активации ПОЛ, о чем свидетельствует нарастание в крови малонового диальдегида (МДА).
Активация функции ферментативного звена АОС выражалась в тенденции к увеличению содержания в крови СОД, каталазы и особенно ГР.
Как считают авторы, повышение концентрации восстановленных эквивалентов небелковой тиол-дисульфидной (представленной в системе крови в основном глутатионом) и аскорбатной окислительно-восстановительных систем связано с увеличением активности ГР, которая поддерживает восстановительный потенциал глутатиона. В свою очередь, глутатион путем восстановления ДАК способствует регенерации АК. Вместе с тем ГР катализирует восстановление окисленного глутатиона, используя для этого никотинамидадениндинуклеотидфосфат – НАДФ ⋅ H2. Образование НАДФ ⋅ H2 зависит от активности дегидрогеназ-глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ), лактатдегидрогеназы (ЛДГ), сукцинатдегидрогеназы (СДГ) – важнейших метаболических циклов, в частности ПФЦ, гликолиза, цикла Кребса, β-окисления высших жирных кислот. Образующийся при этом НАДФ ⋅ H2 может быть использован как источник атомов водорода, необходимых для нормального функционирования АОС. В свете сказанного есть все основания полагать, что повышение уровня восстановленных эквивалентов может быть обусловлено активацией дегидрогеназ.
Высказанное предположение согласуется с результатами исследований ряда авторов, выявивших активацию Г-6-ФДГ, ЛДГ, СДГ в поздние сроки физиологически протекающей беременности [Машаева Л. Л. и др., 1985; Чиладзе З. А. и др., 1981].
Говоря о причинах изменения уровня субстратов липидной природы, можно предположить, что повышение концентрации α-токоферола в крови связано с мобилизацией синтетических процессов.
Повышение в крови содержания МДА наряду с активацией антиперекисных ферментов (СОД, каталазы) свидетельствует о возрастании интенсивности реакций свободнорадикального окисления (СРО). Именно умеренная интенсивность этих реакций является условием активации АОС клеток и тканей материнского организма, играя важную роль в механизмах его адаптации к новым условиям среды и предотвращая возможность развития функциональных расстройств или патологических изменений в жизненно важных органах и системах организма беременной.
Иной характер изменений компонентов АОС был обнаружен при обследовании беременных, страдающих гестозом. Так, при всех клинических формах этой патологии были обнаружены дефицит α-токоферола и нарушения окислительновосстановительного гомеостаза в небелковой тиол-дисульфидной и аскорбатной системах. В частности, отмечалось уменьшение содержания восстановленных (SH-групп и АК) и увеличение концентрации окисленных (SS-групп, ДАК, ДКГК) эквивалентов указанных систем. Следствием этого явилось уменьшение коэффициентов SH/SS и АК/ОФ. Выявленные нарушения являются следствием окислительной модификации субстратов, о чем свидетельствует сдвиг окислительно-восстановительного равновесия в сторону окисленных форм в небелковой тиол-дисульфидной и аскорбатной системах и накопление значительных концентраций МДА в крови больных. Указанные нарушения коррелировали с тяжестью течения токсикоза. Вместе с тем можно предположить, что снижение уровня восстановленных эквивалентов обусловлено инактивацией дегидрогеназ. Естественно, это предположение нуждается в подтверждении специальными исследованиями.
Наряду с вышеизложенным в состоянии ферментативного звена АОС выявлена д вухфазность изменений активности оксидоредуктазных и антиперекисных соединений (ферментов) в зависимости от тяжести течения гестоза. При отеках беременных обнаружена активация ГР, СОД, каталазы, тогда как при нефропатии I – III ст., преэклампсии и эклампсии имело место снижение активности энзимов. По-видимому, эта двухфазность в значительной мере обусловлена разным уровнем интенсивности реакций СРО при начальной и тяжелых формах гестоза.
Результаты проведенных исследований свидетельствуют о снижении буферной емкости АОС организма беременной на фоне многократного усиления реакций АОС при всех клинических формах гестоза.
Согласно полученным данным, можно предположить, что в условиях несостоятельности антиоксидантной системы организма беременной «мишенью» для биологического действия патогенных агентов (дисульфидов, ДАК, перекисных соединений, синглетного кислорода и др.) являются белки, нуклеиновые кислоты, субстраты липидной природы, окисление которых приводит к их модификационным изменениям и, как следствие этого, к нарушениям биологической активности, синтеза, транспорта ферментов, гормонов, витаминов, медиаторов, изменениям рецепции, мембранной проницаемости, а также к энергетическому дефициту и нарушениям транспорта гемоглобином кислорода и утилизации его тканями.
Указанные нарушения приводят к радикальным изменениям режимов жизнедеятельности организма и в конечном итоге к дезинтеграции гуморальных и клеточных механизмов защиты, что и может явиться основой нарушений деятельности ЦНС и ВНС, угнетения процессов тканевого дыхания, увеличения сосудистой проницаемости и внутрисосудистых расстройств. В свою очередь, результатом указанных нарушений являются изменения циркуляторного гомеостаза и системы гемостаза, сосудистой реактивности и микроциркуляции, сердечной деятельности, а также расстройств легочного газообмена, что и приводит к развитию гипоксии тканей и органов.


