
Полная версия
Фармакотерапия гестоза
Постоянно повышенный уровень аккумуляции Са2+ митохондриями при гипертензии вызывает в них ряд нарушений, важнейшим следствием которых является снижение синтеза АТФ и развитие структурных изменений митохондрий, прослеженных на экспериментальной модели первичной гипертензии.
Интенсивная аккумуляция митохондриями избытка цитозольного Са2+ при гипертензии, сопровождающаяся затратой энергии на выкачивание протонов в цитоплазме и соответствующим снижением продукции АТФ, носит постоянный характер. Происходящее при этом «сжигание» АТФ для обеспечения механизма аккумуляции Са2+ сопровождается повышенным образованием побочных токсических продуктов работы дыхательной цепи, в частности супероксида свободных гидроксильных радикалов, способных повреждать молекулы белка, липидов и нуклеиновых кислот. Это составляет основу механизмов повреждения митохондриального аппарата при первичной гипертензии.
Одновременно нарушение клеточной энергетики составляет звено, объединяющее мембранные нарушения и метаболический синдром.
Патофизиологические изменения при гестозе могут быть подразделены на две фазы: в 1-й фазе, примерно в I половине беременности, проявляющейся действием избыточного цАМФ, происходит гиперплазия коры надпочечников, их гиперфункция и истощение; во 2-й фазе, характеризующейся действием избыточного клеточного Са2+, которое наступает ко II половине беременности после геморрагии и некроза коры надпочечников.
Основным нарушением функции клеток, ведущим к гипертензии, является длительный спазм гладкомышечных клеток — артериол.
Механизм возникновения этой дисфункции во время беременности в результате действия различных гормонов и Са2+ является предметом развиваемой нами концепции гестоза.
Оптимальная суточная потребность кальция составляет для беременных и кормящих 1200 мг.
Концентрация кальция во вне- и внутриклеточной жидкости поддерживается в очень узких пределах, что жизненно важно для нормального функционирования физиологических систем. Этот элемент находится преимущественно вне клетки.
Его внутриклеточная концентрация составляет около 1/10000 от концентрации вне клетки. Нервное проведение, сокращение мышцы и свертывание крови зависят от нормального содержания кальция.
Кальций находится в крови в ионизированном состоянии (Ca2+), а также в связанной с белками форме и образует комплексы с различными отрицательно заряженными соединениями. Около 50 % общей концентрации представлено свободной или ионизированной формой кальция. Ионизированный кальций биологически активен и играет ключевую роль в осуществлении нервно-мышечной передачи и свертывании крови. Внеклеточный ионизированный кальций находится в равновесном состоянии с резервной формой кальция, депонированной в костях. Концентрации кальция и фосфата во внеклеточной жидкости взаимосвязаны: приблизительно сохраняется величина произведения растворимостей этих двух ионов.
Механизмы, участвующие в поддержании нормальной концентрации ионизированного внеклеточного кальция, регулируют его абсорбцию в желудочно-кишечном тракте, экскрецию почками и процессы обмена в костях. Организм защищает себя от гипокальциемии, увеличивая его абсорбцию в желудочно-кишечном тракте, уменьшая почечную экскрецию и повышая скорость разрушения костей и деминерализации. Высокие концентрации кальция во внеклеточном пространстве приводят к снижению его абсорбции в желудочно-кишечном тракте, увеличению экскреции почками и усилению минерализации костей.
В процессе эволюции появилась клеточная мембрана для защиты клетки от окружающей среды и для поддержания ионного баланса межклеточной жидкости в состоянии, подобном тому, при котором развивалась жизнь на Земле.
В высокой концентрации Са2+ является токсином для клетки, и при резком повышении концентрации Са2+ клетка немедленно умирает. Практически при всех энзиматических взаимодействиях используется Са2+, но в очень малых количествах. Имеется специальный клеточный механизм, поддерживающий гомеостаз Са2+. В мембране есть каналы, благодаря которым Са2+ может проникать через мембрану. При этом кальциевые каналы являют большое разнообразие по сравнению с натриевыми каналами. С точки зрения филогенеза считается, что Са-каналы гораздо древнее, чем натриевые каналы, и в процессе развития они появляются всегда раньше.
В плане механизма действия Са2+ важно учитывать, что, во-первых, мембрана в покое очень слабо проницаема для Са2+, поэтому не требуется больших затрат энергии для поддержания оптимального уровня Са2+, во-вторых, имеется Са-насос, или Са2+-Mg2+-АTФaзa, который выкачивает Са2+ из клетки в межклеточное пространство.
Повышение содержания Ca2+ внутри клетки приводит в действие мембранный Са-насос, контролируемый Са-кальмодулином. Тогда в норме концентрация Са2+ внутри клетки понижается, клетка таким образом защищается от токсического воздействия высокой концентрации Са2+.
Митохондрии и эндоплазматический ретикулум в гладких мышцах играют главную роль в клеточном Са-гомеостазе.
Перенос Са2+ из цитоплазмы в пространство матрикса митохондрий требует затраты энергии и может совершаться в больших количествах, в то время как перемещение из матрикса лимитировано и совершается пассивно. Если концентрация Са2+ в цитоплазме повышается, например вследствие продолжительного воздействия мессенджера (агента), тогда Са2+ в большом количестве поступает в митохондрии и большая его часть остается здесь в ионизированном состоянии. Наконец, достигается какой-то постоянный уровень, при котором обмен Са2+ между митохондриями и цитоплазмой происходит таким образом, что содержание Са2+ в цитоплазме сохраняется лишь на несколько более высоком уровне, чем в клетке в состоянии покоя. Если все же концентрация Са2+ продолжает оставаться повышенной, Са2+ начинает поступать в митохондрии или в эндоплазматический ретикулум быстрее, чем выводится из них, и происходит насыщение митохондрий. Когда способность митохондрий поглощать Са2+ истощается, избыточное содержание Са2+ приводит к дисфункции клетки и, наконец, к ее гибели.
КАЛЬЦИЙ, ГЛАДКОМЫШЕЧНАЯ МУСКУЛАТУРА СОСУДОВ, ГИПЕРТЕНЗИЯ
Ангиотензин и α-адренергические катехоламины, воздействуя на гладкомышечные клетки сосудов, вызывают их сокращение. При повышенной концентрации какого-нибудь из катехоламинов они вступают в соединение с соответствующими специфическими рецепторами на поверхности мембраны мышечной клетки сосуда и вызывают поступление Ca2+ в цитоплазму из пула плазменной мембраны и эндоплазматического ретикулума, а также происходит поступление Са2+ из межклеточного пространства через каналы с рецепторной или электрической регуляцией.
Содержание Са2+ в цитоплазме также повышается при уменьшении способности эндоплазматического ретикулума абсорбировать его и понижается при повышении содержания цитоплазматического Na+ и повышении вследствие этого Na+-Са2+-обмена. Оба эти вида обмена регулируются цАМФ таким образом, что повышенное содержание цАМФ может привести к повышению содержания Са2+ в цитоплазме.
Состояние сокращения гладкомышечных клеток сосудов зависит от степени фосфорилирования миозиновой короткой легкой цепи, которое контролируется Са-зависимой протеинкиназой, киназой миозиновой легкой цепи. Таким образом, если содержание Са2+ в цитоплазме повышается, процесс фосфорилирования миозиновой легкой цепи усиливается и АД повышается. Любые процессы, вызывающие длительное повышение содержания Са2+ в цитоплазме гладкомышечных клеток сосудов выше нормы, ведут к артериальной гипертензии.
ПАТОФИЗИОЛОГИЯ ГЕСТОЗА
Необходимо подчеркнуть, что в I половине беременности могут возникать условия, ведущие к дисфункции эндокринной системы (рис. 2), что в дальнейшем может привести к спастическим васкулитам и артериальной гипертензии во II половине беременности.
Аргументом для пересмотра сложившихся представлений явилось открытие характерных для этой патологии генерализованных нарушений ионотранспортной функции и ряда других свойств клеточных мембран различных тканей организма, а также выявление «метаболического синдрома», объединившего гипертензию с целым спектром сопутствующих обменных нарушений, к которым относят сахарный диабет тип 2, гиперинсулинемию, дислипидемию, абдоминальное ожирение. Полагают, что основу метаболического синдрома составляет необычно высокая резистентность тканей к инсулину, характерная для этой формы гипертензии.
Вначале адренокортикотропный гормон (АКТГ), воздействуя на кору надпочечников, вызывает ее гиперстимуляцию, что ведет к повышению продукции цАМФ в коре надпочечников в несколько тысяч раз выше нормы. При таком сверхфизиологическом количестве цАМФ наблюдается не только избыточный синтез холестерола, кортизола и альдостерона в коре надпочечников, но и поступление больших количеств цАМФ в кровь и далее в различные органы, где он вызывает неспецифическую задержку воды, приводящую также к различным патологическим состояниям и реакциям. Имеется клиническое подтверждение, что если у беременных в I половине беременности повышается уровень цАМФ в крови, моче и в амниотической жидкости, то во II половине беременности развивается гестоз.
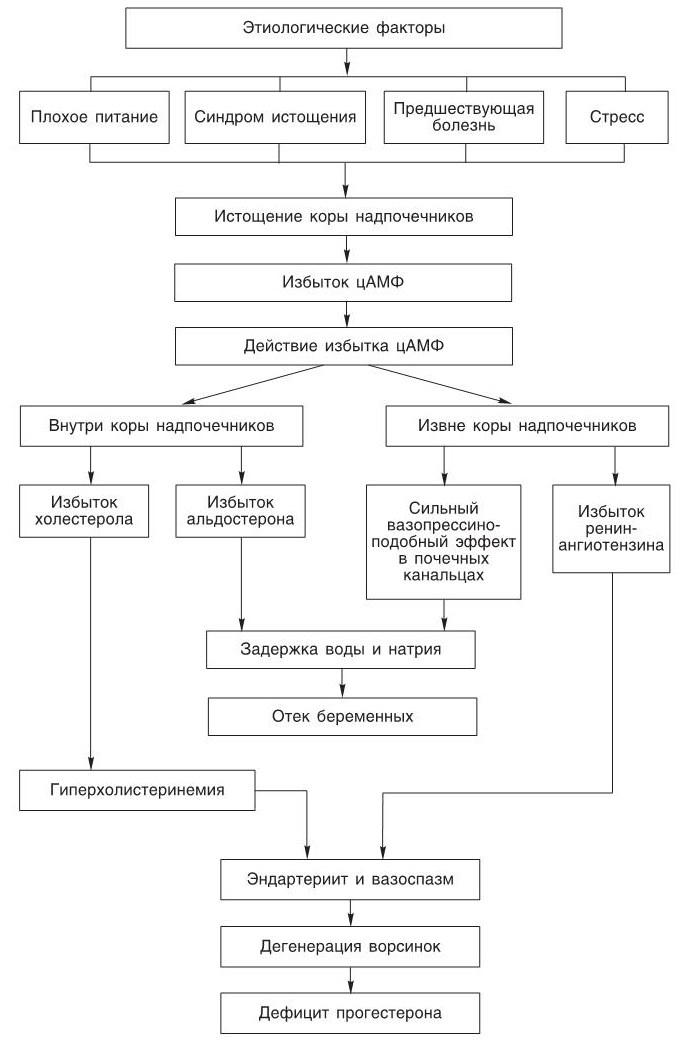
Рис. 2. Патофизиология гестоза в I половине беременности
ЭТИОЛОГИЧЕСКИЕ ФАКТОРЫ
Следующие этиологические факторы ведут к гиперстимуляции коры надпочечников и к продукции больших количеств цАМФ.
• Плохое общее питание.
Для нормального клеточного метаболизма необходимо определенное количество витаминов, энзимов, коэнзимов, ионов H+ и других метаболитов, так же как и углеводов, жирных кислот, аминокислот и белков, минеральных веществ и О2.
Дефицит каких-либо компонентов энзимных систем может привести к блокированию нормальных биохимических реакций.
Недостаток одного или нескольких витаминов всегда ведет к гиперплазии, гипертрофии коры надпочечников, которая может доходить в крайних случаях до удвоения массы. Витамины выступают в качестве катализаторов в энзимных системах. Тропные гормоны, действующие извне на рецепторы мембран, контролируют энзимные системы. Если биохимическая реакция энзимной системы заблокирована по той или иной причине, система обратной связи вызывает большую продукцию гормона, контролирующего энзимную систему. Гормоны коры надпочечников участвуют в большинстве физиологических функций. Если вырабатывается недостаточно гормонов коры надпочечников (кортикальных), механизм обратной связи, воздействуя на систему гипоталамус – гипофиз – кора надпочечников, вызывает усиленное образование адренокортикотропного гормона (АКТГ), что приводит к кортикальной гиперплазии и гипертрофии и в крайних случаях к истощению и дегенерации коры надпочечников. В отсутствие Са+2 активность большинства гормонов подавляется, в то время как продукция цАМФ в надпочечниках на отсутствие Са+2 почти не влияет.
Продукция цАМФ в коре надпочечников при максимальном стероидогенезе мала по сравнению с продукцией цАМФ в ответ на максимальную концентрацию АКТГ, когда она может быть в несколько тысяч раз выше нормы. Для уменьшения избытка цАМФ необходимо действие фосфодиэстеразы и Са-кальмодулина; таким образом при недостатке Са+2 избыток цАМФ сохраняется. АКТГ взаимодействует с мембранным рецептором клеток коры надпочечников и активирует аденилатциклазу. Аденилатциклаза в присутствии Са-кальмодулина образует цАМФ из АТФ. Действуя посредством протеиновых киназ, цАМФ образует холестерол (холестерин Са27Н45ОH) из липидных капель.
Образование специфического протеина в клетках коры надпочечников также вызывает цАМФ. При взаимодействии этого протеина со свободным холестеролом образуется прегненолон, который внутри митохондрий превращается в прогестерон. В ходе дальнейшего синтеза в цитоплазме прогестерон превращается в кортизол и альдостерон, которые секретируются кортикальными клетками в кровь.
• Предшествующие заболевания.
Такие предшествующие заболевания, как сахарный диабет и гипофункция щитовидной железы, могут вызывать стрессоподобные состояния и давать такой же эффект, как и недостаточное (несбалансированное) питание. При недостатке вторичных гормонов биохимические реакции в энзимных системах могут блокироваться и холестерол будет накапливаться. Организм матери может абсорбировать инсулин или тироксин плода, что приведет к относительному диабету или гипотиреозу плода, сопровождаемым гиперхолистеринемией.
• Синдром истощения.
Общий метаболизм увеличивается с начала беременности и к III триместру повышается на 33 % по сравнению с уровнем его до беременности. Питание может быть адекватным до беременности, но с наступлением беременности может стать неадекватным. Работа сердца в покое возрастает в начале беременности и достигает пика – примерно на 40 % больше, чем до беременности – к 20-й нед. беременности. Наибольшее гемодинамическое напряжение достигается к 32-й нед. беременности. Гемодинамические изменения еще больше возрастают при физической нагрузке, и расход О2 повышен у беременных по сравнению с небеременными женщинами. При интенсивной и (или) длительной физической нагрузке может возникать дефицит O2, при котором некоторые ткани могут оказаться в состоянии кислородного голодания.
Недостаток О2 может привести к блокированию биохимических реакций в энзимных системах как у матери, такиуплода и к накоплению у них цАМФ и холестерола.
Синдром истощения сейчас играет бóльшую роль в возникновении гестоза, чем раньше. В современном обществе женщины часто работают полный рабочий день в дополнение к их обычным обязанностям домашней хозяйки, жены и матери. Очень часто они работают по 16 ч в день, что ведет к хроническому истощению и стрессу.
Многие биохимические реакции могут быть заблокированы вследствие относительного недостатка питательных веществ и гормонов. Синтез прогестерона может нарушаться в плаценте и в коре надпочечников, где прогестерон является предшественником кортизола. Кортизол составляет 80 % кортикальных гормонов и является необходимым для многих биологических функций, особенно связанных с продукцией энергии.
• Эмоциональный стресс.
Селье (1950) показал, что любой стресс вызывает в основном одинаковые изменения физиологических процессов и биохимических реакций на уровне клеточного метаболизма. Эмоциональный стресс, действуя на систему кора головного мозга – гипоталамус – гипофиз – кора надпочечников, вызывает длительную АКТГ-стимуляцию, истощение коры надпочечников и избыток цАМФ. Хотя беременная женщина может противостоять значительному количеству стрессов небольшой интенсивности и продолжительности, не заболев при этом, и родить здорового ребенка, но, если она подвергается сильному стрессовому воздействию в течение долгого времени, это может привести к истощению коры надпочечников и избытку цАМФ, что также может явиться этиологическим фактором возникновения гестоза.
• Недостаток кальция.
Недостаток кальция в I половине беременности может привести к блокаде энзимных реакций в клетках многих органов. Сюда относятся не только метаболизм костей, свертывание крови, но и те процессы, где Са2+ активирует внутриклеточные протеины, такие как кальмодулин и такие, где Са2+ служит вторичным мессенджером. Механизм обратной связи ведет к избытку цАМФ, что может также привести к развитию гестоза.
ДЕЙСТВИЕ ИЗБЫТКА цАМФ В КОРЕ НАДПОЧЕЧНИКОВ
• Возникновение избытка холестерола.
При нарушении синтеза стероидных гормонов в коре надпочечников возникающий там избыток цАМФ может продолжать вызывать синтез свободного холестерола. Этот избыточный холестерол может затем поступать в кровь, что ведет к гиперхолистеринемии, которая часто встречается у беременных и более выражена при развитии гестоза. Недостаточные состояния матери сказываются на состоянии плода, что ведет к нарушению остального стероидогенеза. Холестерин накапливается в крови плода. Гиперхолестеринемия ведет к холестериновым эндартериитам у матери, плода и в плацентарных сосудах.
• Возникновение избытка альдостерона и кортизола.
Избыток цАМФ также ведет к избыточному синтезу кортизола и альдостерона, выделяющихся в кровь. Альдостерон слабо связывается с протеинами плазмы крови и быстро выходит из крови в клеточную и межклеточную жидкость. В месте нахождения он вызывает внутри-, экстрацеллюлярную и васкулярную задержку Na+ и воды. Также он вызывает задержку Na+ и воды в почках, действуя на клетки дистальных канальцев и коллекторного протока.
ДЕЙСТВИЕ ИЗБЫТКА КОРТИКАЛЬНОГО цАМФ ВНЕ КОРЫ НАДПОЧЕЧНИКОВ
• Возникновение избытка ренина.
Обычно цАМФ действует в той клетке, где он синтезирован. Внутриклеточная концентрация цАМФ равна примерно 10– 7 М, в то время как в плазме крови – 10– 9 М. Гормоны в нормальных условиях могут повышать содержание цАМФ в плазме крови в 40 раз, тем не менее введенный извне цАМФ неэффективен в этой концентрации из-за слабой абсорбции клетками. Некоторые аналоги цАМФ легче проникают в клетку и используются в эксперименте для получения цАМФ-подобного эффекта.
В эксперименте с использованием суспензии клеток почки было показано, что добавление цАМФ вызывает статистически значимое повышение продукции ренина. Если цАМФ производится в количествах, превышающих физиологические, и наступает истощение коры надпочечников, тогда большие количества цАМФ могут поступать в кровь и достигать околоклубочковых клеток почек (юкстагломерулярные клетки), что может привести к синтезу избыточного ренина, который превратится в ангиотензин II (АII), являющийся наиболее сильным из известных сосудосуживающих веществ. Вдобавок ангиотензин действует на периферические адренергические нейроны и на мозговую часть надпочечников, вызывая синтез и выделение катехоламинов, что также действует на мозговые центры, вызывая повышение симпатической активности, и все это вместе приводит к повышению артериального давления.
• Избыток цАМФ вызывает вазопрессиноподобный эффект в клетках почечных канальцев.
Вазопрессин, или антидиуретический гормон, секретируется нейронами супраоптического и паравентрикулярного ядер гипоталамуса и накапливается в заднем отделе гипофиза. Его секреция и выделение контролируются осморецепторами, находящимися в гипоталамусе, которые чувствительны к изменениям осмотического давления в плазме крови. В этих клетках почечных канальцев цАМФ вызывает резкое повышение проницаемости клеточных мембран, обращенных в просвет канальца с луминальной стороны к воде, мочевине и другим растворимым веществам, что ведет к задержке воды. Количество мочи уменьшается, и она становится концентрированной. Избыточное действие вазопрессина может привести к периферическим отекам. При истощении коры надпочечников и продукции сверхфизиологических количеств цАМФ его уровень в плазме крови становится настолько высок, что абсорбируется в значительных количествах как юкстагломерулярными клетками, так и клетками почечных канальцев. Тогда действие избытка цАМФ на клетки почечных канальцев приводит к возникновению отека.
ДЕГЕНЕРАТИВНЫЕ ИЗМЕНЕНИЯ В ПЛАЦЕНТЕ
Если кортикальный стероидогенез у матери и плода нарушается вследствие какой-либо причины, это ведет к избыточному синтезу цАМФ, холестерина, альдостерона и к задержке Na+, как это описано выше. Гиперхолестеринемия вызывает холестериновые эндартерииты у матери, у плода и в плацентарных сосудах. В то же время избыток цАМФ ведет к гиперсинтезу ренин-ангиотензина, что вызывает спастические васкулиты в сосудах плаценты. Все это вместе может привести к окклюзии сосудов плаценты. Если в процесс вовлечены мелкие сосуды ворсинок, ворсинка может подвергнуться дегенерации и абсорбции или же рядом с дегенерирующей ворсинкой может происходить фибринообразование. Если затронуты крупные сосуды, может произойти инфаркт и дегенерация плаценты, на месте инфаркта может сформироваться рубец или киста. При обширной дегенерации ворсинок плацента теряет способность продуцировать прогестерон, необходимый для поддержания беременности, и также нарушается синтез кортикальных стероидов.
РАННИЕ ФАЗЫ ГЕСТОЗА
• Отек беременных.
Предпосылки для развития гестоза в конце I половины или в начале II половины беременности. Истощение коры надпочечников у матери и плода, вызываемое в I половине беременности плохим питанием и различными стрессами, во II половине беременности – замещением прогестерона кортизолом, сопровождается продукцией сверхфизиологических количеств цАМФ у матери и плода. В коре надпочечников избыток цАМФ вызывает избыточный синтез холестерола (холестерина) и альдостерона. Вне коры надпочечников избыток цАМФ вызывает вазопрессиноподобный эффект в почечных канальцах и задержку воды, что усиливается действием альдостерона и ведет к отекам и задержке натрия в различных тканях и органах, включая стенки артерий.
• Начало гипертонии.
Избыток цАМФ вызывает избыточный синтез ренин-ангиотензина в юкстагломерулярных (околоклубочковых) клетках. Ангиотензин стимулирует дальнейший синтез альдостерона. Наибольшие дозы ангиотензина в эксперименте у животных вначале не вызывают изменений артериального давления, но, безусловно, вызывают повышение секреции альдостерона. Позже, когда альдостерон уже привел к накоплению натрия в стенках сосудов, эти же самые малые дозы ангиотензина вызовут повышение артериального давления.
Ангиотензин приводит к повышению содержания Са2+ в цитоплазме гладкомышечных клеток сосудов, вызывая поступление Са2+ через рецепторно-управляемые каналы клеточной мембраны и высвобождение Са2+ из мембранного пула (резервуаров) из эндоплазматического ретикулума.
Повышение содержания натрия в клетке и воздействие цАМФ могут вызвать уменьшение Na-Са-обмена и привести к еще большему увеличению содержания Са2+ в цитоплазме. Повышенное количество Са2+ в цитоплазме приводит в свою очередь к повышению активности киназы легкой цепи миозина, к усилению фосфорилирования легкой короткой миозиновой цепи и тонического сокращения (тонуса) гладкомышечных клеток в стенках артерий, что ведет к повышению артериального давления.
В I половине беременности артериолы ворсинок оказываются весьма чувствительными к гиперхолистеринемии и сосудосуживающему действию ангиотензина. Плацентарные артерии тех пациенток, у которых развивается гестоз, поражены обширными эндартериитами, склерозированием и тромбозами и развитием дегенерации ворсинок.
У беременных крольчих, у которых удаление в конце I триместра беременности щитовидной железы вызывает гиперхолистеринемию у плода, также наблюдаются сильно выраженные холестериновые эндартерииты плацентарных сосудов.
Таким образом, рассматривая клеточные механизмы артериальной гипертензии, вызванной беременностью, следует заключить, что гипертония возникает вследствие увеличения выше нормы содержания Са2+ в гладкомышечных клетках сосудов. Гипертония (гестоз), обусловленная беременностью, вызывается недостатком Са, что ведет к уменьшению содержания Са в межклеточной жидкости, это деполяризирует клеточные мембраны и повышает потенциал нейронов в гладкомышечных клетках, что влечет за собой вход избыточного Ca2+.
В течение I половины беременности плохое (несбалансированное, недостаточное) питание и стрессы вызывают истощение адреносекреторной деятельности коры надпочечников и избыток цАМФ, что в свою очередь ведет к:
1) гиперхолистеринемии, эндартериитам и дегенерации ворсинок хориона;
2) избытку альдостерона, вызывающему задержку натрия и воды;
3) повышению в крови содержания ангиотензина, повышающего артериальное давление, что вызывает увеличение содержания внутриклеточного Са2+ и спазм гладкомышечных клеток сосудов;
4) вазопрессиноподобному действию на почечные канальцы, что ведет к задержке воды.
Дегенеративные изменения ворсинок хориона ведут к недостатку прогестерона. Прогестерон заменяется кортизолом, вызывая еще большее истощение коры надпочечников и, в тяжелых случаях, его некроз. Во II половине беременности возрастающий недостаток Са2+ и гипокальциемия межклеточной жидкости ведут к проникновению избыточного Са2+ в гладкомышечные клетки сосудов, а преганглионарные симпатические нейроны приводят к высвобождению избыточного ацетилхолина. В постганглионарных адренергических нейронах избыток ацетилхолина ведет к дополнительной секреции α-адренергических катехоламинов с высвобождением большого количества Са2+ в гладкомышечных клетках сосудов с усилением их спазма и появлением артериальной гипертонии. Повышение содержания Ca2+ в поперечно-полосатых мышцах вызывает судорожные сокращения мышц.
Такова общая конструкция патогенеза первичной гипертензии беременных, составляющая основу мембранной концепции. 1. Замещение недостатка прогестерона кортизолом у матери и плода.


