Полная версия
Синдром Жильбера. Генетический сценарий твоего метаболизма и характера
7. Тяжёлые металлы (свинец, ртуть, кадмий). Эти металлы способны накапливаться в тканях организма, вызывая хронические интоксикации, негативно влияя на работу почек, центральной нервной системы и сердечно-сосудистой системы. При сниженной активности ферментов второй фазы детоксикации выведение тяжёлых металлов замедляется, повышая риски нейротоксических эффектов, гипертонии и когнитивных нарушений.
8. Бензопирены и диоксины. Канцерогенные соединения, присутствующие в загрязнённом воздухе, продуктах горения и переработке пищи (например, в копчёностях). Их накопление связано с повышенным риском рака и повреждением ДНК.
9. Продукты переработки пластика. Включают фталаты и микропластик, поступающие в организм с упаковкой и пищей.
Эти пластиковые вещества обладают накопительным эффектом, негативно сказываются на гормональной регуляции и репродуктивной системе. Компоненты пластика можно отнести к группе ксеноэстрогенов – веществ, сходных по структуре с собственными эстрогенами. Они конкурируют за рецепторы к эстрогенам, нарушая гормональный баланс, усиливая риски пролиферативных заболеваний и гормонального сбоя. Особенно уязвимы подростки и дети мужского пола: длительное воздействие ксеноэстрогенов в период полового созревания может приводить к формированию эстрогенового габитуса, проблемам с развитием половой идентичности и повышению риска гормонозависимых нарушений [4]. У девочек избыток ксеноэстрогенов может приводить к сбоям менструального цикла, склонности к отёкам, угревой сыпи, а также повышать риск гормонозависимых заболеваний, включая мастопатию и эндометриоз. Исследования также показывают, что воздействие ксеноэстрогенов связано с увеличением риска репродуктивных нарушений и более раннего полового созревания [5].
Ксеноэстрогены поступают в организм из следующих источников:
– Пластиковая упаковка и пластиковая посуда. Содержат бисфенол A (BPA), фталаты, а также другие компоненты пластика с гормоноподобной активностью.
– Бисфенол A (BPA) в составе пластика и бутылок. Один из наиболее изученных ксеноэстрогенов, доказано влияние на эндокринную систему.
– Парабены в косметике. Метилпарабен, пропилпарабен, бутилпарабен, этилпарабен, изобутилпарабен используются в шампунях, кремах и другой косметике как консерванты.
– Лаки для ногтей и стойкие покрытия для маникюра. Содержат фталаты и другие химические соединения с эстрогеноподобным эффектом.
– Одноразовая пластиковая и бумажная посуда (особенно с внутренним пластиковым слоем). Может выделять BPA и фталаты при нагревании или взаимодействии с жирной пищей.
– Термочеки (бумажные чеки с термопечатью). Поверхность чеков содержит BPA, который легко впитывается через кожу.
– Некоторые фитоэстрогены. Включают преимущественно природные соединения, такие как изофлавоны сои (генистеин, даидзеин), лигнаны (семена льна) и куместаны.
– Консерванты и покрытия упаковок для фастфуда. Часто содержат фталаты и другие вещества, способные вмешиваться в гормональную регуляцию.
– Фармацевтические препараты и БАДы. Оболочки капсул, изготовленные из метакрилатов (метилметакрилат, этилметакрилат, бутилметакрилат, метакриловая кислота), могут содержать вещества с эстрогеноподобной активностью.
– Синтетические ароматизаторы и красители. К синтетическим ароматизаторам с подозреваемой гормональной активностью относят ванилин синтетического происхождения, некоторые бензольные соединения. Из красителей – E102 (тартразин), E110 (желтый солнечный закат), E123 (амарант).
– Бытовая химия. Моющие и чистящие средства содержат поверхностно-активные вещества и консерванты, среди которых известны своими эндокринно-разрушающими свойствами алкилфенолы (ноннилфенол, октилфенол), триклозан, формальдегидные соединения.
Ниже представлены рисунок и таблица с основными источниками ксеноэстрогенов. Изучив их, вы сможете осознанно выбирать продукты, косметику и бытовые средства и избегать компонентов, повышающих токсическую нагрузку.
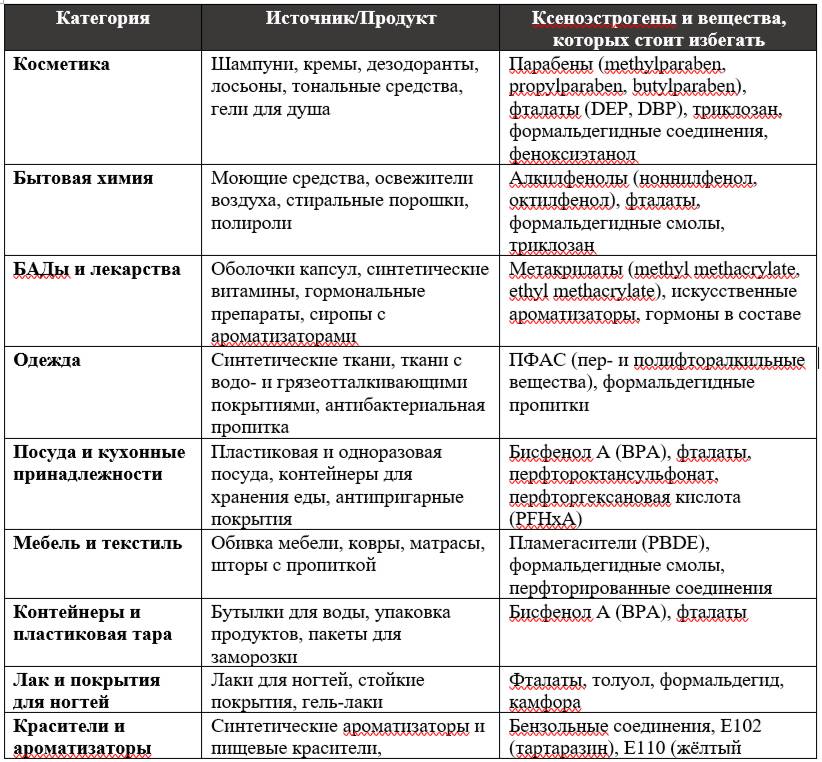
Рисунок №4 «Источники ксеноэстрогенов».

Таблица №1: Основные источники ксеноэстрогенов.
Весь поток токсинов, гормонов и продуктов обмена веществ проходит через один-единственный фермент – глюкуронозилтрансферазу. Всё – и вещества, поступающие из внешней среды, и собственные метаболиты организма – обезвреживаются именно с его участием. Один фермент берёт на себя весь этот колоссальный объём работы. Представьте себе: ежедневно он справляется с бесконечным потоком химических соединений, защищая наш организм.
В условиях современной жизни, когда токсическая нагрузка стремительно растёт – пластик, лекарственные препараты, бытовая химия, избыток гормонов, продукты цивилизации – система детоксикации буквально держится на способности этого фермента вовремя и эффективно нейтрализовать всё, что может нанести вред.
Когда по наследству от обоих родителей передаются две изменённые копии гена UGT1A1, активность этого фермента значительно снижается. В таком случае процесс обезвреживания токсинов замедляется, и это состояние и есть синдром Жильбера. Организм теряет способность эффективно справляться с нагрузкой, и токсины постепенно накапливаются. В результате появляются разнообразные симптомы: хроническая усталость, нарушения работы желудочно-кишечного тракта, гормональные сбои и признаки общей интоксикации.
Чтобы глюкуронозилтрансфераза могла работать полноценно, ей необходим «строительный материал» – глюкуроновая кислота. Именно её фермент присоединяет к токсинам, гормонам и другим соединениям, превращая их в безопасные и готовые к выведению формы.
Глюкуроновая кислота
Глюкуроновая кислота синтезируется в организме из глюкозы, которую мы получаем с пищей. Особенно важную роль здесь играют медленные углеводы – они обеспечивают стабильный, равномерный поток глюкозы без резких скачков уровня сахара в крови. Именно такой стабильный источник глюкозы необходим для постоянного синтеза глюкуроновой кислоты.
В условиях, когда активность фермента снижена по генетическим причинам, как при синдроме Жильбера, мы должны особенно внимательно следить за тем, чтобы этот субстрат поступал в достаточном объёме.
Вот основные источники углеводов и других компонентов, из которых организм производит глюкуроновую кислоту и поддерживает вторую фазу детоксикации:
1. Цельнозерновые крупы: овёс, гречка, бурый рис, киноа, пшено, перловка, булгур, кускус, рожь, ячмень, полба, спельта, камут, амарант, тритикале. Некоторые из этих круп содержат глютен (например, пшеница и её виды – полба, спельта, камут, а также рожь, ячмень, перловка, булгур, кускус, тритикале). При синдроме Жильбера часто нарушена работа ЖКТ, поэтому глютен рекомендуется минимизировать или исключить. Однако если по генам HLA-DQ нет чувствительности к глютену, можно оставить глютеновые злаки в рационе – важно предварительно замачивать их, тщательно готовить и отдавать предпочтение ферментированным продуктам, например, хлебу на закваске. Такие продукты медленно перевариваются и поддерживают стабильный уровень глюкозы.
2. Цельнозерновой хлеб на закваске и хлебцы: особенно ржаной, гречневый, пшеничный цельнозерновой хлеб, а также хлебцы из гречки или льна. Хороший источник сложных углеводов и клетчатки.
3. Бобовые: чечевица, нут, фасоль, горох. Отличный источник сложных углеводов и глюкуроновой кислоты. Для уменьшения содержания антинутриентов (лектинов и фитиновой кислоты) рекомендуется тщательно подготавливать бобовые: замачивать их перед приготовлением и подвергать длительной термической обработке.
4. Крестоцветные овощи: брокколи, цветная капуста, брюссельская капуста, белокочанная капуста. Помимо углеводов, содержат серосодержащие соединения, поддерживающие детоксикацию.
5. Корнеплоды: морковь, свёкла, пастернак, репа.
6. Зелень и листовые овощи: шпинат, петрушка, салаты, сельдерей, укроп, кинза.
7. Фрукты с низким гликемическим индексом: яблоки, груши, ягоды (черника, клюква, малина), гранат, цитрусовые (апельсины, лимоны, грейпфруты).
8. Лук и чеснок: благодаря содержанию серосодержащих соединений также поддерживают работу ферментов детоксикации. В умеренных количествах чеснок допустим при Жильбере, если у человека нет выраженной чувствительности ЖКТ. Лучше использовать его термически обработанным или в минимальных дозах сырого вида (например, в салатах или как добавку к блюдам).
9. Спаржа и артишоки: богаты клетчаткой и антиоксидантами, дополнительно поддерживают функцию печени и кишечника.
На рисунке ниже представлены основные из них: цельнозерновые крупы и хлеб на закваске, бобовые, корнеплоды, крестоцветные и листовые овощи, спаржа, артишоки и фрукты с низким гликемическим индексом. Регулярное включение этих продуктов в рацион создаёт условия для стабильной работы фермента и полноценного процесса детоксикации.

Рисунок №5 «Источники глюкуроновой кислоты».
Если в рационе преобладает кето или низкоуглеводное питание, дефицит углеводов приводит к снижению синтеза глюкуроновой кислоты. При этом организм, сталкиваясь с необходимостью обезвреживать токсины и гормоны, в первую очередь будет направлять все доступные углеводы именно на процессы детоксикации – это приоритетная задача для выживания [6]. Однако на синтез энергии для самого человека углеводов остаётся крайне мало. Именно поэтому у людей с синдромом Жильбера, особенно на фоне дефицита углеводов, часто наблюдается синдром хронической усталости, слабость, эмоциональная и физическая истощаемость, а также зависимость от быстрых углеводов (фрукты, сладости, хлебобулочные изделия).
Чтобы этого избежать, важно наладить регулярное и сбалансированное питание с достаточным количеством медленных углеводов. Интервальное голодание и любые формы длительного голода при синдроме Жильбера не рекомендуются, так как могут спровоцировать всплеск билирубина и ухудшить общее состояние. Также противопоказаны строгие диеты, жёсткие пищевые ограничения и вегетарианство. Такие подходы могут значительно усугубить течение синдрома Жильбера, привести к дефициту белка и ключевых витаминов, нарушить работу ЖКТ и ухудшить функцию детоксикации. Это подтверждают и биографические данные известных личностей. Например, Далай Лама, практикующий вегетарианство и ограниченное питание, нередко отмечал эпизоды слабости и ухудшения самочувствия – подробнее его история описана в главе 21.
Оптимально соблюдать режим не менее 4-х приёмов пищи в день, в каждом из которых должны быть источники белка, клетчатки, медленных углеводов и полезных жиров. Такой подход помогает стабилизировать энергетические уровни и поддерживать полноценную работу фермента глюкуронозилтрансферазы.
Важно учитывать, что глюкуроновая кислота может быть активно потребляема патогенной микрофлорой кишечника. Для условно-патогенных бактерий она является своего рода «лакомством» – они охотно используют её для собственных нужд. При нарушении баланса микробиоты именно эти микроорганизмы начинают забирать значительную часть глюкуроновой кислоты, тем самым снижая её доступность для работы фермента и процессов детоксикации [7].
Кроме того, при выраженном дефиците глюкуроновой кислоты организм может начинать забирать её из соединительных тканей – в первую очередь суставов и хрящей. Глюкуроновая кислота является предшественником гиалуроновой кислоты, которая обеспечивает вязкоэластичные свойства синовиальной жидкости и участвует в поддержании структуры хрящевой ткани. Это может проявляться в виде хруста в суставах, гипермобильности, дискомфорта, болей, а в долгосрочной перспективе – привести к ускоренной дегенерации хрящевой ткани [8]. Поэтому важно не только обеспечить поступление медленных углеводов с пищей, но и поддерживать здоровую микрофлору кишечника и общее нутритивное насыщение организма.
Ниже представлена таблица с основными источниками глюкуроновой кислоты и практическими рекомендациями по их включению в рацион.
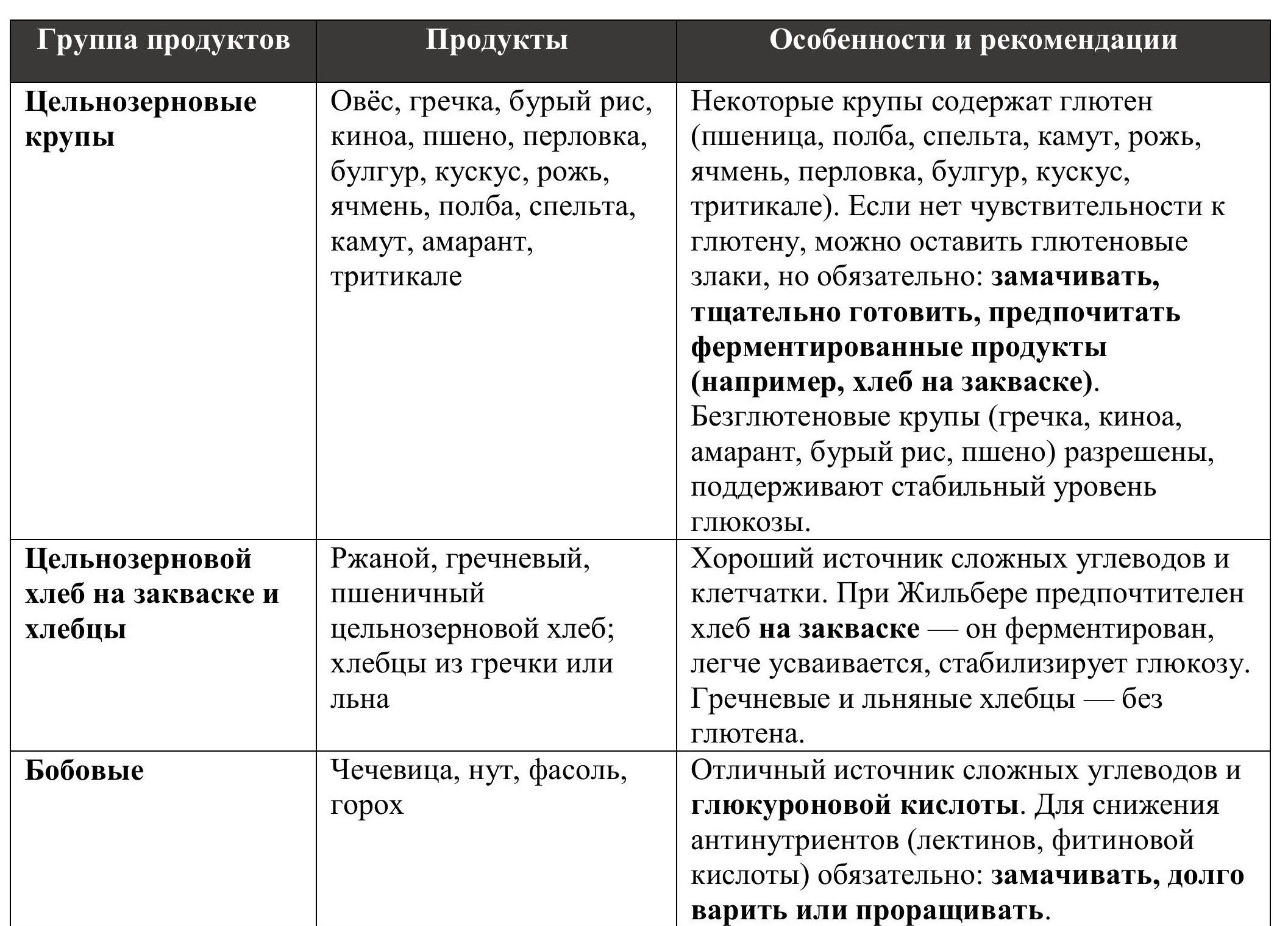
Таблица №2: Источники глюкуроновой кислоты.
Глава 3. Генетические нарушения желчеоттока
Одним из ключевых и часто недооценённых проявлений синдрома Жильбера является нарушение желчеоттока. Это наблюдается не только у пациентов с полным синдромом (гомозиготный вариант), но и у носителей одной копии мутации (гетерозиготных носителей).
Ген UGT1A1 отвечает за синтез фермента уридиндифосфат-глюкуронозилтрансферазы. В норме его генотип обозначается как (TA)6/(TA)6, а при наличии синдрома Жильбера встречается вариант (TA)7/(TA)7 – это полная форма синдрома. Носительство одной копии мутации – (TA)6/(TA)7 – проявляется мягче, уровень билирубина в таких случаях, как правило, остаётся в пределах нормы и может повышаться только на фоне провоцирующих факторов (стресс, интоксикации, голод, ОРВИ, менструация). Однако нарушение желчеоттока и замедленный процесс детоксикации токсинов присутствуют стабильно у носителей, независимо от провокаций.
При снижении активности фермента UGT1A1 нарушается нейтрализация метаболитов, включая билирубин и продукты обмена гормонов и токсинов. Эти вещества накапливаются и оказывают влияние на свойства желчи. Желчь становится густой, вязкой, приобретает "замазкообразную" консистенцию и плохо оттекает. Это состояние известно, как дискинезия желчевыводящих путей и часто сопровождается застойными явлениями, формированием сладжа (песка) и даже желчных камней [9]. Однако нередко при УЗИ может наблюдаться нормальная картина или выявляться перегиб протоков, что свидетельствует об изменении давления и деформации желчевыводящих путей вследствие нарушения оттока желчи.
Нарушение желчеоттока влечёт за собой:
1. Дефицит жирорастворимых витаминов (A, D, E, K), необходимых для нормального обмена веществ, иммунной функции и здоровья костей. Желчь необходима для всасывания этих витаминов в кишечнике.
2. Снижение усвоения минералов (железа, кальция, цинка, магния и других), а также водорастворимых витаминов (С и группы B). Это происходит косвенно – из-за нарушений работы слизистой кишечника и микробиоты при хроническом дефиците жёлчи.
3. Нарушение переваривания жиров. Желчь эмульгирует жиры, подготавливая их к расщеплению ферментами поджелудочной железы.
4. Усиление дисбиоза кишечника из-за застойной желчи. Желчь обладает антисептическим и противомикробным действием, а при её застое микробиота смещается в сторону патогенной.
5. Дефицит омега-3 жирных кислот. Для их всасывания также требуется нормальная секреция желчи. Недостаток усвоения омега-3 приводит к повышению воспалительного фона, нарушениям липидного обмена и ухудшению состояния нервной системы.
6. Повышение вероятности паразитарных инвазий. Желчь обладает антисептическим и противопаразитарным действием, а её застой создаёт благоприятные условия для роста и размножения паразитов.
7. Повышенную нагрузку на печень. Не вовремя выведенные токсины и метаболиты возвращаются в кровоток, снова циркулируя и усиливая нагрузку на печень.
8. Развитие дисбаланса жирных кислот и холестерина. Желчь участвует в их переваривании и всасывании, а нарушение этого процесса способствует дисбалансу липидного обмена и увеличивает риски атеросклероза.
9. Нарушение работы поджелудочной железы, вплоть до развития панкреатита. Желчь и сок поджелудочной железы выделяются синхронно, нарушение одного процесса отражается на другом.
Кроме того, желчь выполняет функцию выведения гормонов и токсинов. Если её отток нарушен:
– Нарушается выведение избытка эстрогенов – повышается риск пролиферативных заболеваний (например миом, кист, эндометриоза), так как большая часть эстрогенов выводится именно с желчью.
– Задерживаются метаболиты кортизола – проявляется повышенная тревожность, склонность к психоэмоциональному напряжению, формируется типичный "желчный" психотип.
Мутация гена UGT1A1 и связанное с ней снижение активности глюкуронозилтрансферазы являются ведущим фактором в регуляции желчеоттока и обменных процессов. Нарушение желчеотделения постепенно превращается в замкнутый круг: оно усиливает дефициты нутриентов, перегружает печень и замедляет процессы детоксикации. При этом стандартные методы диагностики далеко не всегда фиксируют происходящие изменения. Даже при наличии характерных жалоб и внешних проявлений нарушения желчеоттока результаты ультразвукового исследования печени и желчевыводящих путей могут выглядеть вполне нормальными. Так возникает противоречие: пациент продолжает испытывать симптомы и видеть их отражение во внешности, тогда как врачи уверенно сообщает о полном здоровье.
На иллюстрации ниже показана типичная сцена: уставший и обеспокоенный пациент рядом с довольным врачом, уверенно демонстрирующим «нормальное» УЗИ печени.
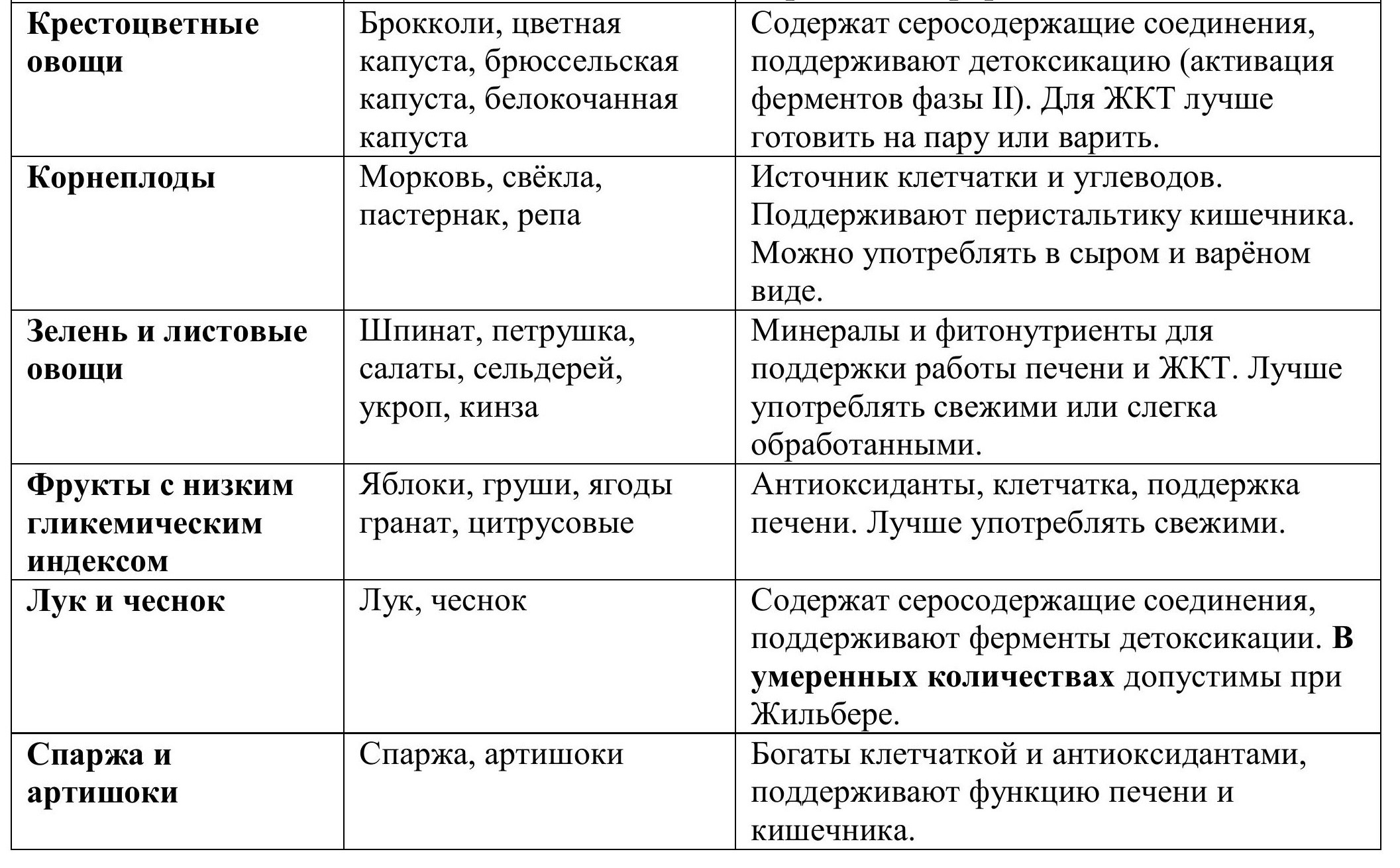
Рисунок №6 «Расхождение между симптомами и данными УЗИ при синдроме Жильбера»
Глава 4. Синдром Жильбера: Эволюционные преимущества
Синдром Жильбера (СЖ) – одно из наиболее распространённых наследственных состояний. Официальные данные подтверждают его высокую распространённость: среди европейцев частота встречаемости составляет 2–5%, среди азиатов – около 3%, среди африканцев – до 15-20%. В России, по данным некоторых исследований, синдром Жильбера выявляется у каждого седьмого россиянина, что составляет около 14% населения.
В моей практике складывается впечатление, что таких людей ещё больше. Но важно уточнить: ко мне редко обращаются совершенно здоровые пациенты исключительно ради профилактики. Чаще это люди, уже столкнувшиеся с хронической усталостью, нарушениями пищеварения или эмоциональной нестабильностью. И в этой выборке действительно создаётся ощущение, что синдром Жильбера встречается повсеместно. Практически каждый второй пациент, с которым я работаю, оказывается либо носителем мутации, либо имеет её в полной форме с выраженными проявлениями. Жильбериков действительно много, и подобная распространённость не случайна: у этого явления есть своё эволюционное объяснение.
Почему данная мутация закрепилась в процессе эволюции?
На первый взгляд, наличие синдрома Жильбера кажется маловыгодным: нарушение работы фермента уридиндифосфат-глюкуронозилтрансферазы (UGT1A1) приводит к повышению билирубина и снижает эффективность детоксикации. Однако, если углубиться в биохимию и учесть условия, в которых формировался человек как вид, становится понятно, что это состояние имело ряд преимуществ, важных для выживания.
Эволюция закрепляет те признаки, которые повышают шансы на выживание в условиях среды. В доиндустриальную эпоху ключевыми факторами угрозы были инфекции, воспалительные процессы и травмы. Организм нуждался в мощной системе защиты от окислительного стресса и свободных радикалов. Здесь и вступал в игру билирубин.
Потенциальные эволюционные преимущества синдрома Жильбера:
1. Антиоксидантные свойства билирубина:
Билирубин является мощным эндогенным антиоксидантом, способным эффективно нейтрализовать свободные радикалы и останавливать цепные реакции перекисного окисления липидов. Исследования показали, что по эффективности он превосходит многие известные антиоксиданты, включая витамин Е. Билирубин действует в паре с ферментом биливердинредуктазой, создавая цикл восстановления, который позволяет ему многократно участвовать в обезвреживании активных форм кислорода. Это снижает риск окислительного повреждения тканей, особенно в условиях инфекций, воспалений и острого стресса, и могло давать носителям СЖ эволюционное преимущество, увеличивая их выживаемость [10].
2. Противовоспалительное и иммуномодулирующее действие:
Билирубин способен снижать активность воспалительных процессов и предотвращать чрезмерную активацию иммунной системы. Механизм этого действия связан с его влиянием на ключевые сигнальные пути воспаления. В частности, билирубин подавляет активацию NF-κB – одного из главных регуляторов воспалительного ответа, а также снижает экспрессию провоспалительных цитокинов, таких как TNF-α и IL-6. Кроме того, билирубин активирует антиоксидантный путь Nrf2, что способствует снижению окислительного стресса и дальнейшему контролю воспаления. Эти свойства особенно важны при хронических инфекциях и аутоиммунных состояниях, где чрезмерная иммунная активность может нанести вред организму [11].
3. Снижение риска сердечно-сосудистых заболеваний:
Установлено, что люди с синдромом Жильбера имеют значительно более низкий риск развития атеросклероза и ишемической болезни сердца. Это связано с антиоксидантным действием билирубина, который препятствует окислению липидов и образованию атеросклеротических бляшек в сосудах. В эпоху, когда рацион человека был беден антиоксидантами, а доступ к растительной пище и витаминам был ограничен, такая встроенная защита оказывалась важным эволюционным преимуществом, помогая сохранять здоровье сосудов и снижать риски преждевременной смертности от сердечно-сосудистых заболеваний [12].
4. Более высокая устойчивость к инфекциям:
Некоторые исследования показывают, что билирубин обладает выраженной противовирусной активностью. В частности, он способен снижать репликацию вирусов, таких как вирус простого герпеса и энтеровирусы, активируя защитные клеточные механизмы, включая выработку оксида азота и ключевых сигнальных путей. В условиях, когда у предков не было доступа к антибиотикам и противовирусным средствам, такие природные механизмы защиты были критически важны для выживания [13].
5. Потенциальное влияние на продолжительность жизни:
Наблюдения и исследования всё чаще подтверждают: синдром Жильбера – это не просто доброкачественная особенность обмена веществ, а потенциальное биологическое преимущество. Люди с этим синдромом, имея умеренно повышенный уровень билирубина, демонстрируют признаки здорового старения и реже сталкиваются с заболеваниями, связанными с хроническим воспалением. Билирубин, обладая выраженной антиоксидантной активностью, защищает клетки организма от окислительного стресса – ключевого фактора преждевременного старения и развития так называемых «болезней цивилизации».
Влияние билирубина на организм выходит за рамки простой антиоксидантной защиты. Исследования показывают, что он активно участвует в регуляции клеточных процессов, поддерживая баланс между воспалением, метаболизмом и иммунным ответом. Такой комплексный эффект объясняет, почему при синдроме Жильбера наблюдается снижение рисков сердечно-сосудистых, аутоиммунных и нейродегенеративных заболеваний [14].
6. Психоэмоциональная чувствительность как социально-поведенческое преимущество.
Наряду с биохимическими особенностями, у людей с синдромом Жильбера часто отмечается повышенная психоэмоциональная чувствительность. Склонность к тревожности, настороженности и более интенсивному переживанию стресса не стоит рассматривать только как уязвимость – в эволюционном контексте это могло быть адаптивным механизмом. Такие особенности помогали быстрее реагировать на потенциальные угрозы, быть осторожнее при принятии решений и внимательнее к изменениям внешней среды. В условиях первобытных сообществ это превращало носителей синдрома в своеобразных «детекторов опасности», чья бдительность могла сохранять жизнь не только им самим, но и всему племени.
Пока прямых исследований, связывающих синдром Жильбера с психическими преимуществами, не проведено. Однако, если опираться на модели эволюционного поведения и наблюдения за носителями, становится очевидным, что именно их настороженность, умение быстрее уловить изменения в окружающей среде и чувствовать эмоциональное состояние группы выполняли защитную социально-поведенческую функцию.









