
Полная версия
Гемопоэтическая стволовая клетка в патогенезе болезней цивилизации, ее диагностические возможности и биотерапевтический потенциал
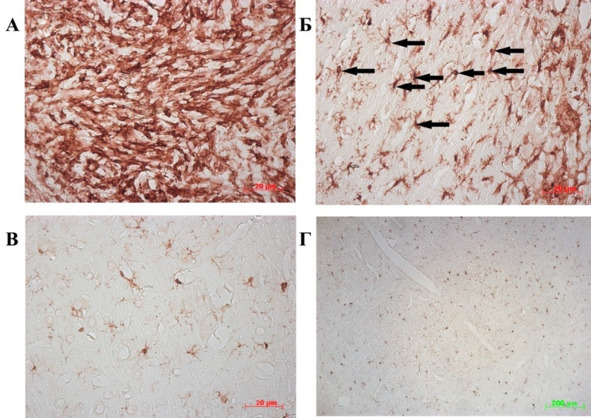
Рис. 35.⠀Распределение микроглии в мозге животных контрольной группы на 15—20 сут. развития опухоли. Иммуногистохимическая реакция на антитела к специфическому белку микроглии (макрофагов; IBA1), 15 сут. с момента начала эксперимента. А – центр; Б – ткань мозга, непосредственно прилегающая к опухоли; видны клетки активированной микроглии с телами амебоидной формы и короткими отростками (указаны стрелками); В, Г – ткань противоположного опухоли головного мозга на 15-е (В) и 20-е (Г) сутки. Видны единичные IBA1-позитивные клетки
С 20-го по 30-й дни количество микроглиальных клеток в области опухолевого узла уменьшалось. В центре опухоли микроглиоциты уплотнялись, смещаясь к периферии, за счет чего зоны разрежения чередовались с участками скопления IBA1-позитивных клеток, как правило окружающих кровеносные микрососуды. В участках перивазального скопления микроглиоциты округлой и амебоидной формы формировали плотные ряды, окружающие зоны некроза. Значительное количество микроглиоцитов было локализовано вдоль границ опухолевого очага (рис. 36 А—В).
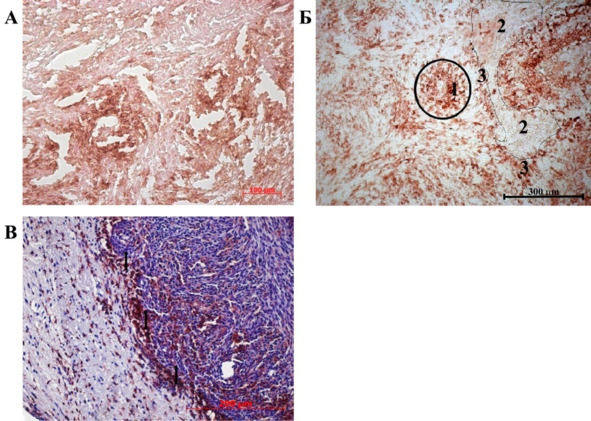
Рис. 36.⠀Распределение IBA1-ИР клеток в мозге животных контрольной группы на 25—30 сут. развития опухоли. А – неоднородное распределение IBA1-ИР микроглиоцитов в очагах некроза и участках активного роста опухоли; Б – концентрация IBA1-ИР вокруг кровеносного сосуда (обведены в круг) и зоны запустения (обведены маркерным карандашом), окруженные псевдопалисадными структурами (3); В – граница неопластического очага в мозге крыс контрольной группы. IBA1-ИР клетки образуют плотную кайму (1) на границе неопластического очага. 30-й день эксперимента. Дополнительная окраска гематоксилин-эозином
При этом значительно возрастало количество клеток микроглии за пределами опухолевого очага и локализующихся в противоположной гемисфере, что, очевидно, связано с миграцией этих клеток в опухолевый очаг.
К 30 сут. микроглиальные клетки практически не обнаруживались в ткани опухолевого узла и были сосредоточены в виде плотной каймы на границе опухоли с тканью мозга (рис. 36 В). Следуя за клетками глиомы, инфильтрирующими ткань мозга, основная масса микроглии локализовалась в дистрофически измененной паренхиме, окружающей опухолевый очаг. Очевидно, подобная картина обусловлена сложными, специфическими взаимоотношениями микроглии с опухолевыми клетками, в т.ч. с ОСК, что связано с секрецией опухолевыми клетками и микроглией цитокинов, поскольку секреторная функция микроглии в данном случае имеет решающее значение. Динамика числа IBA1-позитивных клеток на различных сроках развития опухоли в контрольной группе представлена на рис. 37.
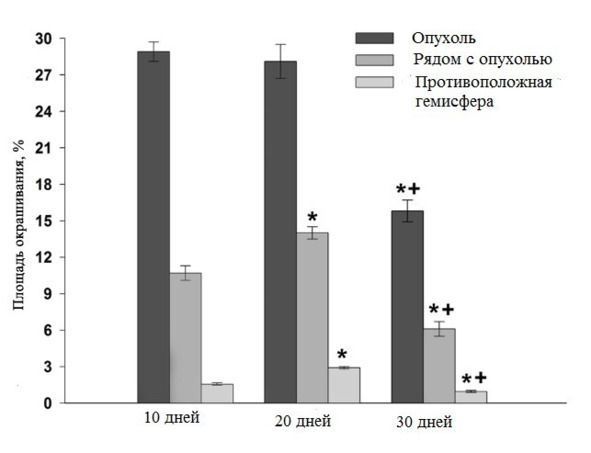
Рис. 37.⠀Динамика числа IBA1-иммунореактивных (ИР) клеток в ткани глиомы С6 у крыс контрольной группы в ходе эксперимента. По оси ординат – количество ИР клеток в поле зрения. Данные представлены в виде М ± s.e.m., n = 30 для каждой группы. Знаком * указаны достоверные (p <0,05) отличия количества IBA1-ИР клеток рядом с опухолью и в тканях противоположной гемисферы, знаком *+ – различие в количестве IBA1-ИР клеток по всем точкам эксперимента между 20 и 30 сут.
На 20-е сут. эксперимента у крыс контрольной группы GFAP-позитивные звездчатые клетки концентрировались вокруг опухолевого очага, образуя контур, конгруэнтный зоне опухолевой инвазии (рис. 38 А), и практически не обнаруживались в неопластической ткани (рис. 38 Б). Подобная морфологическая картина сохранялась к 30 сут., однако группировка GFAP-позитивных астроцитов становилась более плотной и компактной (рис. 38 В, Г). GFAP-ИР клетки окружали зону инвазии и отсутствовали в опухолевой ткани. При более предметном морфологическом исследовании тканей мозга крыс контрольной группы GFAP-ИР клетки с телом звездчатой формы с активно ветвящимися отростками образовывали скопления вдоль опухолевого очага и, очевидно, контактировали друг с другом (рис. 38 Д, Е), формируя барьер, противодействующий инвазивному процессу. При этом в ткани мозга противоположного полушария были обнаружены только единичные GFAP-позитивные клетки. При анализе рис. 36 и 38 становится очевидным, что, двигаясь навстречу друг другу, микро- и макроглия стремится отграничить зону инвазии с двух сторон, что проявляется не только в виде локальных перестроек непосредственно на границе опухоли, но и в ткани мозга в целом.
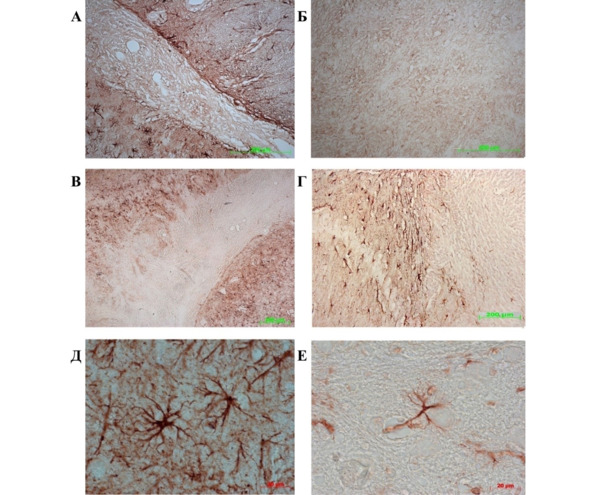
Рис. 38.⠀Иммуноцитохимическая реакция на антитела к GFAP у крыс контрольной группы. А – край опухоли в мозге контрольных крыс, 20 сут.; Б – ткань опухоли в мозге контрольных животных, 20 сут.; В – опухоль в мозге крыс контрольной группы, 30 сут.; Г – край опухолевого очага в мозге крыс группы контрольной группы, 30 сут.; Д – скопление GFAP-ИР клеток рядом с опухолью, 30 сут.; Е – единичные GFAP-ИР клетки в мозге контрольных крыс в ткани мозга противоположного полушария
На 30 сут. после формирования опухоли участки перифокальной инвазии, содержащие максимальное скопление клеток микро- и макроглии (о чем будет сказано ниже) активно окрашивались антителами к нестину, CXCR4 и TGF-β1 (рис. 39). Нестин принято считать одним из ключевых маркеров нейральных стволовых и прогениторных клеток. Как было указано выше, абсолютное большинство клеток глиобластомы, использованных в эксперименте, окрашивались антителами к этому белку, что служит признаком низкой степени дифференцировки и высокой агрессивности опухолевых клеток.
Ряд авторов относит нестин к одному из маркеров ОСК злокачественных глиом. Скопление нестин-позитивных клеток в области инвазивного роста свидетельствует об их прямом участии в этом процессе. Заслуживает внимание скопление в данном участке клеток, позитивных в отношении CXCR4-антигена. Этот цитоплазматический маркер локализован на поверхности стволовых клеток всех типов и играет ведущую роль в механизмах их миграции в опухолевый очаг. Присутствие маркера CXCR4 может означать наличие в области инвазивного роста нейральных стволовых клеток, мигрировавших из герминативных зон мозга.
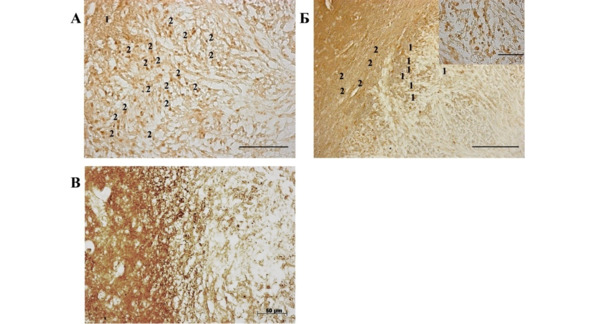
Рис. 39.⠀Край опухоли в мозге крыс контрольной группы, 30 сут. эксперимента. А – иммуноцитохимическая реакция на антитела к белку стволовых клеток нестину. Нестин-позитивные клетки локализуются как на краю очага глиомы (1), так в области инвазии (2) неопластических элементов в вещество мозга. Масштаб 200 мкм; Б – иммуноцитохимическая реакция на рецепторный белок CXCR4. Клетки, несущие этот рецептор, а следовательно, мигрировавшие, локализуются как в области инвазии (1 – показаны на вставке), так и на периферии неопластической ткани (2). Масштаб 100 мкм, вставка 200 мкм; В – иммуноцитохимическая реакция на TGF-β1. Скопление белка выявлено вдоль границы зоны инвазии
Вместе с тем данный маркер локализован и на поверхности раковых или опухолевых стволовых клеток глиобластомы, что может свидетельствовать как об их прямом участии в механизмах инвазии при взаимодействии с микроглией, так и о взаимодействии с мигрировавшими сюда стволовыми клетками других типов, несущих на поверхности рецептор CXCR4. Кроме того, CXCR4 является компонентом клеточной мембраны микроглиальных клеток, привлекаемых опухолью. Вероятно, микросреда, создаваемая ОСК, селективно активирует микроглию М2-фенотипа, которая содействует процессам опухолевого роста и инвазии.
Особого внимания заслуживает скопление в данной области клеток, секретирующих TGF-β1 – лиганд, который запускает процесс эпителиально-мезенхимального перехода в опухолевых клетках и способствует обретению ими локомоторного фенотипа. Опубликованы данные о том, что TGF-β может вызывать метастазы и прогрессию опухолевого процесса по аутокринному механизму. TGF-β интенсифицирует пролиферацию клеток МГБ и усиливает процессы инвазии. Описана способность этого лиганда активизировать такие каскады, как Notch и Sonic Hedgehog, в раковых клетках; кроме того, сигнальный домен TGF-β идентифицирован на поверхности ОСК глиобластомы и гемопоэтических стволовых клеток.
Анализируя данные локализации ряда маркеров в опухоли животных контрольной группы, необходимо отметить, что высокая скорость пролиферации клеток МГБ является главной составляющей неопластического процесса. К 20-му дню эксперимента скорость пролиферации клеток опухоли начинает опережать темпы ангиогенеза, что формирует гипоксическую микросреду. Роль гипоксии весьма многогранна. Гипоксия является главным фактором экспрессии генов, ответственных за биосинтез цитокинов, инициирующих процессы миграции в опухоль соматических и стволовых клеток. Главная роль в этом процессе принадлежит хемокину семейства CXC – фактору стромальных клеток (SDF-1α). Лиганд выделяется в ответ на гипоксическое повреждение тканей и активно привлекает в зону неоплазии стволовые клетки. В литературе описаны сложные секреторные ансамбли, образуемые ОСК со стволовыми и дифференцированными клетками других типов (Lourenco et al., 2015).
Например, клетки МГБ продуцируют колониестимулирующий фактор. Допустимо предположить (Revoltella et al., 2012), что синтез этого лиганда является ответом на суровые условия гипоксии, формируемые благодаря высокой скорости пролиферации клеток злокачественной глиомы. Гранулоцитарный колониестимулирующий фактор мобилизует стволовые клетки из депо в костном мозге (Sainathan et al., 2008), и они мигрируют в опухолевый очаг, что позволяет глиоме их рекрутировать, вовлекая в секреторные ансамбли, модерируемые ОСК, индуцировать синтез трансформирующего фактора роста β1, роль которого представляется весьма неоднозначной.
Таким образом, клетки глиомы С6 при имплантации в мозг быстро запускают пролиферативные процессы и формируют гипоксическую микросреду, индуцируют процессы направленной миграции различных типов соматических и стволовых клеток. Значительную часть привлекаемых опухолью клеток составляют микроглиоциты. Локальное скопление клеток, имеющих иммунофенотипические признаки ОСК на границах опухоли, сопровождается повышенной продукцией в этих областях TGF-β1.
Группа «клетки»
Средняя продолжительность жизни крыс группы «клетки» составила 41 ± 6,8 дня, что больше подобного показателя в контрольной группе. Средний объем опухолевого узла в мозге этих животных составил 197 ± 14,2 мм3. В отличие от контрольной группы, темп нарастания неврологических симптомов был медленным, крысы длительно сохраняли активность. На 20 сут. отмечено появление птоза на стороне опухоли, снижение рефлексов на сгибание и переворачивание, дискоординация между передними и задними конечностями. К 30—40 сут. эксперимента крысы становились вялыми и заторможенными, реагировали на прикосновение к вибрисам пронзительным визгом, при выкладывании на спину не могли перевернуться. По мере нарастания симптоматики до комы животные выводились из эксперимента.
На 10-й день наблюдения морфологическая картина не обнаруживала существенных отличий от контрольной группы. Однако к 30 сут. признаки некроза в центре опухолевого узла в группе «клетки» были выражены в существенно меньшей степени (рис. 40).
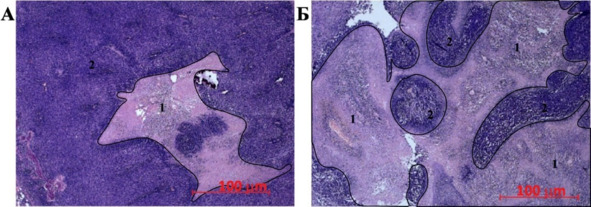
Рис. 40.⠀Неопластическая ткань в мозге крыс сравниваемых групп, 30 сут. эксперимента. А – группа клетки: 1 – область некроза (выделена маркером), 2 – активно растущая опухолевая ткань; Б – опухолевая ткань в мозге крыс контрольной группы: 1 – обширные зоны некроза (выделены маркером), 2 – фрагменты сохранной опухолевой ткани. Окраска гематоксилин-эозином
Данные сравнительной оценки площади некрозов в неопластической ткани крыс контрольной группы и группы «клетки» представлены на рис. 41.
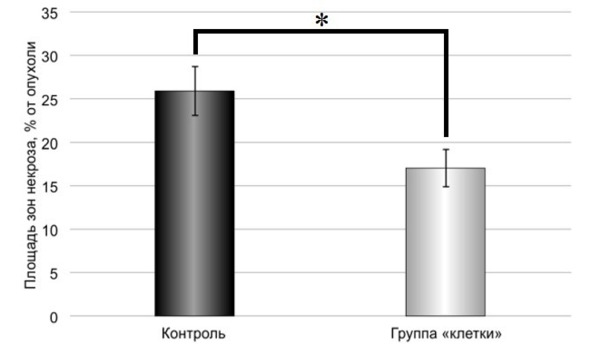
Рис. 41.⠀Суммарная площадь некрозов в опухолевой ткани из головного мозга животных сравниваемых групп. По оси абсцисс: площадь зон некроза, % от суммарной площади микропрепаратов; М ± s.e.m., n = 30 для каждой группы. Знаком * показаны достоверные отличия (p <0,05) группы «клетки» от контроля
Помимо этого, опухолевая ткань из мозга крыс группы «клетки» содержала многочисленные инфильтраты в виде клеток округлой или овальной формы с эксцентрично расположенным несегментированным ядром. Локализация этих инфильтратов частично соответствовала зонам некроза опухолевой ткани, при этом они практически отсутствовала в участках инвазии неопластических клеток в паренхиму мозга (рис. 42). Нельзя исключить, что в составе данных образований присутствуют трансплантированные ГСК, которые мигрировали в опухолевую ткань и накапливались в участках максимальной гипоксии.
Сравнение результатов иммуногистохимической реакции на антитела к PCNA свидетельствовало о некотором усилении процессов пролиферации в области опухолевого узла к 30-му дню эксперимента по сравнению с контрольной группой (рис. 43 А, Б), что, вероятно, было связано с трансформацией мигрировавших сюда ГСК. Подобная динамика сохранялась в группе «клетки» между 30—35 сут. эксперимента (рис. 43 В).
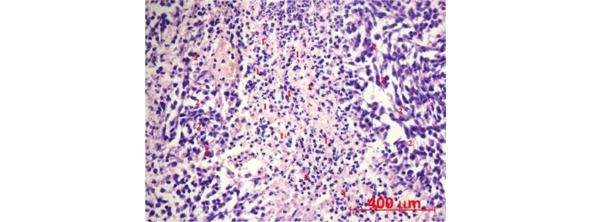
Рис. 42.⠀Инфильтраты в зонах разряжения и некроза опухолевой ткани у крыс группы «клетки». Размер инфильтрирующих клеток (1) существенно меньше клеток (2) опухоли. Окраска гематоксилин-эозином
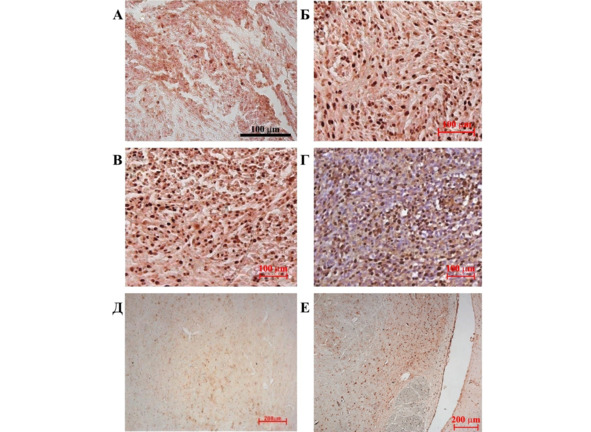
Рис. 43.⠀Неопластическая ткань в мозге экспериментальных животных. Иммуногистохимическая реакция на PCNA. А – контрольная группа, 30 сут.; Б – группа «клетки», 25 сут.; В – группа «клетки», 30 сут., масштаб 100 мкм; Г – группа «клетки», 30 сут., дополнительная окраска гематоксилин-эозином; Д – противоположная сторона полушария контрольных животных; Е – противоположная сторона полушария группы «клетки»
На рис. 44 представлены сравнительные данные о количестве PCNA-ИР клеток у животных контрольной и получивших трансплантацию ГСК групп.
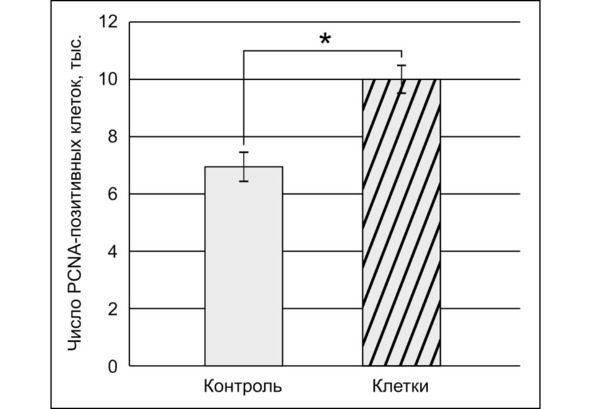
Рис. 44.⠀Соотношение числа PCNA-ИР клеток в опухолевой ткани глиомы С6 в мозге крыс при введении ГСК. По оси ординат – количество (тыс.) ИР клеток на микропрепаратах для каждой точки. Указаны М ± s.e.m., n = 30 для каждой группы; * – достоверные данные (p <0,05) в количестве PCNA-ИР между группами
Важно отметить, что усиление пролиферации наблюдалось именно в опухоли, а вне очага глиомы встречаются только единичные PCNA-ИР клетки, сосредоточенные в кровеносных сосудах или участках мозга, подвергшихся инфильтрации опухолевыми клетками. В противоположном опухоли полушарии мозга крыс контрольной группы такие клетки практически отсутствовали. В свою очередь, у крыс, получивших трансплантацию ГСК в ткани мозга на противоположные полушария, было отмечено транзиторное увеличение PCNA-ИР элементов.
Вероятно, увеличение числа PCNA-позитивных клеток в очаге обусловлено пролиферацией мигрирующих в опухоль ГСК. В пользу данного утверждения свидетельствует резкое увеличение к 30 сут. наблюдения в опухолевой ткани крыс группы «клетки» количества микроглиоцитов (рис. 45).
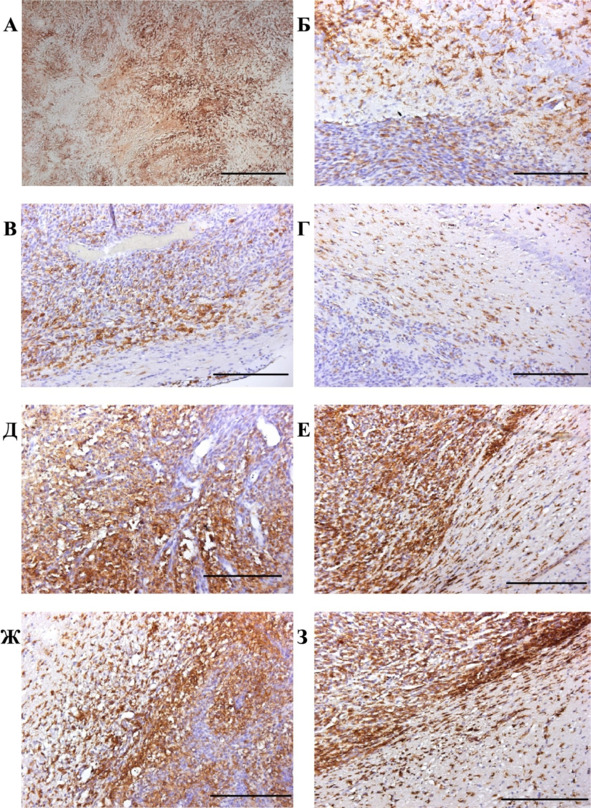
Рис. 45.⠀Иммуногистохимическая реакция на антитела к специфическому белку IBA1. А—Г, контрольная группа: А – центр опухоли, 30 сут.; край опухоли: Б – 10 сут., В – 20 сут., Г – 30 сут. Д—З, группа «клетки»: Д – центр опухоли, 30 сут.; край опухоли: Е – 10 сут., Ж – 20 сут., З – 30 сут. Дополнительная окраска гематоксилин-эозином. Масштаб 200 мкм
Скопления IBA1-позитивных клеток выявлялись в дистрофически измененных участках мозга, непосредственно прилегающих к опухоли и максимально подверженных инвазии, и при этом практически отсутствовали в кровеносных сосудах. Количество IBA1-ИР микроглиальных клеток в паренхиме мозга на противоположном полушарии головного мозга у крыс группы «клетки» не имело достоверных различий по сравнению с контролем (рис. 46).
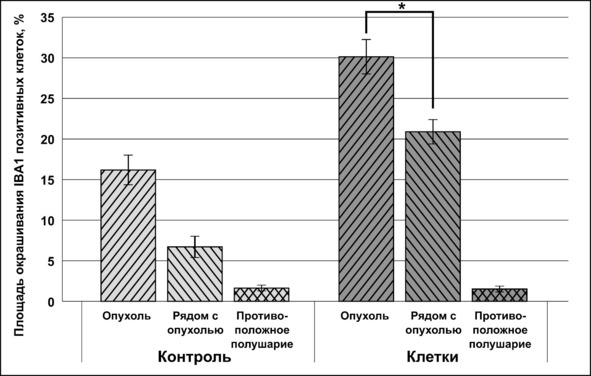
Рис. 46.⠀Сравнительная оценка распределения IBA1 в мозге животных. По оси абсцисс – доля площади окрашивания специфическими антителами от площади снимка, %. Данные представлены в виде М ± s.e.m., n = 30 для каждой группы. Знаком * отмечены достоверные отличия (p <0,05) между площадью IBA1+-ткани в опухоли и участках мозга, прилегающих к ней, в группе «клетки» от группы контроля
Микроглия (макрофаги) в этой связи заслуживает особого внимания. Данный тип клеток составляет более трети всех клеток, рекрутируемых МГБ (Fonseca et al., 2015). Известно, что примитивные макрофаги заселяют мозг на ранних этапах эмбриогенеза и поддерживают популяцию путем пролиферации, стволовые клетки костного мозга в этом процессе участия не принимают. Однако продуцируемые опухолью токсины повреждают гематоэнцефалический барьер, что делает возможным рекрутирование значительного количества моноцитов и cтволовых клеток различных типов, что оставляет возможность для их трансформации в IBA1+-клетки. Однако биологическая роль таких трансформаций достаточно неоднозначна.
Морфология GFAP-позитивной астроцитарной глии в мозге животных, получивших трансфузию ГСК, не демонстрирует на всем сроке наблюдения принципиальных отличий от животных контрольной группы. Как и в контроле, на 20 сут. GFAP-позитивные звездчатые клетки концентрировались вокруг очага опухолевой инвазии и практически не обнаруживались в неопластической ткани. К 30 сут. группировка GFAP-позитивных астроцитов становилась более плотной, однако эти клетки также отсутствовали в опухолевой ткани. При этом у крыс двух сравниваемых групп в ткани мозга противоположного полушария были обнаружены только единичные GFAP-позитивные клетки.
При анализе влияния трансплантированных ГСК на опухолевый очаг наше внимание привлекло изменение количества висфатина и эндотелина-1 в очаге глиомы (рис. 47). Висфатин – фермент, который лимитирует скорость биосинтеза NAD, что играет важную роль в энергетическом метаболизме. В клетках глиомы потребность в NAD существенно выше, чем в нормальных клетках ЦНС, при этом степень злокачественности МГБ коррелирует с высокими концентрациями этого агента (Reddy et al., 2008). Висфатин вовлечен в процессы гомеостаза, блокирует процессы апоптоза, стимулирует выживание клеток, обеспечивает накопление висцерального жира, задействован в механизмах нейропротекции и вовлечен в нейрогенез. Данное вещество является аналогом инсулина; биологические эффекты висфатина проявляются в оптимизации процесса утилизации глюкозы, что весьма актуально в условиях ишемии. Однако спектр биологических эффектов этого лиганда намного шире.
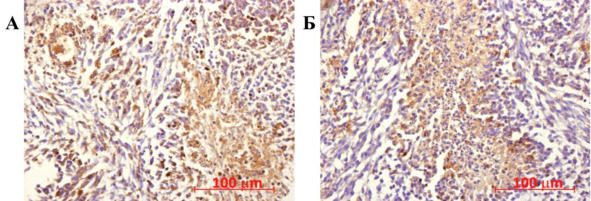
Рис. 47.⠀Распределение висфатина в опухолевой ткани крыс контрольной группы (А) и группы «клетки» (Б). Иммуногистохимичесакя реакция на висфатин. Докраска гематоксилин-эозином
В опухолевых клетках висфатин стимулирует пролиферацию, миграцию, ангиогенез, ремоделирование ВКМ. В очаге глиомы основным источником висфатина являются опухолевые клетки. Он также способен индуцировать процессы миграции НСК, ГСК и высокодифференцированных клеток, стимулируя в очаге продукцию MCP-1 и EGF-2. В моноцитах и макрофагах висфатин стимулирует секрецию интерлейкина-6 и -8, а также TNF-α. Соотношение площади окрашивания опухолевой ткани у крыс сравниваемых групп представлено на рис. 48.
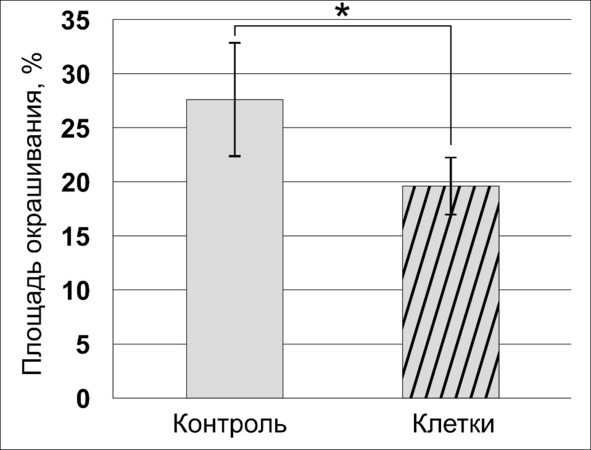
Рис. 48.⠀Суммарная площадь окрашивания опухолевой ткани антителами к висфатину, 30 сут. По оси абсцисс – площадь окрашивания, % от суммарной площади. Данные представлены в виде М ± s.e.m., n = 30 для каждой группы
Как следует из представленных данных, тенденция к снижению продукции висфатина является одним из биологических эффектов ГСК. Это утверждение становится очевидным на фоне уменьшения размеров опухолевого узла и увеличения выживаемости экспериментальных животных, а также обнаруженного в данном исследовании увеличении количества эндотелина-1 в опухолевом очаге (рис. 49, 50).
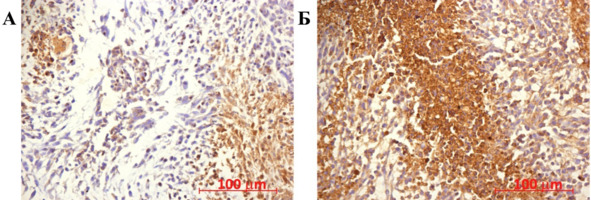
Рис. 49.⠀Иммуногистохимическая реакция на антитела к эндотелину-1. Неопластическая ткань мозга крысы группы «клетки», 30 сут. эксперимента. Дополнительная окраска гематоксилин-эозином
Будучи вазоактивным пептидом и мощным вазодилататором с противовоспалительным действием, эндотелин-1 обладает цитостатическими свойствами, конечные эффекты этого лиганда определяются его концентрацией и зависят от локального микроокружения.
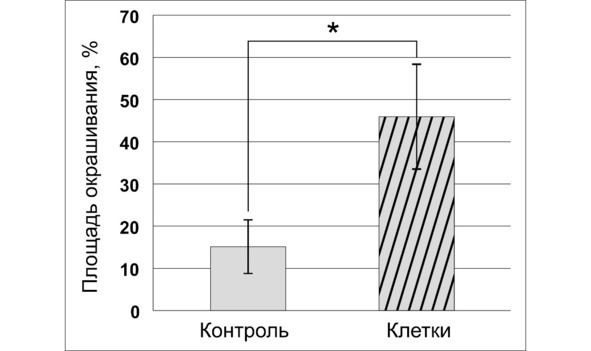
Рис. 50.⠀Суммарная площадь окрашивания опухолевой ткани антителами к эндотелину-1, 30 сут. По оси ординат – площадь окрашивания, % от суммарной площади микропрепаратов. Сравниваемые данные представлены в виде М ± s.e.m., n = 30 для каждой группы. Знаком * показаны достоверные (p <0,05) отличия сравниваемых значений в группе «клетки» от контроля
В ходе иммуногистохимической характеристики опухолевых узлов мозга крыс с глиомой С6, получивших трансплантацию ГСК, наше внимание привлекли изменения в площади окрашивания опухолевой ткани антителами к TGF-β1 у животных сравниваемых групп. Препараты опухолевой ткани мозга крыс контрольной группы активно окрашивались антителами к этому лиганду, при этом TGF-β1 был довольно равномерно распределен как в центре, так и на периферии опухоли. Данное распределение TGF-β1 в опухолевой ткани крыс, получавших трансплантацию ГСК, сохранялось до 20—30 сут. эксперимента (рис. 51).
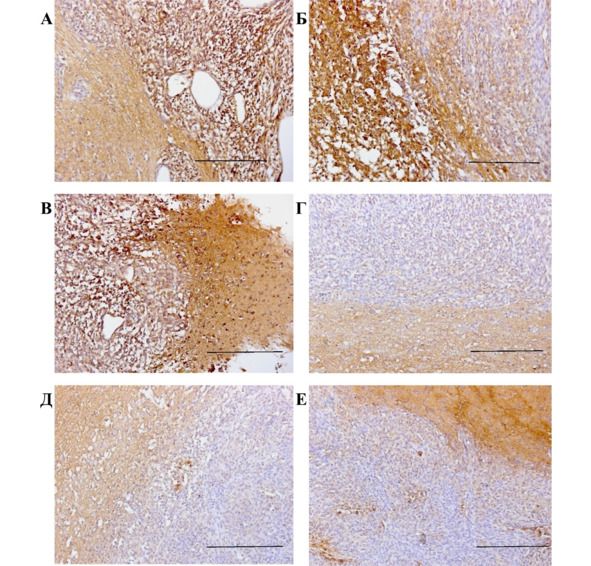
Рис. 51.⠀Ткань опухоли из мозга крыс, 30 сут. Иммуногистохимическая реакция на антитела к TGF-β1. Препарат дополнительно окрашен гематоксилин-эозином. Масштаб 100 мкм. А—В – контрольная группа, маркер распределен в опухолевой ткани; Г—Е – группа «клетки», единичные включения TGF-β1
У крыс группы «клетки» к этому времени в неопластической ткани появляются многочисленные полости (рис. 51), что закономерно снижает площадь окрашивания микропрепаратов антителами к этому фактору. Весьма вероятно, что обнаруженная тенденция к сокращению площади окрашивания TGF-β1 может быть связана с воздействием микроглии (рис. 52) и проявляться на более поздних сроках эксперимента.
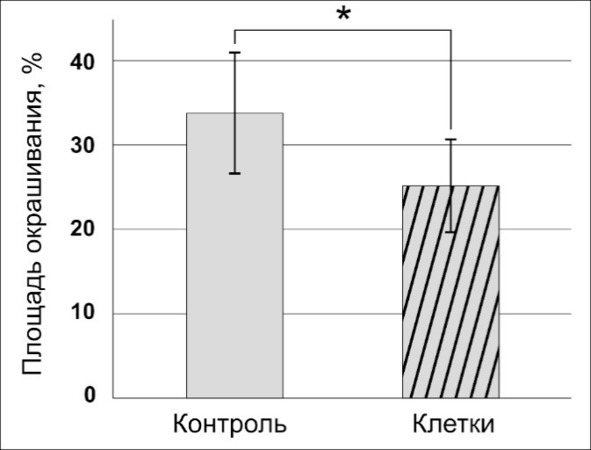
Рис. 52.⠀Сравнительное распределение иммунореактивности к TGF-β1 в опухолевой ткани крыс сравниваемых групп на 30 сут. По оси абсцисс – доля площади окрашивания специфическими антителами к общей площади снимков, %. Данные представлены в виде М ± s.e.m., n = 30 для каждой группы. Знаком * отмечены отличия (p <0,05) между площадью ткани, иммунопозитивной к TGF-β1, в центре опухоли в группе «клетки» от группы контроля
При морфологическом анализе иммуногистохимических перестроек в опухолевой ткани животных сравниваемых групп обращало на себя внимание значительное скопление на границе опухолевого очага клеток, позитивно окрашивающихся антителами к нестину (рис. 53 А) и рецепторному белку CXCR4 (рис. 53 Б). При анализе распределения нестина и CXCR4+-клеток в сравнении с рис. 37 и 38 следует отметить более плотную группировку клеток на границе неопластического очага. Экспрессия нестина и CXCR4 свойственна как опухолевым клеткам, так и нормальным нейральным и гемопоэтическим стволовым клеткам, что свидетельствует об их способности к миграции, а следовательно, к взаимодействию с клетками других типов.

