
Полная версия
Миелопролиферативные новообразования
• возраст менее 20 лет 0 баллов, 20–40 лет 1 балл, более 40 лет 2 балла;
• время от постановки диагноза до Алло-ТКМ менее 1 года 0 баллов, более 1 года 1 балл;
• HLA-идентичный сиблинг 0 баллов, другие доноры 1 балл;
• пара донор-женщина реципиент-мужчина 1 балл, 0 баллов для других сочетаний донор-реципиент.
Современное медикаментозное лечение больных ХМЛ является высокоэффективным у подавляющего большинства больных. Имеющиеся рекомендации по контролю нежелательных явлений ИТК и возможность альтернативного выбора препаратов позволяет практически полностью сохранить физическое состояние и повседневный уровень активности больного.
Для сохранения принципа максимального и постоянного воздействия на опухолевый клон важно свести к минимуму побочные эффекты терапии, учитывая небходимость длительного приема препаратов.
Побочные эффекты лечения хронического миелолейкоза и методы их коррекцииТоксичность терапии на фоне применения ИТК можно разделить на гематологическую и негематологическую. Общие рекомендации по коррекции нежелательных явлений при лечении ХМЛ приведены ниже [73].
Гематологическая токсичностьЧастым побочным эффектом лечения ИТК является снижение показателей крови. Анемия любой степени во всех фазах ХМЛ не является показанием к прерыванию терапии ИТК. Необходимо дополнительное обследование пациента для исключения других причин анемии, с учетом клинической ситуации (анализ крови на обмен железа, фолаты, витамин В12, гемолитические тесты и др.). При клинически значимых проявлениях анемического синдрома показаны заместительные трансфузии эритроцитной массы.
При нейтропении и тромбоцитопении 1–2 степени в любой фазе ХМЛ снижения дозы ИТК и перерывов в лечении не требуется. В ХФ ХМЛ при нейтропении и/или тромбоцитопении 3–4 степени показана временная отмена ИТК с контролем клинического анализа крови один раз в неделю. После восстановления абсолютного числа нейтрофилов до уровня более 1,0 × 109/л, тромбоцитов более 50 × 109/л необходимо возобновить терапию ИТК:
• если перерыв в лечении составлял менее 2 недель, то терапия возобновляется в прежней дозе, при перерыве более 2 недель – в сниженной на один уровень дозе (см. табл. 4 – дозы ИТК);
• если доза ИТК ранее была снижена, при стабильных показателях гемограммы через 1 месяц целесообразно возвращение к стандартной дозировке;
• при длительных нейтропениях возможно кратковременное применение гранулоцитарного колониестимулирующего фактора (Г-КСФ): филграстим в дозе 5 мкг/кг/сут подкожно, при отсутствии эффекта от введения Г-КСФ необходима редукция дозы или смена ИТК;
• при длительных повторных цитопениях необходимо провести обследование (миелограмма, гистологическое исследование костного мозга) с целью исключения прогрессирования заболевания, развития фиброза костного мозга.
В ФА и БК ХМЛ даже при наличии нейтропении и тромбоцитопении 3–4 степеней с целью индукции ремиссии в течение первых 4 недель терапия ИТК не должна прерываться. При тромбоцитопении 3–4 степени, геморрагическом синдроме показаны трансфузии тромбоцитного концентрата. Определенную пользу для продолжения терапии ИТК, при коррекции тромбоцитопении 3–4 степени, не обусловленной прогрессированием заболевания может принести введение агонистов рецепторов тромбопоэтина [73]. Следует отметить, что показание для использования данных препаратов в настоящее время официально не зарегистрировано и должно осуществляться только при наличии жизненных показаний для купирования тромбоцитопении с целью продолжения терапии ИТК. Если миелосупрессия сохраняется после 1 месяца терапии, то необходимо выполнение стернальной пункции с подсчетом миелограммы для исключения прогрессирования заболевания:
• при числе бластов менее 5 % и снижении клеточности костного мозга следует прервать терапию; контроль клинического анализа крови проводить не реже 1 раза в неделю; возобновить терапию после восстановления абсолютного числа нейтрофилов более 0,5х109/л и тромбоцитов более 50х109/л; при повторном возникновении миелосупрессии доза ИТК должна быть снижена; при длительных и/или повторных эпизодах нейтропении и отсутствии бластоза в периферической крови и костном мозге возможно применение Г-КСФ;
• при наличии более 5 % бластов и гиперклеточном костном мозге должен быть обсужден вопрос об изменении тактики терапии:
– при терапии иматинибом переход на терапию ИТК2;
– при терапии ИТК2 смена препарата;
– проведение другого вида терапии (химиотерапия, экспериментальное лечение).
Негематологическая токсичностьПомимо гематологической токсичности терапия ИТК может осложняться и другими побочными эффектами, связанными лишь с относительной селективностью ИТК и возможностью влияния на широкий спектр тирозинкиназ, регулирующих различные процессы жизнедеятельности организма. Наиболее частыми побочными эффектами лечения ИТК являются тошнота, рвота, диарея, задержка жидкости с развитием отеков, кожная сыпь, зуд, слабость, нарушения сна, боли в мышцах и суставах. Особенное значение данные побочные явления приобретают в связи с необходимостью постоянного приема препаратов ИТК. Даже небольшая выраженность постоянно существующих побочных эффектов может приводить к снижению приверженности к лечению (комплаентности) – пропускам приема либо снижению дозы препарата пациентами, что ведет к снижению эффективности терапии.
Общая тактика ведения больных при различных проявлениях негематологической токсичности на фоне ИТК представлена в табл. II-14. Перерывы в лечении и снижение дозы допустимы при длительных и/или повторных эпизодах токсичности 2 степени и при однократной токсичности 3–4 степени. Непереносимость терапии ИТК возможно констатировать при длительном (более 2–3 мес.) сохранении явлений токсичности 2 ст. при условии адекватной сопроводительной терапии, а также при повторных явлениях токсичности 3–4 степени. Непереносимость терапии является показанием к переводу на другой ИТК, так как профиль негематологической токсичности у препаратов разный, и перекрестная непереносимость минимальная.
Таблица II-14. Общая тактика терапии при негематологической токсичности ИТК

Одним из наиболее актуальных дополнений последних версий рекомендаций по диагностике и лечению ХМЛ является включение раздела, посвященного методике ведения пациентов ХМЛ в ремиссии без лечения (РБЛ). В этот период у пациентов с длительным глубоким молекулярным ответом (ГМО) отменяется прием препаратов – ингибиторов тирозинкиназ и больной остается только под частым молекулярным мониторингом минимальной остаточной болезни. В случае повышения уровня экспрессии BCR::ABL более порогового значения, обычно МО4,0 или БМО, таргетная терапия возобновляется.
В настоящее время уже накоплено достаточно результатов клинических исследований возможной отмены терапии у больных со стойким длительным глубоким молекулярным ответом – ведение ремиссии ХМЛ без лечения [74–77]. Успешные результаты этих исследований, в том числе подтвержденные и в отечественных работах [78], в виде сохранения ответа у большой части (39–67 %) пациентов при крайне низком риске прогрессирования заболевания сделали возможным включение данного раздела в клинические рекомендации.
Условия для включения пациентов в ХМЛ в РБЛ в соответствии с рекомендациями ELN2020 следующие [16].
• Обязательные:
– первая хроническая фаза;
– мотивированный пациент с хорошей коммуникацией;
– доступ к высококачественной ПЦР с использованием Международной шкалы (IS) с быстрым получением результатов;
– согласие пациента на более частый мониторинг после прекращения лечения, ежемесячно в течение первых 6 месяцев, каждые 2 месяца в течение 6–12 месяцев, затем каждые 3 месяца.
• Минимально допустимые:
– первая линия терапии, вторая линия только в случае непереносимости первой линии терапии;
– типичные транскрипты BCR::ABL e13a2 или e14a2;
– продолжительность терапии ИТК >5 лет (>4 лет для ИТК2);
– продолжительность глубокого молекулярного ответа (МО4.0 или лучше) >2 лет.
• Оптимальные:
– продолжительность терапии ИТК >5 лет;
– продолжительность глубокого молекулярного ответа >3 лет, если МО4.0;
– продолжительность глубокого молекулярного ответа >2 лет, если МО4.5.
Оценка возможности применения методики РБЛ в клинической практике по рекомендациям NCCN приведена в табл. II-15 [17].
Таблица II-15. Возможность применения РБЛ в клинической практике (рекомендации NCCN) [17]
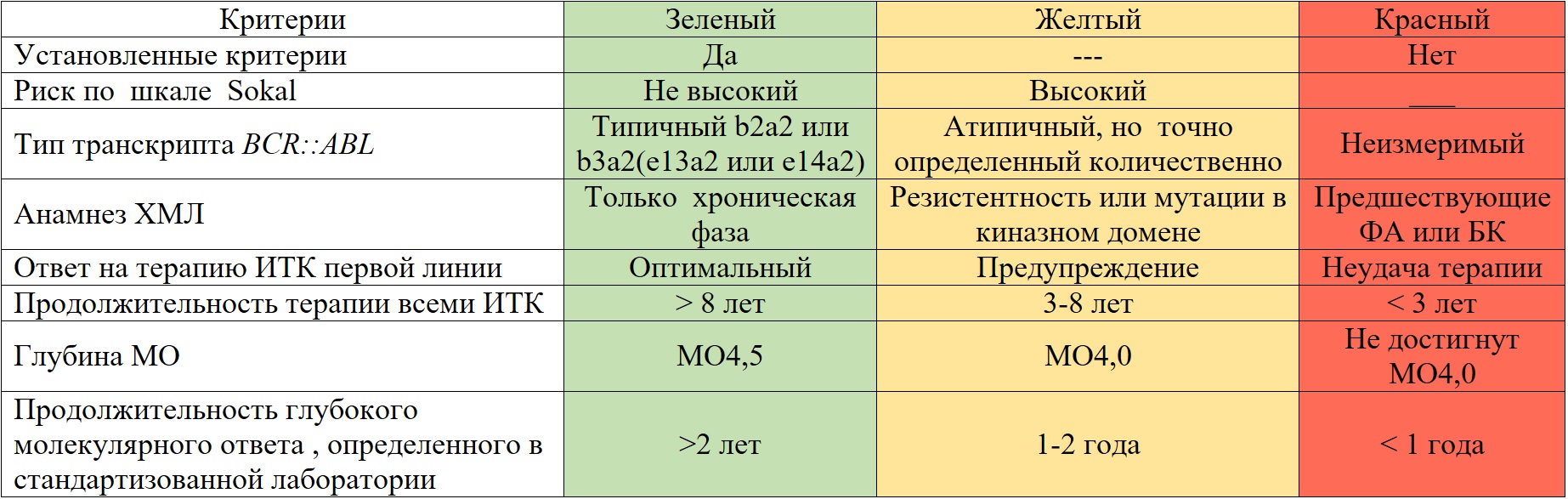
Все зеленый свет: рекомендация рассмотреть отказ от терапии ИТК.
Любой желтый свет: отказ от терапии ИТК рассмотреть только при очень значимых обстоятельствах (например, значительная токсичность или планируемая беременность.
Любой красный свет: отмена ИТК не рекомендована, исключая клиническое исследование.
Краеугольным камнем методики РБЛ является частый молекулярный мониторинг экспрессии BCR::ABL:
• ежемесячно в течение первых 6 месяцев;
• каждые 2 месяца в течение 6–12 месяцев;
• затем каждые 3 месяца.
Интересным побочным эффектом отмены терапии ИТК являются мышечные боли, наблюдающиеся у 20–30 % пациентов после прекращения приема ИТК. Предполагается, что возникновение данного побочного эффекта связано с дисбалансом цитокинов и носит временный характер. Однако выраженность болей у некоторых пациентов требовала возобновления приема ИТК.
Потеря БМО при молекулярном мониторинге, подтвержденная в двух последовательных исследованиях является показанием к возобновлению терапии тем же самым ИТК, который пациент принимал до включения в РБЛ.
Беременность и отцовствоВ соответствии с инструкциями по применению ИТК, беременность является противопоказанием к терапии. Всем пациентам, принимающим ИТК, показана эффективная контрацепция.
Пациенткам, планирующим беременность, необходимо быть информированными о потенциальном тератогенном действии иматиниба; мало изученном действии ИТК2 при беременности и описанном эмбриотоксическом действии; вероятности самопроизвольного прерывания беременности; возможности рецидива ХМЛ при отмене терапии на период беременности даже при наличии ПМО; небольшом количестве наблюдений случаев беременности при ХМЛ.
В рекомендациях ELN2020 включен раздел, посвященный беременности и отцовству больных ХМЛ [16]. Риск генотоксичности для мужчин при приеме иматиниба, нилотиниба, дазатиниба и бозутиниба признан низким, прекращения приема препаратов во время планирования отцовства не требуется.
Для женщин рекомендации по впервые выявленному ХМЛ во время беременности должны быть индивидуальными. При наличии продвинутых фаз ХМЛ – прерывание беременности. Все ИТК противопоказаны во время беременности, хотя иматиниб безопасно использовался во время второго и третьего триместра беременности.
Требования к женщинам, планирующим беременность, такие же, как и при использовании методики ремиссии без лечения. При потере БМО, но сохранении ПЦО, во время беременности имеется вероятность продолжения наблюдения до родов без необходимости возобновления лечения. Женщины, потерявшие БМО, но не забеременевшие должны возобновить лечение, возможно более активным ИТК, для достижения более устойчивого ответа для повторной попытки отмены и беременности.
У женщин, планирующих беременность и не имеющих глубокого молекулярного ответа лечение может быть заменено на интерферон-альфа или могут быть рассмотрены альтернативные методы беременности.
С терапевтической целью у пациенток с ХМЛ и беременностью могут использоваться антиагреганты (ацетилсалициловая кислота) и/или низкомолекулярные гепарины при тромбоцитозе. Лейкаферез и препараты интерферона-альфа расцениваются как относительно безопасные во время беременности. Вскармливание противопоказано при приеме ИТК.
В рамках научно-исследовательской работы нами была разработана программа диагностики и лечения ХМЛ, включающая методику РБЛ.
Особенностью разработанной программы лечения ХМЛ было использование раннего переключения между линиями таргетной терапии при отсутствии оптимального ответа на таргетную терапию.
Для оптимального ответа на первую линию терапии ИТК необходимо наличие:
• ПГО в течение первых 3 месяцев;
• ПЦО в течение первых 6 месяцев;
• БМО в течение первых 12 месяцев.
Для соответствия оптимальному ответу второй линии терапии ИТК считали необходимым достижение:
• на 3 месяца лечения раннего молекулярного ответа (BCR::ABL ≤ 10 %) и / или малого цитогенетического ответа (Ph+ <65 %, МЦО);
• на 6 месяцев лечения раннего молекулярного ответа BCR::ABL ≤ 10 % и / или частичного цитогенетического ответа (Ph+ ≤35 %, ЧЦО);
• на 1 год лечения BCR::ABL ≤ 1 % и / или полного цитогенетического ответа (Ph+ 0 %, ПЦО);
• в любое время после года терапии достижение БМО (на 3 месяца терапии достижение раннего молекулярного ответа (BCR::ABL ≤ 0,1 %).
В обычной практике смена терапии проводится при констатации неудачи терапии. Во вновь разработанной программе переключение между линиями лечения проводится при отсутствии оптимального ответа, то есть у больных с неудачей терапии и у пациентов с наличием факторов предостережения. Таким образом, доля пациентов, которым проводится смена терапии существенно увеличивается.
В общем виде разработанная программа лечения представлена на рисунке II-2.

Рисунок II-2. Программа лечения ХМЛ с методикой ведения больных в фазе ремиссии без использования ингибиторов тирозинкиназ (ремиссии без лечения).
При достижении продолжительного (не менее 3 лет) стабильного глубокого молекулярного ответа (МО4,0 и глубже) больные ХМЛ могли быть переведены в режим без лечения (РБЛ).
В этом случае лечение ИТК прекращалось и проводился мониторинг уровня BCR::ABL с момента прекращения приема ИТК по следующей схеме: в течение первых 6 месяцев 1 раз в месяц; в течение второй половины первого года (с 7-го до завершения 12 месяца) 1 раз в 1,5 месяца; затем 1 раз в 3 месяца.
При повышении относительного уровня BCR::ABL/ABL более 0,1 % терапия ИТК возобновлялась с периодическим контролем BCR::ABL не реже чем в 3 месяца до повторного достижения и подтверждения БМО, затем 1 раз в 6 месяцев при его сохранении. Нами была проведена апробация разработанной программы и фармакоэкономическая оценка её эффективности.
Всего в исследование было включено 307 пациентов с диагнозом ХМЛ. Группа сравнения (исторического контроля) состояла из 216 больных, 91 пациент был включен в группу исследования. Результаты первичной диагностики приведены в таблице II-16.
Диагностика и лечение пациентов в группе исследования проводилось по вновь разработанной программе. Всем больным после установления диагноза назначались ингибиторы тирозинкиназ: первого поколения – иматиниб 79 (87 %) пациентам и второго поколения – нилотиниб 9 (10 %) и дазатиниб 3 (3 %) больным. Для анализа эффективности таргетной терапии в группе сравнения использовались только результаты лечения пациентов, получавших ингибиторы тирозинкиназ.
Таблица II-16. Клинические показатели пациентов с ХМЛ на момент первичной диагностики
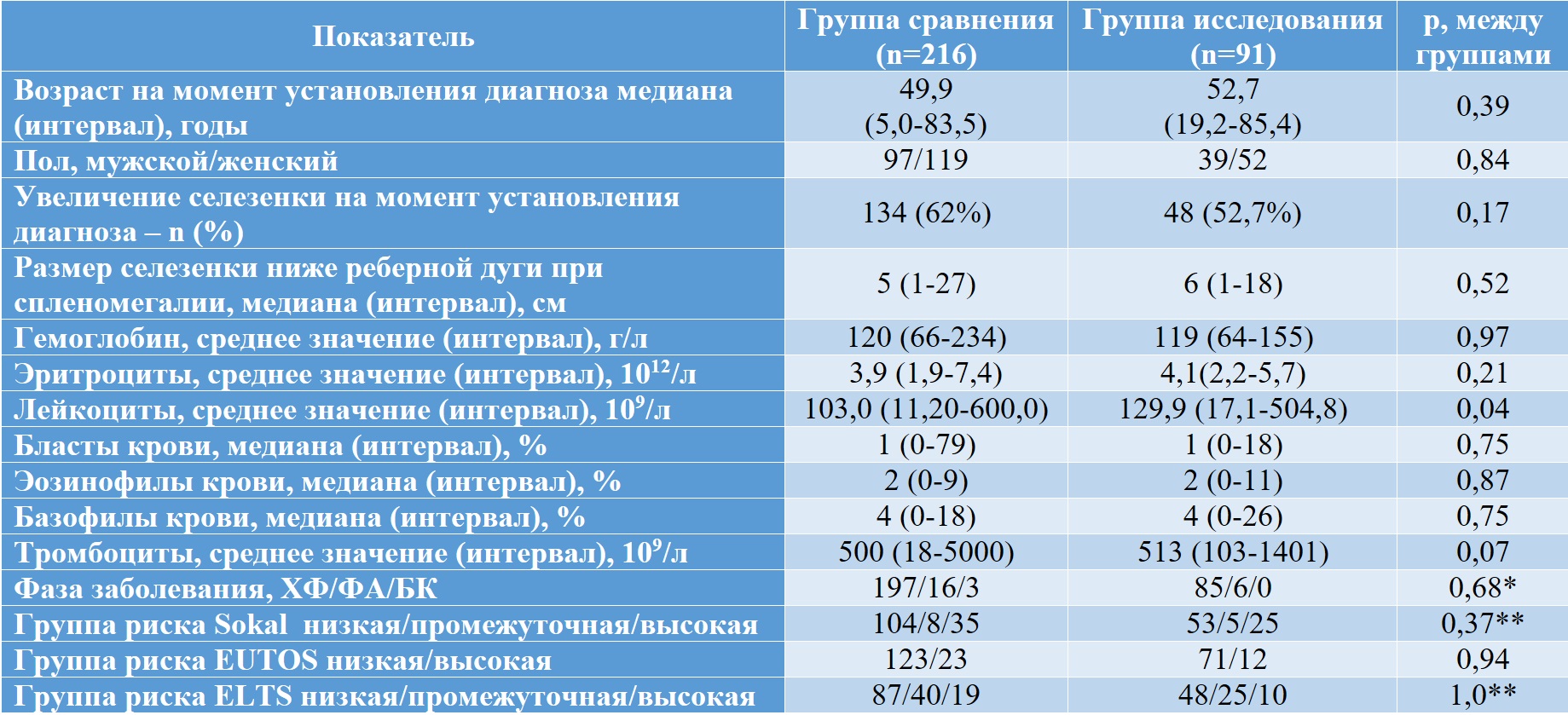
* сравнение между частотами ХФ и ФА+БК, **сравнение между частотами низкая+промежуточная и высокая
Группы пациентов значимо различались по срокам от установления диагноза до начала таргетной терапии: медиана составила 2,0 месяца для группы сравнения и 0,5 месяца для группы исследования.
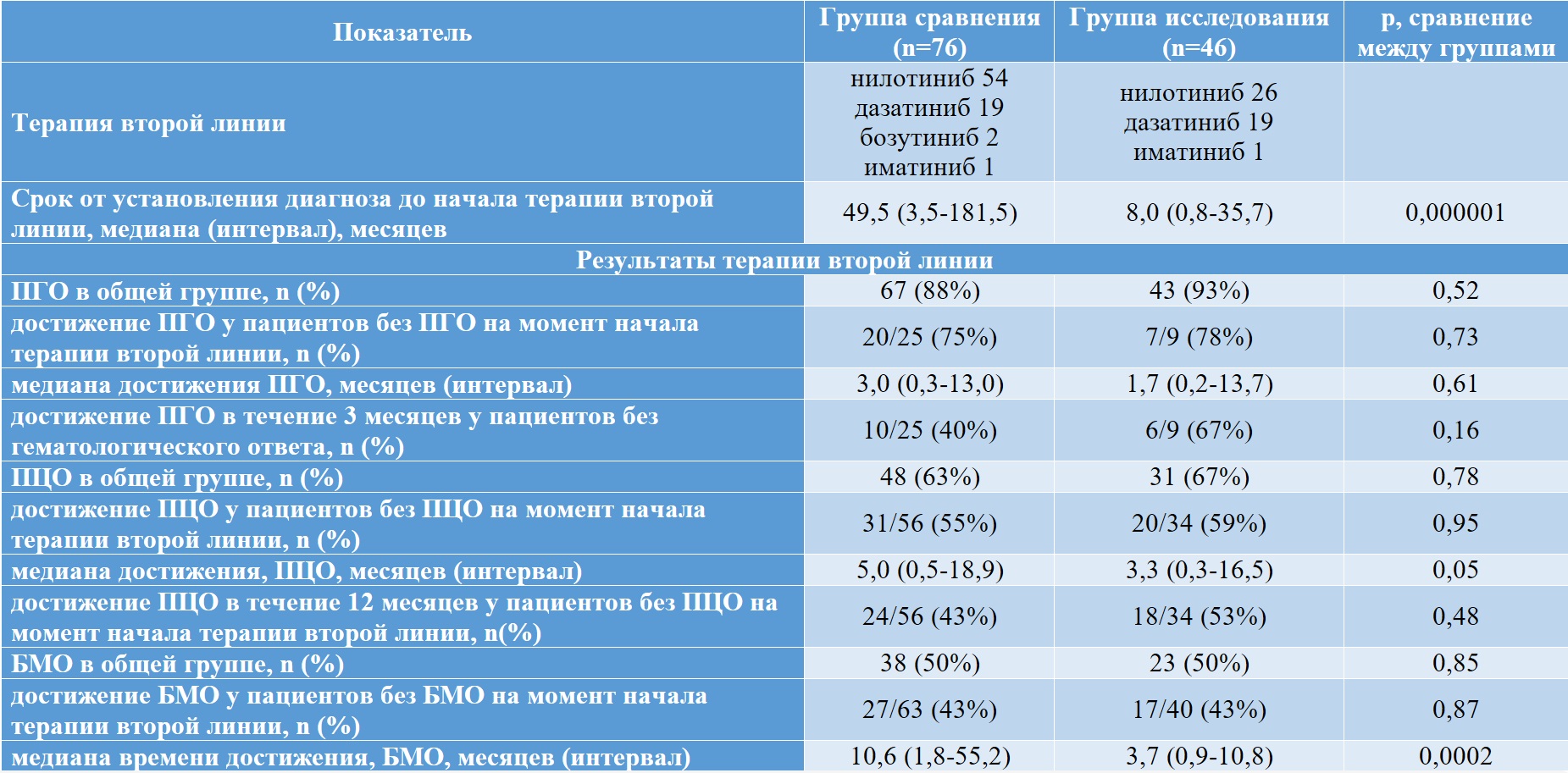
Вторая линия терапии проводилась в группе сравнения 76 больным (нилотиниб – 54, дазатиниб – 19, бозутиниб – 2, иматиниб – 1); в группе исследования 46 пациентам (нилотиниб – 26, дазатиниб – 19, иматиниб – 1).
Сроки от установления диагноза до начала таргетной терапии второй линии статистически значимо различались между группами: медиана составила 49,5 месяцев для группы сравнения и 8,0 для группы исследования.
Третья линия таргетной терапии была использована в группе сравнения у 32 больных (нилотиниб – 6, дазатиниб – 25, бозутиниб – 1); в группе исследования у 19 пациентов (нилотиниб – 1, дазатиниб – 10, бозутиниб – 5, понатиниб – 3). Сроки от установления диагноза до начала таргетной терапии третьей линии статистически значимо различались между группами: медиана составила 81,3 месяца для группы сравнения и 26,4 месяцев – для группы исследования.
Методика ведения ремиссии без лечения была использована у 27 пациентов с диагнозом ХМЛ.
Причинами отмены терапии были: нежелательные явления у 16 больных, наличие глубокого молекулярного ответа у 11 пациентов, давших информированное согласие. Клинические данные пациентов представлены в таблице II-17.
Таблица II-17. Пациенты с хроническим миелолейкозом в фазе ремиссии без лечения
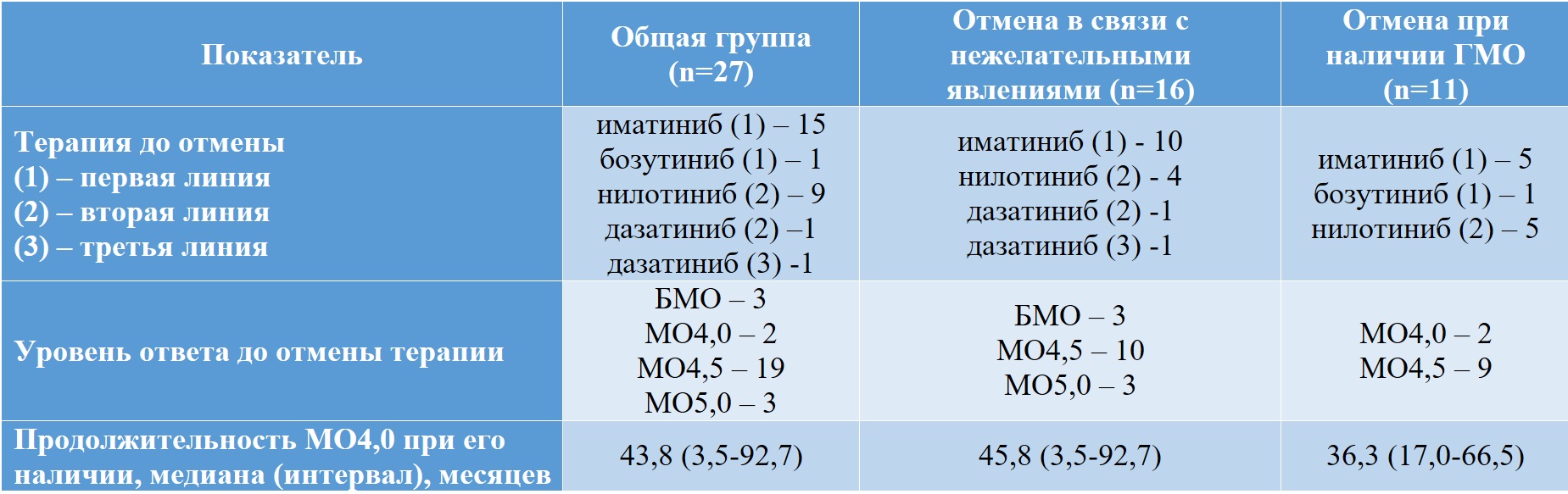
* сравнение между подгруппами
При использовании разработанной программы лечения ХМЛ в первой линии терапии частота достижения целевых суррогатных маркеров выживаемости составила: ПГО на 3 месяца терапии у 64 % пациентов в группе сравнения и у 74 % больных в группе исследования, ПЦО определялся на 12 месяцев терапии в 40 % случаев в группе сравнения и 48 % в группе исследования, БМО на 18 месяцев терапии был зарегистрирован в 16 % группы сравнения и 36 % группы исследования (табл. II-18). Статистически значимым различие было только в частоте достижения БМО (p=0,0002).
Таблица II-18. Лечение больных ХМЛ группы контроля и исследования – первая линия терапии

Общая выживаемость больных при проведении таргетной терапии первой линии статистически значимо была выше в группе исследования, чем в группе сравнения (p=0,0001): 5-летняя ОВ для группы исследования – 89 %, для группы сравнения – 75 % (рисунок II-3).
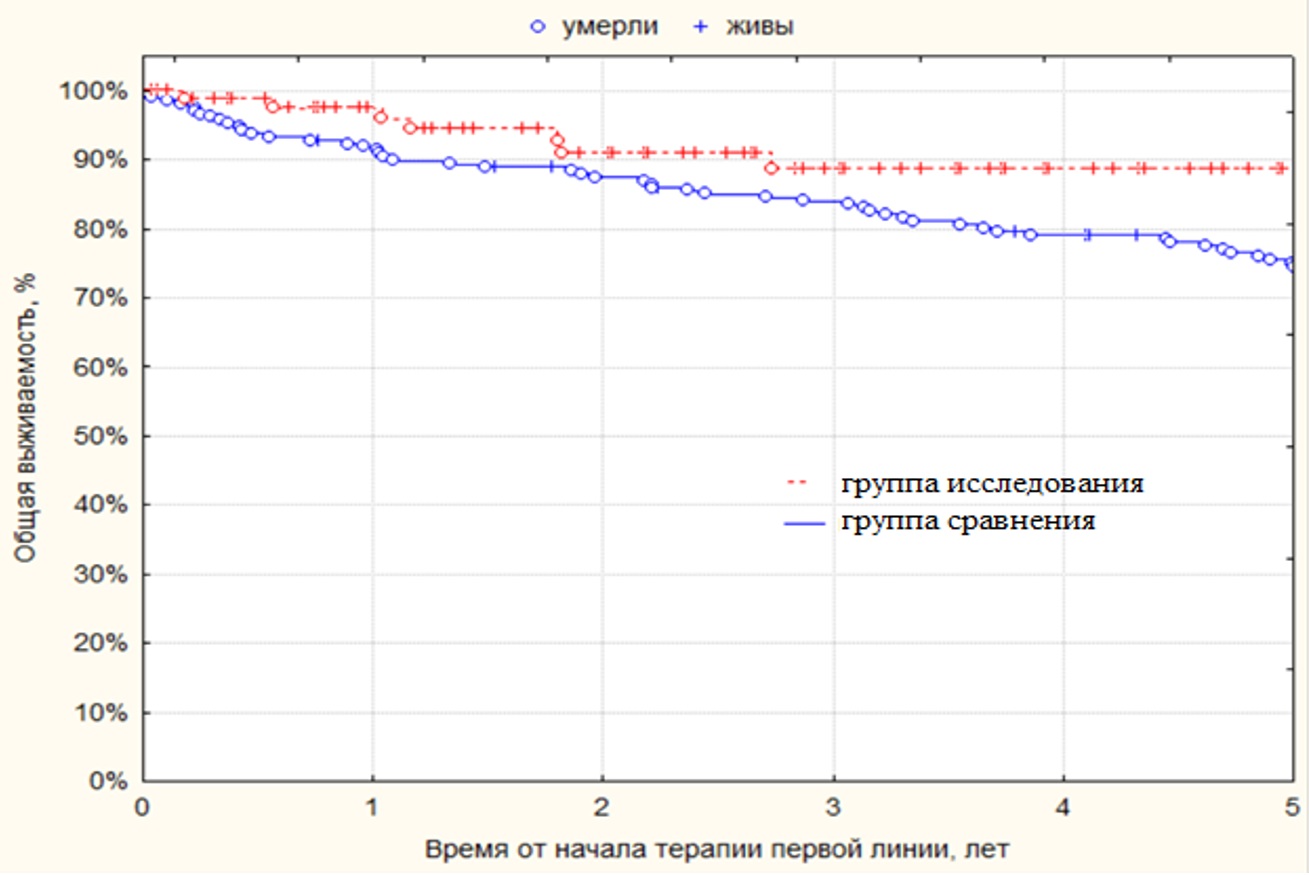
Рисунок II-3. Общая выживаемость больных со времени начала терапии первой линии в группе сравнения (n=208) и группе исследования (n=91).
Терапия второй линии значительно чаще назначалась в группе исследования – 46 (51 %) пациентам в сравнении с 76 (37 %) больных в группе сравнения (p=0,02). Причинами назначения второй линии терапии были: непереносимость терапии – статистически значимо чаще в группе исследования 13 (14 %), чем в группе сравнения 12 (6 %), (р=0,009); резистентность – одинаково часто в группе исследования 29 (32 %) и в группе сравнения 59 (28 %) (p=0,50); другие причины – со схожей частотой в группе исследования 4 (9 %) и в группе сравнения 5 (2 %) и (p=0,54).
Результаты терапии второй линии в группах пациентов представлены в таблице II-18.
Общая частота ПГО, частота достижения ПГО при его отсутствии на момент начала терапии второй линии и частота достижения ПГО в течение первых 3 месяцев терапии второй линии были выше, а медиана длительности достижения ПГО короче в группе исследования по сравнению с группой сравнения, однако, статистически значимых различий получено не было.
Общая частота достижения ПЦО, его частота при отсутствии ПЦО на момент начала терапии второй линии, а также частота ПЦО в течение первых 12 месяцев лечения второй линии были чаще в группе исследования по сравнению с группой сравнения, но без статистически значимых различий. Медиана длительности достижения ПЦО была значимо короче в группе исследования при сопоставлении с группой сравнения.
Большой молекулярный ответ достигался одинаково часто в группах исследования и сравнения как в общем по группам, так и в подгруппах пациентов, не имевших БМО на момент начала терапии второй линии, однако, медиана достижения БМО статистически значимо была почти три раза короче в группе исследования (3,7 месяцев) по сравнению с группой сравнения (10,6 месяцев).
Таблица II-18. Лечение больных ХМЛ группы сравнения и исследования – вторая линия терапии
Общая выживаемость была статистически значимо (p=0,0005) выше в группе исследования по сравнению с группой сравнения: 5-летняя ОВ составила соответственно 88 % и 63 % (рисунок II-4).
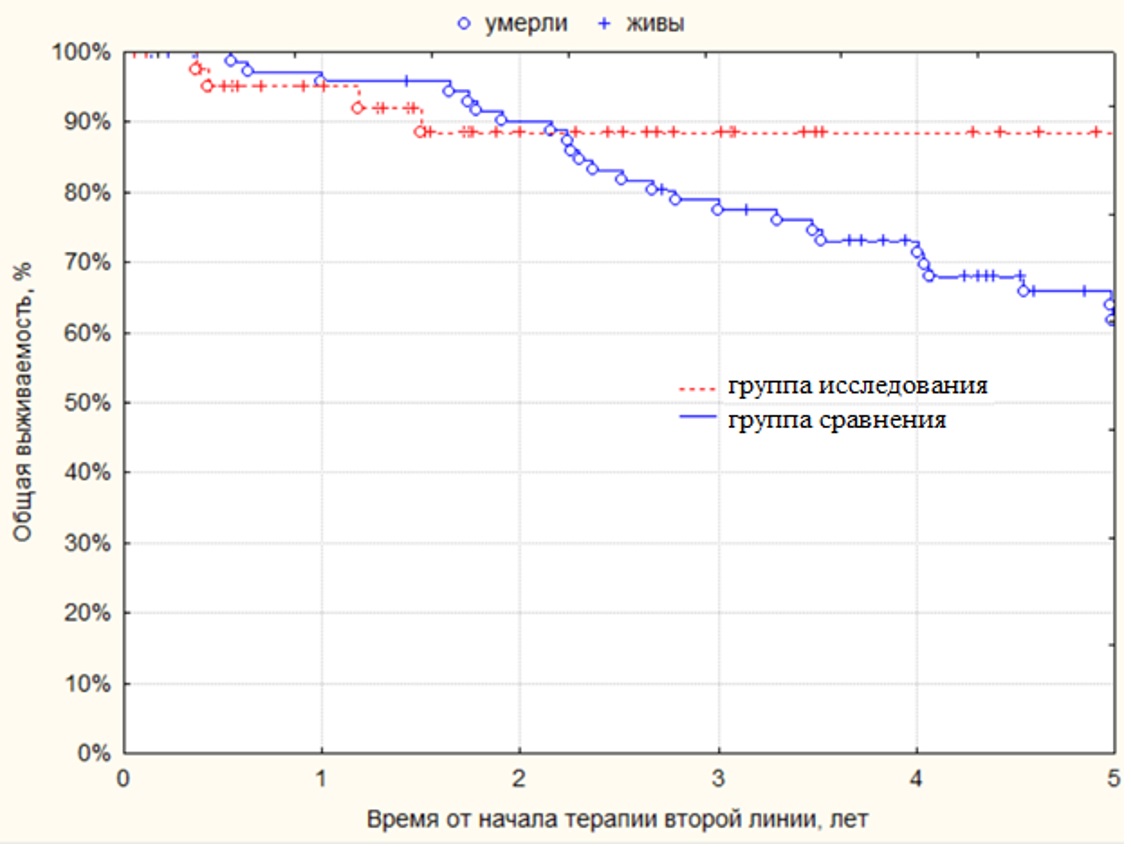
Рисунок II-4. Общая выживаемость пациентов, получавших вторую линию таргетной терапии в группе сравнения (n=76) и в группе исследования (n=46).
Назначение терапии третьей линии одинаково часто проводилось в группе исследования – 19 (41 %) и в группе сравнения 32 (42 %) больных (p=0,99). Частоты встречаемости причин, по которым назначалась терапия третьей линии, статистически значимо не различались:
– непереносимость – в группе исследования 9 (20 %) и в группе сравнения 12 (16 %), (р=0,77);
– резистентность – в группе исследования 9 (20 %) и в группе сравнения 16 (21 %) и (p=0,97);
– другие причины – в группе исследования 1 (2 %) и в группе сравнения 3 (4 %) и (p=0,66).
Результаты лечения пациентов с ХМЛ, получавших таргетную терапию третьей линии, представлены в таблице II-19.
Таблица II-19. Лечение больных ХМЛ группы сравнения и исследования – третья линия терапии
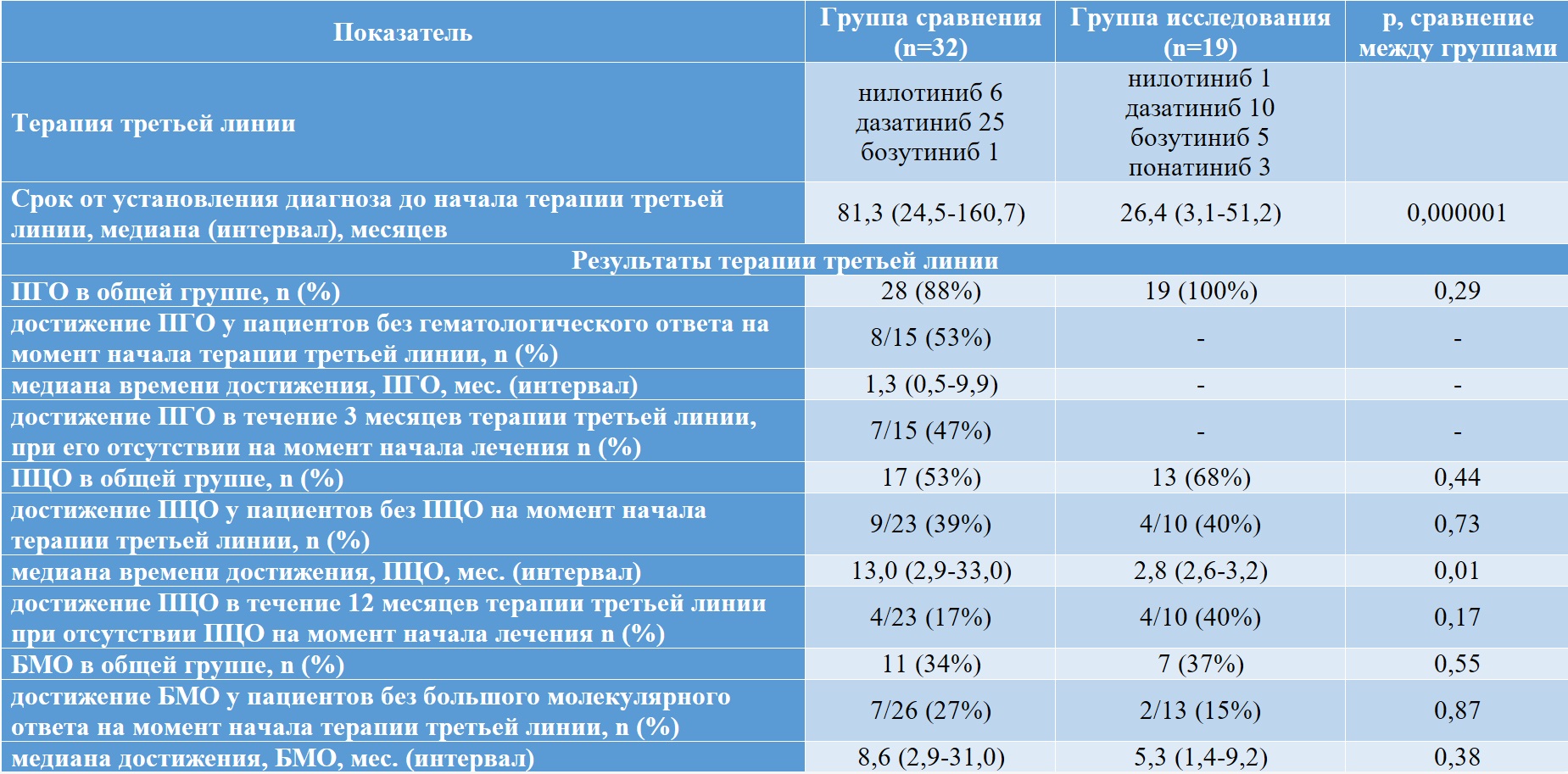
Общая частота ПЦО, частота его достижения при отсутствии ПЦО на момент начала терапии третьей линии, а также частота достижения ПЦО в течение первых 12 месяцев лечения были выше в группе исследования по сравнению с группой сравнения, но без статистической значимости. Медиана длительности достижения ПЦО была значимо короче в группе исследования чем группе сравнения. Большой молекулярный ответ достигался одинаково часто в группах исследования и сравнения, как в общем, так и при анализе подгрупп пациентов, не имевших БМО на момент начала терапии третьей линии. Медиана длительности достижения БМО была короче в группе исследования (3,7 месяцев) по сравнению с группой сравнения (10,6 месяцев), однако, без статистической значимости различий.
Смена терапии на четвертую линию несколько чаще, но статистически незначимо, проводилась в группе исследования – у 6 (32 %) и в группе сравнения у 7 (22 %) больных (p=0,66). Различий в причинах, по которым назначалась терапия четвертой линии между группами больных не было:
– непереносимость – в группе исследования у 2 (11 %) и группе сравнения у 3 (9 %), р=0,62;
– резистентность – в группе исследования у 4 (21 %) и в группе сравнения у 4 (13 %), p=0,33.
Общая выживаемость была значимо (p=0,0001) выше в группе исследования по сравнению с группой сравнения: 3-летняя ОВ составила в группе исследования 100 % и 64 % – в группе сравнения (рисунок II-5).
При анализе выживаемости пациентов с ХМЛ в общей группе, были получены следующие результаты:
– летальные исходы наступили у 90 (43 %) пациентов в группе сравнения, только треть из них (29 случаев) была связана с прогрессированием заболевания, в остальных случаях неблагоприятные исходы были обусловлены сопутствующими заболеваниями (58 больных) и 3 пациента погибли вследствие осложнений алло-ТКМ;
– в группе исследования умерло 7 (8 %) больных, 4 смерти были связаны с прогрессированием ХМЛ, остальные 3 летальных исхода были обусловлены сопутствующими заболеваниями;
– риск смерти был статистически значимо выше (p=0,00007) в группе сравнения (0,0041 случая/лет наблюдения) при сопоставлении с группой исследования (0,0024 случая/лет наблюдения).
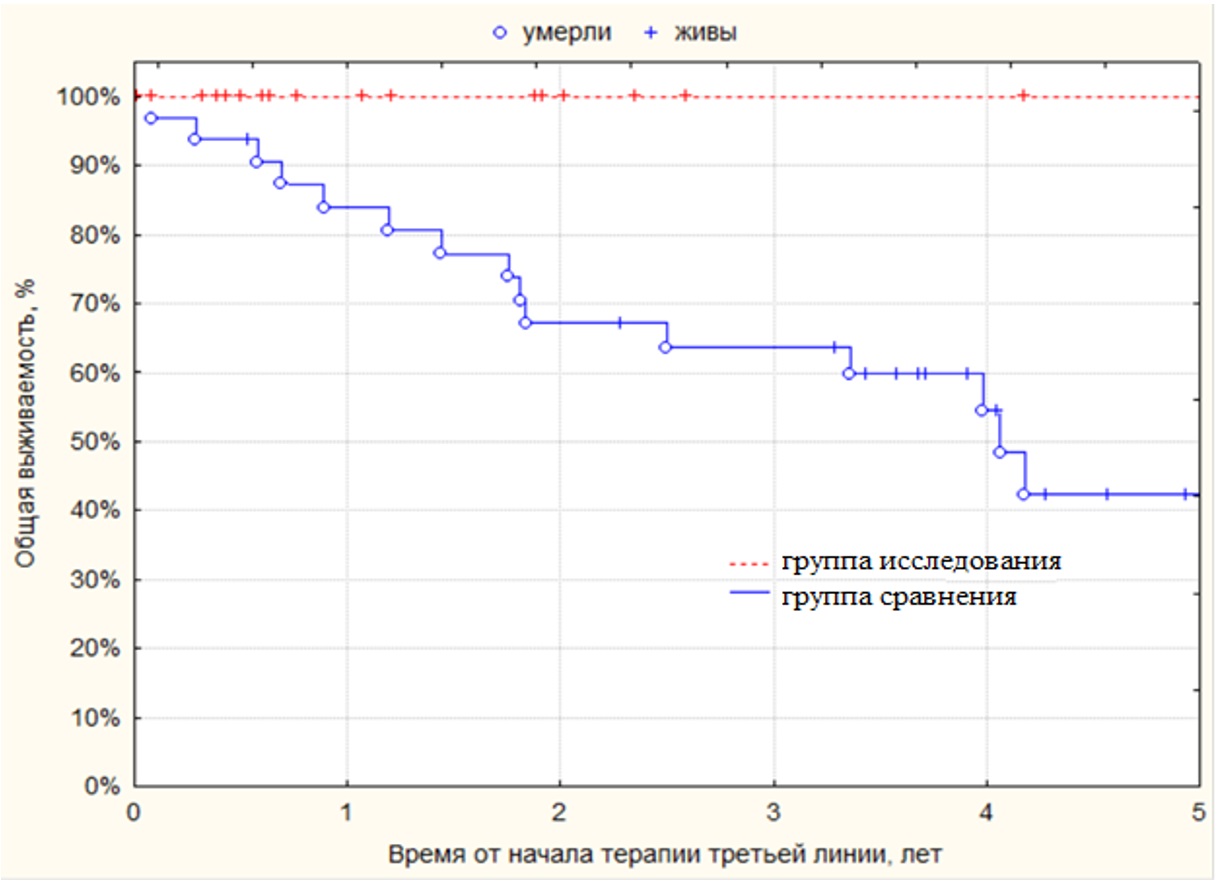
Рисунок II-5. Общая выживаемость больных, получавших таргетную терапию третьей линии в группе сравнения (n=32) и в группе исследования (n=19).
Применение методики ведения ремиссии ХМЛ без использования ингибиторов тирозинкиназ. Доля больных с отменой терапии и стабильным уровнем BCR::ABL, не требующем терапии после 3 лет наблюдения, составила 36 % при отмене терапии в связи с нежелательными явлениями и 38 % при прекращении лечения по желанию пациентов.
Увеличение уровня экспрессии BCR::ABL, требующее возобновления терапии, происходило только в течение первых 2,5 лет наблюдения, в большинстве случаев – в течение первых 6 месяцев прекращения лечения.
Результаты применения методики ведения ремиссии ХМЛ без лечения приведены в таблице II-19.

