Полная версия
Вирусы и эпидемии в истории мира. Прошлое, настоящее и будущее
Вирус, переносимый обезьянами в организме, однако, не вызывает заболевания. Таким образом, каждый раз, когда он сталкивается с незнакомым организмом, вирус может пройти многочисленные мутации и превратиться в штамм, который вызовет новое и тяжелое заболевание. Например, вирус человеческого гриппа содержит один из трех вирусных гемагглютининов, которые являются внешними гликопротеинами вируса, служащими для того, чтобы прикрепляться к молекулам на поверхности клетки(-ок) хозяина. Обозначенный H1, H2 или H3, гемагглютинин (H) вируса человеческого гриппа может быть вытеснен птичьим гемагглютинином, к примеру H5 у птиц, что приведет к заболеванию, известному нам как птичий грипп. Два внешних белка (гликопротеина) на поверхности вируса гриппа – это H и нейраминидаза (N). Заразные для некоторых птиц, вирусы птичьего гриппа H5 и H7 сейчас впервые инфицировали человеческий организм, приведя к высокой смертности среди первых зараженных и госпитализированных. Штаммы птичьего гриппа H5 и H7, опасные для человека, еще не передаются легко от одного заболевшего к другому, но если вдруг такое произойдет, вполне может разразиться новая пандемия гриппа. Существует и другая вероятность. Кроме H1, H2, H3, H5 и H7 птичий грипп содержит еще 11 молекул гемагглютинина, обладающих способностью заменять человеческий гемагглютинин. Несколько исследователей – хотя их опыты и вызывают множество споров – в качестве эксперимента изменили геномы гриппа или последовательности вирусных геномов, чтобы понять, появляются ли у них новые функции или теряются уже имеющиеся. Положительной стороной этих исследований является возможность предсказывать новые опасные вспышки заболевания и подготавливаться к ним; отрицательной – вероятность создания нового вируса гриппа, вируса-Франкенштейна, который сможет вызвать пандемию. Разумеется, подобные исследования проводятся в строго охраняемых закрытых лабораториях.
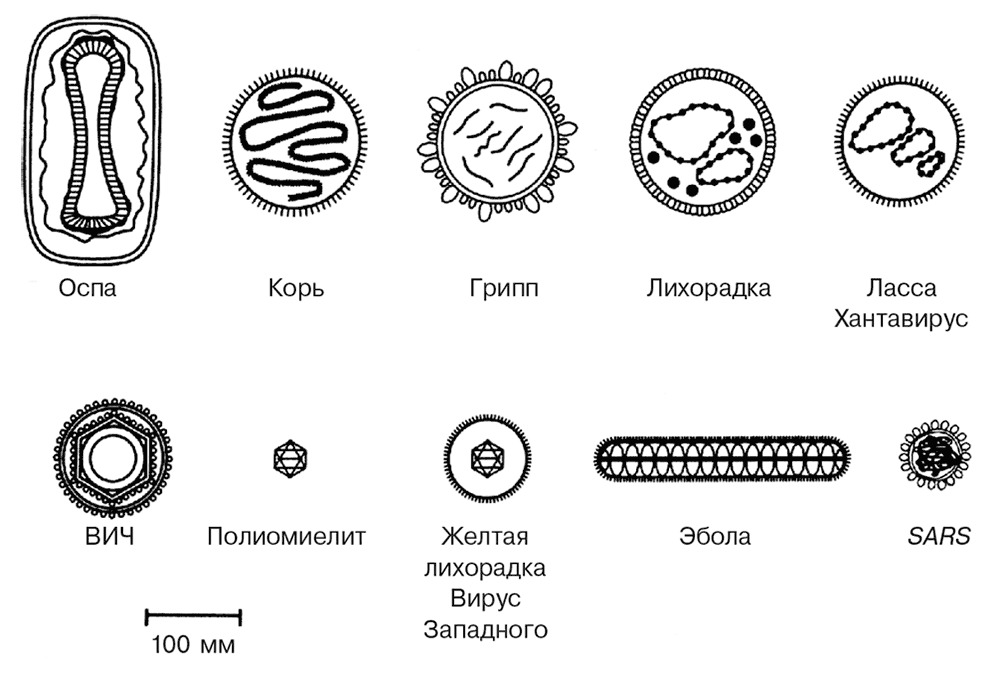
РИСУНОК 2.1. Вирусы отличаются друг от друга образом жизни. В процессе развития у них появились различные формы и размеры для размещения генетического материала. Здесь в масштабированном виде сравниваются вирусы, обсуждаемые в данной книге. Они варьируются от самого маленького, полиомиелита, до самого большого – вируса оспы
Чтобы сохраняться и размножаться в природе, вирус должен пройти несколько этапов. Во-первых, ему нужно найти способ проникнуть в подходящую клетку-хозяина. Вирус вступает в контакт с клеткой, которую он будет инфицировать, а затем прикрепляется к рецептору на ее поверхности. Основная функция плазменной мембраны, или внешней «кожи», содержащей ядро клетки, – защита клетки от проникновения в нее вирусов. И все же вирусы часто проходят через эту оболочку со своими вспомогательными белками и генетическим материалом в цитоплазме (внутренней среде) клетки. Затем вирусы проникают внутрь самой клетки, что приводит к сбрасыванию или удалению внешней оболочки вируса. После этого вирус использует благоприобретенную стратегию для экспрессии своих генов, репликации своего генома и собирает свои составляющие (нуклеиновые кислоты и белки) в многочисленные копии, или потомство. По завершении этой последовательности готовые вирионы – вирусные частицы, сформировавшиеся в процессе репликации, – покидают инфицированную клетку. Процесс этот называется почкованием. В некоторых случаях вирус, произведя многочисленное потомство, убивает инфицированную клетку, больше не нуждаясь в ней для создания следующего поколения.
Обычно прикрепление вирусов к клетке и проникновение внутрь нее зависит от функций самой хозяйской клетки и от свойств конкретных вирусных генов. На поверхности клетки находятся рецепторы, к которым вирус, зацепившись за них, прикрепляется при помощи специально развившихся для этого белков. После того как прикрепление завершится, клетка также должна обеспечить вирусам механизм проникновения и путь, по которому они будут проходить внутрь клетки (в ее цитоплазму или ядро), где они смогут реплицироваться.
Как описано выше, первым шагом в инфицировании хозяйской клетки является прикрепление вирусного белка (точнее, последовательности аминокислот в данном белке) к одному из ее рецепторов. Уникальное распределение некоторых рецепторов и либо их наличие только на ограниченном числе типов клеток, либо, наоборот, их большой диапазон, присутствующий на самых разных видах клеток, диктует количество порталов для внедрения вирусов в клетку. Более того, тяжесть болезни, которую может вызвать вирус, распределение инфицируемых зон (органов, тканей, клеток) в хозяйском организме, а также его способность к выздоровлению определяются типом клетки с такими рецепторами и/или ее способностью реплицировать данный вирус. Например, заражение/уничтожение невосполнимых нейронных клеток в центральной нервной системе (ЦНС) или жизненно важных клеток сердца представляет чрезвычайную угрозу для организма. Намного менее опасно поражение клеток кожи, не являющихся столь критичными для выживания и легко заменяемых.
В качестве примера клеточного рецептора можно привести кластер дифференцировки 4 (CD4), изобилующий на поверхности некоторых лимфоцитов (белых кровяных телец), выделяемых тимусом – зобной, или вилочковой, железой, (CD4+ T-клетки). Молекулы этого типа присутствуют, правда, не в таком количестве, и на моноцитах/макрофагах (макрофаги – клетки, сражающиеся с инфекцией, активированная форма моноцитов) в крови и на определенных тканях человеческого тела. Молекула CD4 вместе с конкретными молекулами-хемокинами (сигнальными молекулами, индуцирующими направленный хемотаксис – движение) является рецептором ВИЧ. Из-за того, что этот рецептор находится на относительно малом количестве типов клеток, которые ВИЧ может инфицировать, его вирусы атакуют лишь немногие зоны в человеческом организме2,3. И напротив, молекула CD46 – один из клеточных рецепторов вируса кори (в частности, для вакцинных штаммов вируса кори), наряду с другими рецепторами – SLAM, или CD150, сигнальной молекулой активации лимфоцитов и нектин-4, – присутствует на клетках многих видов4–9. CD46 обнаруживается на клетках эпителия, который покрывает большинство полостей в организме, включая нос, глотку, дыхательную/респираторную систему и кишечник; на эндотелиальных клетках, выстилающих кровеносные сосуды; на лимфоцитах/макрофагах и на нейронных клетках головного мозга. Молекулы SLAM находятся на клетках эпителия, эндотелия, нейронах, лимфоцитах/макрофагах и дендритных клетках; нектин – на клетках эпителия. Наличие этих рецепторов на таких клетках объясняет репликацию, тропизм, подавление иммунной системы и мозговые явления, проявляющиеся при коревой вирусной инфекции.
Помимо конкретных клеточных рецепторов, вирусы могут проникать в клетку и по-другому. Когда незнакомый агент, состоящий из чужеродных белков (антигенов) – такой как вирус, – внедряется в организм, защитная реакция хозяина вызывает создание антител, которые связываются с антигенами и нейтрализуют их. Благодаря тому, что антитела имеют форму, примерно напоминающую букву Y, они могут прикрепляться к антигену двумя способами: во-первых, своими «руками» (двумя верхними частями Y), при помощи которых они взаимодействуют именно с антигенами на поверхности клетки, используя место связывания (так называемое место связывания фрагмента антигена [Fab2]). Во-вторых, при помощи своей нижней части, известной как область Fc, молекулы антител могут сцепляться с рецепторами (рецепторами Fc) на определенных клетках. После того как антитела, произведенные иммунной системой в ответ на появление в организме-хозяине вирусных антигенов, объединяются с этими антигенами, образуется инфекционный комплекс «вирус – антитело»10. Прикрепившись к клетке с помощью рецептора Fc, вирус может проникнуть в клетку как часть комплекса «вирус – антитело», даже если на поверхности клетки отсутствует подходящий для него рецептор.
Не все клетки, связавшиеся с вирусом и допустившие его внутрь себя, обладают подобающим механизмом для его репликации. Таким образом, прикрепление вируса к рецептору и проникновение его в клетку необязательно ведет к производству вирионов. Итак, подойдет ли конкретная клетка для размножения в ней вируса, зависит по крайней мере от трех факторов. Во-первых, на поверхности должен находиться функциональный рецептор. Во-вторых, в наличии должен быть конкретный вирусный белок, вернее, его пептидная последовательность, чтобы прикрепить вирус к рецептору клетки. В-третьих, клетка должна обладать необходимым механизмом, чтобы способствовать репликации вируса.
Следующий за прикреплением шаг, во время которого вирус может внедриться в клетку, – процесс активный и зависит от запаса энергии. Проникнуть внутрь за секунды после прикрепления вирус может, либо целиком пройдя сквозь плазменную мембрану клетки – процесс, известный как фагоцитоз (или, конкретнее, эндоцитоз), когда вирусная частица заключается в вакуоль или внутренний отсек клетки, – либо сливаясь с мембраной клетки своей внешней оболочкой. Попав внутрь клетки, вирус сбрасывает свой защитный белковый покров и высвобождает свой геном для репликации. За этой процедурой следует репликация вирусного генома, во время которой производство собственных белков хозяйской клеткой переключается на синтез новых вирионов. Чтобы произвести огромное количество своих собственных белков, вирусы должны развить стратегию, которая даст им преимущество для синтеза вирусных строительных материалов, а не строительных материалов клетки-хозяина. Вирусы добиваются этого, либо лишая клетку способности производить свои собственные белки, либо получив преимущество в выборе производимых клеткой материалов, переключив ее на производство именно вирусных компонентов.
Вирусы содержат либо РНК, либо ДНК и, соответственно, подразделяются на РНК- и ДНК-содержащие. РНК-содержащие вирусы – это единственные известные организмы, использующие РНК в качестве своего генетического материала. Они реплицируют свои РНК-геномы двумя уникальными способами: либо путем РНК-зависимого РНК-синтеза (это свойственно большинству РНК-вирусов, то есть кори, гриппу, полиомиелиту и т. д.), либо путем РНК-зависимого ДНК-синтеза, так называемой обратной транскрипции, за которой следуют интеграция ДНК в клеточное ядро, ее репликация и транскрипция (характерно для ретровирусов, таких как ВИЧ).
Важно то, что РНК-репликация – процесс, сильно подверженный погрешностям, так как у этого класса вирусов нет надежного механизма корректировки ошибок посредством удаления нуклеиновых кислот, претерпевших отклонения или мутации. У фермента (полимеразы), катализатора РНК-репликации, корректировочная активность минимальна. В результате уровень погрешностей у РНК-вирусов в 10 000 раз выше, чем у ДНК-содержащих вирусов (то есть герпесвирусов, оспы), чей корректирующий механизм удаляет отклоняющиеся от нормы вирусные ДНК во время ДНК-репликации. Таким образом, для эволюции, селекции и биологии РНК-вирусов последствия этого весьма значительны. Популяции клонов РНК-вирусов никогда не бывают гомогенны напротив, они представляют собой массу родственных РНК-последовательностей, группирующихся вокруг основной последовательности. Это множество обозначается как квазивиды и представляет собой плодородную почву для создания генетических вариантов, которые могут успешно реагировать на селективные сложности, такие, например, как при инфицировании хозяйского организма, резистентного к данному вирусу. В результате часть генетической композиции вируса может измениться в пользу вируса, обеспечивая ему преимущество в этом процессе, который включает постоянную репликацию, непрерывное продвижение и распространение. Таким образом, РНК-вирусы только эволюционируют до миллиона раз быстрее, чем ДНК-вирусы.
Высокая степень погрешности РНК-вирусов ограничивает их геномы в размере, то есть в количестве их генов. Различные РНК-вирусы могут содержать 4–10 генов; для сравнения, ДНК-вирусы (такие, как вирус оспы) имеют сотни генов. ДНК-вирусы, которым нужно относительно немного генов для репликации, несут с собой целый багаж многочисленных генов, которые обеспечивают им селективное преимущество. В этом багаже находятся дополнительные гены, не представляющие жизненной необходимости для репликации вируса, но важные для повышения его выживаемости и способности производить потомство. Следовательно, РНК-вирусам, несущим значительно меньше генов, чем ДНК-вирусы, приходится выполнять столько же задач, что и ДНК-вирусам, у которых генов множество. РНК-вирусы частично выходят из положения, кодируя белки для выполнения множественных задач. Для РНК-вирусов это разнообразие приводит к индивидуальности многочисленного потомства, а также к потере многих вирусов из всей их массы из-за летальных вирусных мутаций. Преимущество РНК-вирусов состоит в быстрой эволюционной реакции.
Дальше РНК-вирусы подразделяются на разновидности с позитивно и негативно-полярными нитями РНК. Для того чтобы начать свой инфекционный цикл, вирусы с позитивно-полярными нитями РНК доставляют РНК своих геномов непосредственно к рибосомам клеток. Вирусы с информационной РНК с позитивно-полярной нитью (mRNA) инфекционны, и в их числе такие, как полиомиелит. Вирусы же кори, гриппа, лихорадок Эбола и Ласса, напротив, имеют негативно-полярную нить РНК – их РНК неинфекционна. Они вынуждены начинать свой инфекционный цикл с транскрибирования (копирования) вирусных информационных РНК. Ферменты, переносимые инфицирующими вирусами в хозяйскую клетку, ускоряют этот процесс.
Каким бы ни был путь, как только вирусные геномы и белки сформированы, они образуют многочисленное потомство, которое, созрев, покидает пораженную клетку. Отдельные вирусы развили и «запатентовали» уникальные механизмы в этом процессе. Сформировавшись в созревшую частицу, вирусы принимают конкретную форму и достигают определенных размеров.
Существуют три различных пути того, как вирусы вызывают заболевания11,12. В первом случае вирус или его белки напрямую токсичны для клетки. При таком раскладе вирус убивает хозяйскую клетку. У некоторых вирусов этот процесс служит для высвобождения вирионов из клетки наружу в окружающее ее внешнее пространство. Другой метод позволяет вирусу сохранить клетку, но вместо ее уничтожения изменить ее функцию. Это означает, что синтез клеткой какого-то важного вещества либо снижается, либо повышается. К примеру, неопасная для жизни вирусная инфекция клетки, вырабатывающей гормон роста, может снизить уровень производства этого гормона инфицированной хозяйской клеткой. В результате хозяйский организм перестанет расти и нормально развиваться. Третий путь, посредством которого вирусное заражение может вызвать болезнь и ущерб здоровью, – это участие вируса в иммунном ответе хозяйского организма13. Как описано в главе 3, задача иммунного ответа на вирусную атаку заключается в избавлении инфицированных клеток от вирионов и выведении инфекционного вируса из крови и других жидкостей хозяйского организма. Идея в том, чтобы уничтожить фабрики, производящие новые вирусы, если повезет, до того, как завершится формирование инфекционного вирусного потомства. В следующей главе рассказывается, что специализированная составляющая иммунного ответа, так называемые цитотоксические CD8 T-клетки, способны распознавать на поверхности клетки части вирусных белков (пептидов) среди собственно хозяйских частиц (молекул I главного комплекса гистосовместимости) и убивать инфицированную клетку на ранней стадии инфекции, прежде чем завершится сборка инфекционных вирусных частиц. Кроме того, могут формироваться иммунные комплексы «вирус – антитело», оседая на стенках кровеносных сосудов или застревая в почках, что затем приводит к их повреждению. Таким образом, другой стороной иммунного ответа, обычно выполняющего защитные функции, может быть его разрушительный потенциал. Наука, изучающая такие процессы, называется иммунопатологией. Соотношение между защитными и разрушительными процессами в иммунной системе отвечает большей частью за клинические симптомы (то, что пациент ощущает или описывает) и клинические признаки (то, что обнаруживает врач), сопровождающие вирусную инфекцию.
Как вирусы были признаны опасными для здоровья? Хотя болезни, вызываемые вирусами, были известны еще в древности, сами вирусы были опознаны как отдельные носители инфекции лишь в конце 1890-х годов, после того как было признано существование бактерий и других паразитов.
Бактерии были открыты только в середине 1800-х годов, когда завершили работу первооткрыватели в этой области Луи Пастер, Роберт Кох и их коллеги: был разработан лабораторный процесс создания бактериологических культур, так что бактерии стало возможно выращивать в обогащенном агаре или бульоне, затем размещать на лабораторных стеклах, окрашивать и изучать под микроскопом. Бактерии задерживались фильтром с отверстиями-порами определенного размера, что позволяло вычислить величину каждой из них. После идентификации конкретные бактерии можно было связать с определенными болезненными состояниями. Именно во время работы по такой схеме и были обнаружены вирусы. В 1898 году Дмитрий Иосифович Ивановский14 в России и Мартин Бейеринк15 в Нидерландах продемонстрировали, что частицы вещества, вызывающего заболевание табачных растений, вместо того чтобы задерживаться в порах фильтра Пастера – Шамберлана, проходят через них, сохраняя при этом способность инфицировать (то есть эти частицы оказались меньше бактерий, которые задерживались фильтром). (Рисунок 2.2 и рисунок 2.3. на вклейке.) Исследователи обнаружили, что вещество, остававшееся в этом отфильтрованном растворимом осадке, каким-то образом могло развиваться на здоровых листьях табака, но не в питательной среде, используемой для выращивания бактерий. Это было первое сообщение о растительном вирусе – вирусе табачной мозаики. Фридрих Лёффлер и Пауль Фрош16 в Германии аналогичным способом пришли к выводу, что возбудитель ящура у коров также не задерживался керамическими фильтрами и вызывал симптомы болезни у здорового до этого скота при введении его в их организм. В 1900 году первый вирус, инфицировавший человека, – вирус желтой лихорадки – был выделен на Кубе Уолтером Ридом и его сотрудниками (см. главу 5). Таким образом, Рид и его группа открыли первый фильтруемый вирус человека – первый переносимый насекомыми (комарами) вирус; впервые доказали существование вируса, циркулирующего в крови, и его передачу от человека к человеку. Эти наблюдения, вызывавшие множество споров в то время, создали основу для описания вирусов как субклеточных единиц, которые могут вызывать определенные повреждения тканей, что становится признаком конкретных заболеваний. Уникальность этого научного расследования становится еще более очевидной, если представить себе, что вирусы слишком малы, чтобы их можно было рассмотреть, и их невозможно было вырастить в существовавших тогда питательных средах. Визуализации вирусов пришлось ждать до начала использования электронных микроскопов в середине 1930-х годов, а вырастить в питательной среде живую клетку, необходимую для репликации вирусов, смогли только в конце 1940-х – начале 1950-х годов.
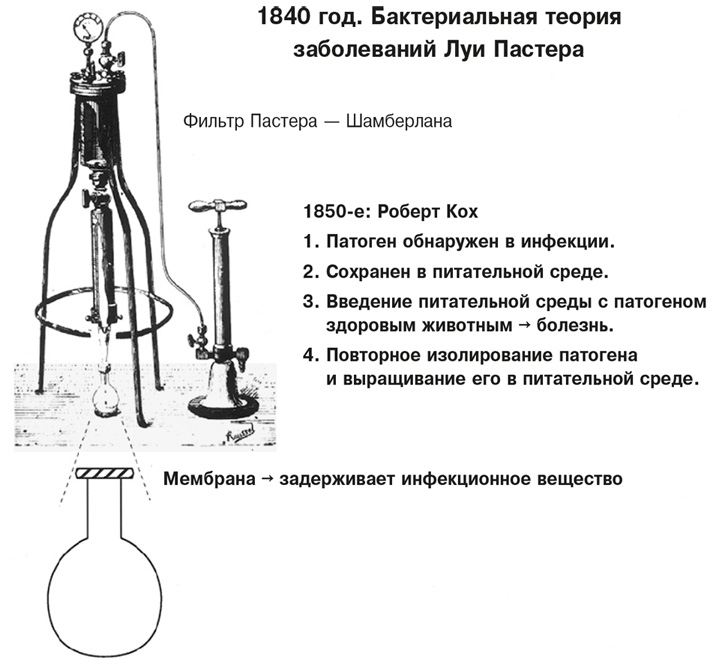
РИСУНОК 2.2. Разновидность фильтра Пастера – Шамберлана, присоединенного к ручной помпе, использовавшаяся в Институте Пастера к концу XIX века
Большинство вирусных инфекций считаются острыми заболеваниями. Это значит, что вирус-возбудитель проникает в организм, размножается в одной или нескольких тканях и распространяется локально либо с кровотоком, либо по нервам. За инкубационным периодом, длящимся от двух дней до двух-трех недель, следуют признаки и симптомы заболевания и местные или широкомасштабные повреждения тканей. Вирусы можно выделять из крови пациента (из плазмы или кровяных клеток) или выделений (назальных, респираторных, уринальных, фекальных и т. д.) очень недолго: непосредственно до или сразу после появления симптомов из перечисленных выше источников и из инфицированных тканей. После этого инфицированный либо выздоравливает – часто осчастливленный пожизненным иммунитетом к данному вирусу, – либо умирает во время острой фазы заболевания.
В отличие от острых, хронические заболевания характеризуются тем, что иммунный ответ не в состоянии полностью удалить вирусную инфекцию из организма, и оставшиеся в нем вирусы могут существовать месяцы и годы. Как в случае ВИЧ и гепатитных инфекций, инфекционные полноценные вирусы способны собираться в течение всей болезни, годами. Несмотря на то, что все компоненты иммунного ответа (антитела и T-клетки) генерируются в течение ВИЧ и гепатитных инфекций, а присутствие вирусов отслеживается, иммунная система инфицированного организма не в силах полностью ликвидировать инфекцию.
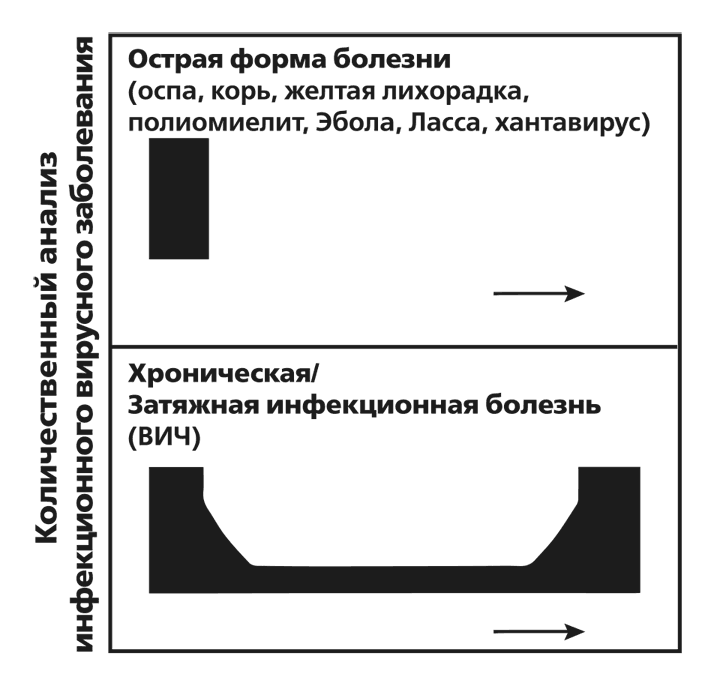
РИСУНОК 2.3. Вызванные вирусами инфекции отличаются друг от друга. Некоторые протекают в острой форме, как корь, грипп и желтая лихорадка; их исход – выздоровление или смерть – решается в пределах нескольких недель. Другие, такие как ВИЧ и вирус гепатита, вызывают инфекции, хронически протекающие в инфицированном человеческом организме годами или всю жизнь. Затемненная область на рисунке обозначает наличие вируса.
Во время этой хронической фазы составляющая иммунитета, отвечающая за генерацию T-клеток, ослабевает или совсем исчезает; то есть T-клетки истощаются и плохо функционируют. На рисунке 2.4 продемонстрирована разница между острой и хронической инфекциями. Что представляет собой иммунный ответ и как он борется с вирусами, описано в следующей главе.
Глава третья. Введение в основы иммунологии
Термин «иммунный» часто воспринимается неправильно. Для обычных людей «иммунитет» означает полное отсутствие каких-либо заболеваний. Тем не менее ученые-медики знают, что патоген может инфицировать хозяйский организм в такой мягкой форме, что не вызовет никаких серьезных последствий или угрозы жизни. На самом деле такая инфекция часто протекает без каких-либо видимых признаков. Таким образом, «иммунитет» обозначает некую систему в организме (иммунный ответ), которая, вместо того чтобы предотвращать инфекцию, дает возможность инфицированному объекту сопротивляться заболеванию.
Белки вирусов и бактерий, вызывающие иммунный ответ, называются «антигенами», или «иммуногенами», а «иммунитет» – долгосрочная защита от повторного заболевания, причиной которого являются конкретные вирусы или бактерии, – появляется в результате успешного иммунного ответа на эти антигены1. Подобным же образом вакцина стимулирует иммунный ответ, программируя его на предупреждение и сопротивление в будущем таким же патогенам, как и те, что используются в конкретной вакцине.
Эволюция иммунной системы была всегда направлена на борьбу со всевозможными многочисленными и разнообразнейшими инородными антигенами. Следствием проникновения вируса в организм и репликации в нем становится создание вирусных антигенов, которые в большинстве случаев вызывают в атакуемом организме иммунный ответ. Успешная работа иммунной системы определяет способность организма выживать. Помимо этого, иммунная система должна отличать чужеродные антигены, такие как вирусные белки, которые своими собственными не являются, от своих собственных белков (т. е. гормонов, таких как инсулин и клеточные белки, из которых состоят мышечные или нервные клетки).
После первоначального столкновения с вирусной инфекцией, во время острой фазы, начинается гонка между быстро реплицирующим вирусом и хозяйской иммунной системой, которая сперва стремится сократить количество создаваемых вирионов, а затем полностью очистить организм хозяина от вируса. На кону стоит, преуспеет ли вирус в своей репликации. Для борьбы с вирусом хозяйский организм мобилизует и использует множество средств – как специфическую, так и неспецифическую реакцию своей иммунной системы. Сначала в бой против вируса и инфицированных им клеток вступают неспецифические факторы. В эту группу входят природные убийцы: лимфоидные клетки, фагоцитные макрофаги (большие клетки, поглощающие или съедающие вирусы), а также белки в крови, называемые факторами комплемента, способные взаимодействовать с вирусами и уничтожать клетки. Чрезвычайно важна врожденная иммунная система, обеспечивающая начальную защиту от патогенов и стимулирующая последующую реакцию адаптивной иммунной системы. Главными игроками во врожденной иммунной системе являются толл-подобные рецепторы (TLR), распознающие различные микробные конфигурации и интерфероны I-типа (IFN), создаваемые в основном плазмоцитоидными дендритными клетками (DC)1,2. Эти две действующие силы дополняют друг друга и участвуют в создании последующей реакции адаптивной иммунной системы. К примеру, взаимодействие патогена с TLR может спровоцировать выделение IFN. Интерфероны I-типа являются ключевыми молекулами, которые усиливают и поддерживают реакцию T-клеток. Они активируют костимуляторные молекулы главного комплекса гистосовместимости на дендритных клетках – условие, необходимое для их оптимального взаимодействия с T-клетками, экспрессирующими на своей поверхности CD4+ и CD8+ T-клеток. Итак, подводя итог, после вирусной инфекции или вакцинации так называемые профессиональные антиген-представляющие клетки, главным образом DC-клетки, но также и B-клетки, и макрофаги, осуществляют процессинг вирусных белков (антигенов), до коротких участков, называемых пептидами, и представляют их на своей поверхности, упакованными в гликопротеины главного комплекса гистосовместимости (MHC). В случае вирусной инфекции образующиеся внутриклеточно пептидные АГ связываются с молекулами MHC I класса, которые представляют их T-клеткам. Это действие обозначается как предварительная иммунизация и буквально подготавливает инфицированного к сопротивлению болезни. Внешний путь, или путь MHC II класса, в основном используется для обработки бактерий и токсинов. При должной стимуляции антиген-представляющие клетки (главным образом DC-клетки) выставляют на своей поверхности костимулирующие молекулы, такие как B7.1 и B7.2, и производят субстанции (цитокины), активирующие T-клетки, чтобы обеспечить иммунный ответ, который, в свою очередь, ликвидирует внедряющиеся вирусы, уничтожая клетки, в которых эти патогены размножаются. Эффективность антивирусного иммунного ответа напрямую коррелирует с величиной и мощностью реакции адаптивной иммунной системы и появляющейся в результате этого памятью, предотвращающей дальнейшее пагубное воздействие данного конкретного вируса. Вся сила иммунного ответа, следующего за инфекцией или вакцинацией, отражает соотношение между теми факторами (цитокинами), которые усиливают реакцию иммунной системы (провоспалительные цитокины), и теми молекулами организма-хозяина, которые служат для снижения силы или нивелирования иммунного ответа (антивоспалительные цитокины). Факторы, нивелирующие или подавляющие иммунитет (такие молекулы, как интерлейкин-10, запрограммированная смерть-1 [PD-1], и т. д.3–5 и T-регуляторные клетки), представляют защитный механизм хозяина для предотвращения избыточного иммунного ответа, который может нанести урон организму. И все же некоторые вирусы научились использовать ситуацию в свою пользу; они нашли способ стимулировать продукцию подавляющих иммунную реакцию молекул, тем самым подавляя мощность иммунного ответа, необходимую для очищения организма от инфекции. Это приводит к тому, что обычно эффективные цитотоксические T-клетки хозяйского организма перестают адекватно функционировать, истощаются и не могут справиться с вирусной инфекцией. Тогда вирусы могут продолжать существовать в хозяйском организме в виде хронической устойчивой инфекции. Как описывается в главе 16 на примере ВИЧ, эти иммуноподавляющие молекулы, найденные при помощи экспериментальной модели животного вируса лимфоцитарного хориоменингита3–5, обнаруживаются у пациентов с ВИЧ и другими устойчивыми вирусными инфекциями и различными видами рака. Одна из используемых сейчас терапевтических стратегий заключается в блокаде или нейтрализации таких иммуноподавляющих молекул в надежде на то, что ослабевшие T-клетки восстановят свои функции и смогут бороться с хроническими вирусными инфекциями и элиминировать дефектные или зараженные клетки. Важно отметить, что подобный сценарий был позднее применен для борьбы с несколькими видами рака человека. Восстановление функционирования истощенных антираковых цитотоксических T-клеток при помощи блокирования иммуноподавляющих молекул антителами называется иммунотерапией рака5,6. В 2018 году Тасуко Хоньо (за работы по изучению молекул PD-1) и Джим Эллисон (за изучение CTLA4)7 получили Нобелевскую премию по медицине за применение в раковой иммунотерапии блокады антителами молекул PD-1, цитотоксического T-лимфоцит-связанного а – 4 (CTLA4) и других иммуноподавляющих молекул3-5. Эти молекулы являются рецепторами и участвуют в функционировании цитотоксических T-клеток, или T-киллеров, подавляя их и не давая им атаковать раковые клетки или клетки, зараженные вирусом. Как указывается в последующих главах, некоторые вирусы способны вызывать рак; в действительности, примерно 20 % всех онкологических заболеваний связаны с вирусными инфекциями (ВИЧ – саркома Капоши, агрессивная B-клеточная неходжкинская лимфома; вирусы гепатита В и С – аденокарцинома печени; папилломавирус – рак полового члена и шейки матки; вирус Эпштейна – Барр – назофарингеальный рак, лимфома Буркитта, лимфома Ходжкина, некоторые случаи рака желудка и т. д.).