
Полная версия
Целевое питание для нормализации показателей здоровья
– Святой отец, я не пью, не курю, не встречаюсь с женщинами. Скажите, правильно ли я живу?
– Правильно, сын мой. Но зря…
АнекдотИнтересно отметить, что в геронтологии происходит смена парадигмы. В то время как прежде основным было исследование биологических механизмов старения, сейчас приоритетным становится изучение процессов замедления наступления возрастассоциируемых болезней, т. е. направленных на продление именно активной и здоровой части жизни человека. И здесь очень важны превентивные меры, направленные в том числе на нормализацию значений биохимических показателей крови, вышедших за пределы референтных значений. Однако необходимы определенные оговорки. Некоторые показатели могут изменяться в течение короткого времени на значительные величины, и эти отклонения могут быть жизненно важны для организма. Кроме того, значение отдельных показателей зависит от времени суток, сезона, приема лекарств и пищевых добавок, физической активности, возраста, перенесенных ранее заболеваний, психологического состояния и т. д. Нельзя забывать и об условности референтных значений, т. к. зачастую показатели имеют огромный межиндивидуальный разброс, не говоря уже о том, что референтные значения крайне редко учитывают динамику возрастных изменений. Именно поэтому нельзя делать вывод по однократному измерению показателей. Только неоднократный выход в течение непродолжительного времени определенных биохимических показателей из референтного диапазона может свидетельствовать о необходимости принятия корректирующих, превентивных мер. И в этом случае первоначально необходимо использовать именно целевое питание. Ниже рассмотрим отдельные, на наш взгляд наиболее важные показатели, требующие постоянного мониторинга и своевременной нормализации их значения. Отметим также, что выбор показателей во многом обусловлен необходимостью принятия превентивных мер против двух заболеваний с наиболее тяжелыми последствиями – сердечно-сосудистых и онкологических.
Железо
Основной функцией железа в организме является транспортировка кислорода к тканям и выведение углекислого газа. В случае отклонения от нормативных значений в любую сторону может появляться слабость, головные боли, ухудшаться работоспособность, память, когнитивные способности. Другими функциями железа являются:
– формирование иммунной системы;
– участие в синтезе ДНК;
– участие в метаболизме гормонов надпочечников;
– участие в кроветворении;
– участие в процессах репарации и репликации клеток;
– осуществление переноса электронов в составе энзим-цитохромов;
– уменьшение уровня токсинов;
– участие в составе цитохрома Р450, необходимого для эффективной детоксикации первой фазы;
– поддержание нормального уровня холестерина;
– участие в выработке гормонов щитовидной железы, оказывающих влияние на обменные процессы;
– предотвращение развития анемии.
Железо способствует синтезу белка миоглобина, участвующего в сокращении мышечных тканей, регулирует окислительно-восстановительные процессы, поддерживает иммунную систему. Анализ уровня железа является одним из самых важных анализов, который на постоянной основе должен сдавать каждый. Хотя железо в умеренных количествах необходимо, его избыток может принести значительный вред органам, тканям, суставам. Высокий уровень железа повышает риск онкопатологии и сердечно-сосудистых заболеваний, сахарного диабета второго типа, усиливает рост патогенных бактерий, грибков, простейших10. Люди с избыточным весом склонны к увеличению уровня ферритина11 и наоборот, как показало корейское исследование, – несколько увеличенный уровень ферритина в крови способствует ожирению. Поскольку железо участвует в окислении липопротеинов низкой плотности и повреждении эндотелиальных клеток, что приводит к атеросклерозу, оно повышает риск инфаркта, инсульта, сердечных приступов. Вообще, при любых проблемах с сердцем надо проверить кровь на наличие избытка железа, причем желательно не только кровь, но и волосы, и ногти, чтобы проанализировать динамику. Высокие концентрации железа выявлены в бляшках кровеносных сосудов мозга у пациентов с болезнью Альцгеймера и Паркинсона. Есть данные, что избыток железа индуцирует развитие депрессии и шизофрении. Выявлена связь наличия полипов в толстом кишечнике с повышенным уровнем железа, возможно именно поэтому частое употребление красного мяса ассоциировано с колоректальным раком. Здоровье костей регулируется в том числе клетками, чувствительными к железу. В случае нарушения обмена железа возникает склонность к остеопорозу12.
Нельзя исключать, что вследствие того, что женщины на протяжении 30—40 лет каждый месяц во время менструации снижают уровень железа, они живут в среднем дольше мужчин, реже болеют сердечно-сосудистыми и онкологическими заболеваниями. Почему повышенный уровень железа ассоциирован с риском онкозаболеваний? Дело в том, что перекись водорода, являющаяся естественным продуктом генерации аденозинтрифосфата (АТФ) в митохондриях, при повышенном уровне железа, становящимся катализатором так называемой «реакции Фентона», превращается в крайне опасные гидроксильные свободные радикалы, которые повреждают ДНК митохондрий, белки, мембраны и усиливают воспалительные процессы, индуцируя различные хронические заболевания. Именно повреждение ДНК митохондрий способствует возникновению онкозаболеваний.
В медицине используются несколько показателей для оценки уровня железа в крови: ферритин, железо, общая железосвязывающая способность сыворотки крови, насыщение трансферрина железом. Железо в сыворотке крови определяет объем циркулирующего в организме железа, а способность трансферрина к переносу железа показывает общая железосвязывающая способность сыворотки крови.
Весомым средством для вывода железа из организма является молочная кислота и продукты, ее содержащие, например квашеные овощи без добавления соли. Молочная кислота существенно подкисляет кровь и выводит железо и токсины. Связывают свободные молекулы железа фиолетовые и синие ягоды и фрукты. Необходимо также помнить, что из растительной пищи железо усваивается в несколько раз меньше, чем из мясной, которое существует в форме гемового железа.
Следует также ограничить употребление продуктов, способствующих усвоению железа: кислые продукты, в том числе кислоты, содержащиеся в овощах и фруктах, яблочный уксус, красный виноград, красное вино, арахис, какао-бобы, черника, яблоки, груши, кизил, хурма, коричневый рис, слива, яйца, орехи (все виды), бобовые (чечевица, горох, фасоль), овощи и зелень (брокколи, шпинат, спаржа), сухофрукты (инжир, курага, чернослив, изюм), злаки (гречка, рожь, ячневая крупа), продукты, содержащие в большом количестве витамины С и В, особенно В12. Много железа содержится в мясных продуктах: говядине, баранине, субпродуктах, языке, кролике и т. д. Чем темнее мясо, тем больше в нем железа. Кстати, речная рыба в отличие от мясных продуктов содержит незначительное количество железа. Важно также подвергать все блюда длительной термической обработке. Не следует часто употреблять яичный желток, петрушку, рыбу и морепродукты. Кальций, магний и цинк конкурируют с железом и эффективно снижают его усвоение. Кукуруза, соя, пшеница, щавелевая кислота, содержащаяся в шпинате, чернике, щавеле также ослабляют всасывание железа.
Необходимо также воздерживаться от приготовления пищи в железных посудах, так как железо из них может попадать в пищу. Важно избегать употребления продуктов, подвергшихся промышленной переработке, например белого хлеба, обогащенного железом. К сожалению, при производстве продуктов применяют низкокачественное неорганическое железо, которое значительно более опасно, чем даже его гемовая форма, содержащаяся в мясе. Лучше воздержаться от питья ключевой воды, богатой железом. Какие вещества уменьшают усвоение железа, и какие способствуют всасыванию железа?
К наиболее известным веществам, снижающим всасывание негемового железа относятся:
– соевый белок;
– фитаты (фасоль, крупы);
– кальций;
– пищевые волокна;
– вещества, содержащиеся в бобах, орехах, чае, кофе.
Способствуют всасыванию негемового железа:
– витамин С (или аскорбиновая кислота);
– животный белок (красное мясо, мясо птицы, рыбы).
В 2012 году были завершены два крупных исследования, осуществленных специалистами Гарвардского университета, в которых приняли участие начиная с 1976 года 120 тыс. женщин и 50 тыс. мужчин, которые придерживались заранее оговоренного определенного рациона питания. В результате исследования была установлена связь между употреблением в пищу красного мяса и других мясных продуктов и высоким риском онкологических и сердечно-сосудистых заболеваний13. Возник естественный вопрос, что такого находится в мясе, что так увеличивает риск этих заболеваний? Предположительный ответ – гемовое железо, способное действовать как прооксидант, создавая онкогенные свободные радикалы. Таким образом получается: если уровень железа низкий, то нарушается доставка кислорода к тканям и возникает анемическая гипоксия и, как мы покажем в дальнейшем, – стресс-реакция на гипоксию и, как следствие, индукция ангиогенеза, дезактивация апоптоза и повышение инвазивности и метастатического потенциала уже существующих опухолей. Если же возникает избыток железа, то митохондрии становятся дефектными и также повышается риск онкозаболеваний. Следовательно, критически важно поддерживать уровень железа на нормальном уровне.
В организме человека предусмотрена система регулирования уровня железа в крови. Если возникает недостаток железа, то организм повышает процент всасываемого железа, а если возникает избыток – снижает. К сожалению, этот механизм реализуется исключительно для негемового железа. Более того, организм более чем в пять раз эффективнее блокирует абсорбирование излишка железа, содержащегося в растительной пище, чем в мясной14. Предполагается, что именно поэтому существует корреляция избытка гемового железа с раком15. Высокая концентрация ферритина, формы, в которой организм накапливает железо, определяется у многих онкопациентов, причем чем больше его значение, тем агрессивнее опухоль и хуже клинический исход16. Иногда врачи, не определив предварительно уровень ферритина, назначают онкобольным, особенно при жалобах на усталость, добавки железа. Однако результаты исследований показывают, что железо стимулирует рост некоторых видов рака17, так что это не самое разумное предписание. Считается, что гемовое железо также увеличивает риск возникновения диабета второго типа18.
Можно ли устранением избытка железа уберечься от рака? В работе19 показано, что те, кто регулярно сдают кровь, что в свою очередь снижает содержание железа в крови, в два раза уменьшают риск возникновения рака кишечника. Таким образом становится понятно, что нормальный уровень железа крайне важен для снижения риска как сердечно-сосудистых, так и онкологических заболеваний.
Хотя повышенное содержание железа в крови негативно сказывается на здоровье, его недостаток тоже носит отрицательный характер. Человек начинает ощущать недостаток энергии, усталость, происходит нарушение концентрации внимания, снижение памяти, нарушение координации движения и т. д. Железо необходимо для клеток и функционирования митохондрий. Железо является атрибутом множества белков и ферментов, участвующих в разрушение и утилизации токсинов, в трансформации калорий в энергию, в работе иммунной системы. Симптомами недостатка железа являются:
– головокружение, шум в ушах, мелькают мушки перед глазами;
– вкусовые изменения (например, желание съесть мел), нравятся странные запахи (ацетон, бензин);
– слоятся и ломаются ногти, стали плоскими, с поперечными полосками, могут принимать вогнутую форму;
– выпадение волос и/или их медленный рост;
– сухая бледная кожа, шелушение;
– трещины в уголках рта;
– хрупкие зубы, шероховатая блеклая эмаль, «лаковый язык»;
– трудности с глотанием сухой или твердой пищи;
– одышка;
– нарушение ритма сердечных сокращений;
– слабость (гипотония (мышечная, артериальная);
– пигментация кожи цвета кофе с молоком.
Для повышения уровня железа в крови необходимо употреблять продукты питания, богатые железом. Как известно, железо может быть в гемовой (содержится в продуктах животного происхождения) и негемовой форме. Ниже в приведен список продуктов животного происхождения, содержащих железо, из расчета на 100 г20:
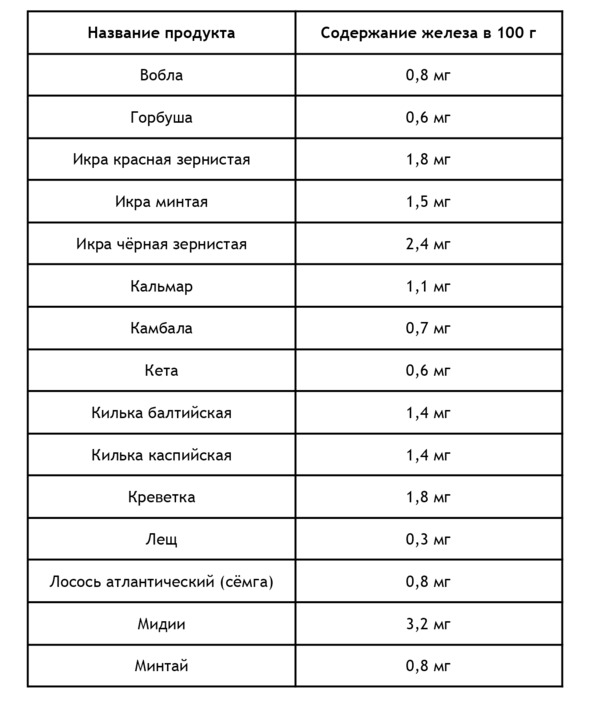
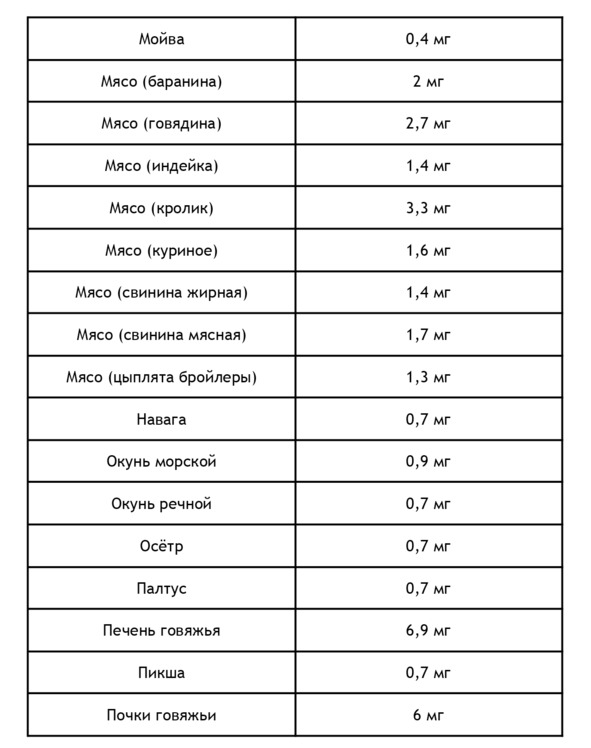
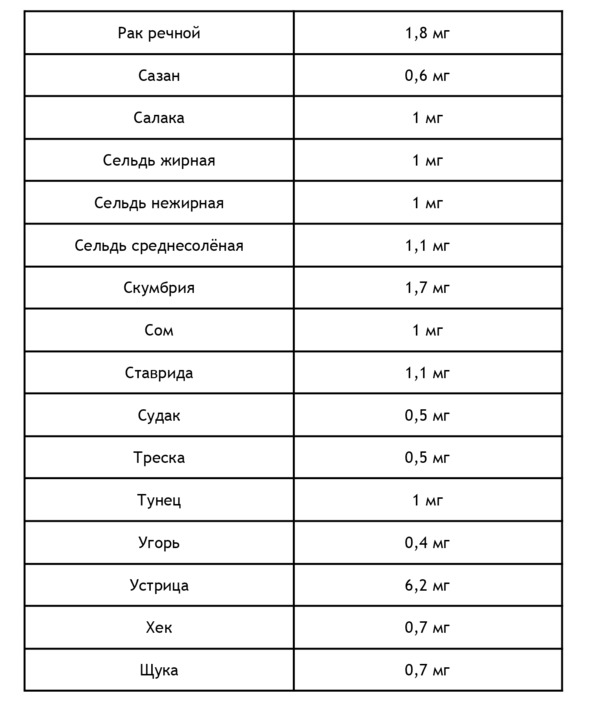
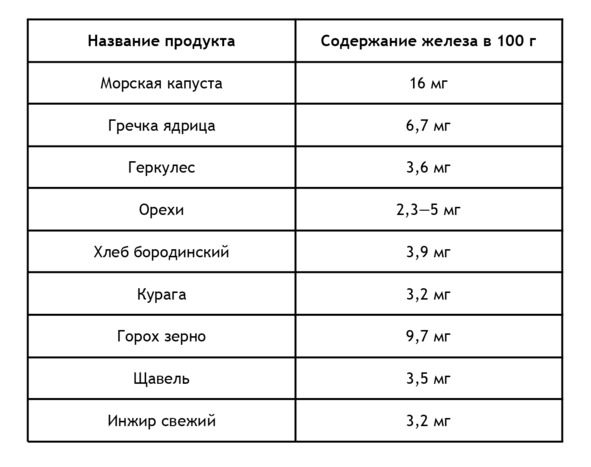
Негемовое железо содержится в продуктах растительного происхождения, правда его биодоступность составляет лишь 10%. Содержание железа в продуктах растительного происхождения из расчета на 100 г21:
Так же, как и в случае необходимости снижения уровня железа, для его повышения важно не только употреблять продукты богатые железом, но учитывать их усвоение кишечником. Для успешного усвоения железа (кроме нормальной секреции желудочного сока) необходимы:
– Витамины, А и С.
– Витамины группы В в виде активных форм.
– Хром, кремний, цинк, медь, марганец, молибден, йод.
– Биофлавоноиды.
– Коэнзим Q10.
– Селен. Селен необходим, так как активные ферменты, которые формируют гемоглобин, содержат селен.
Ягоды с высоким содержанием железа из расчета на 100 г и процент суточной потребности22:
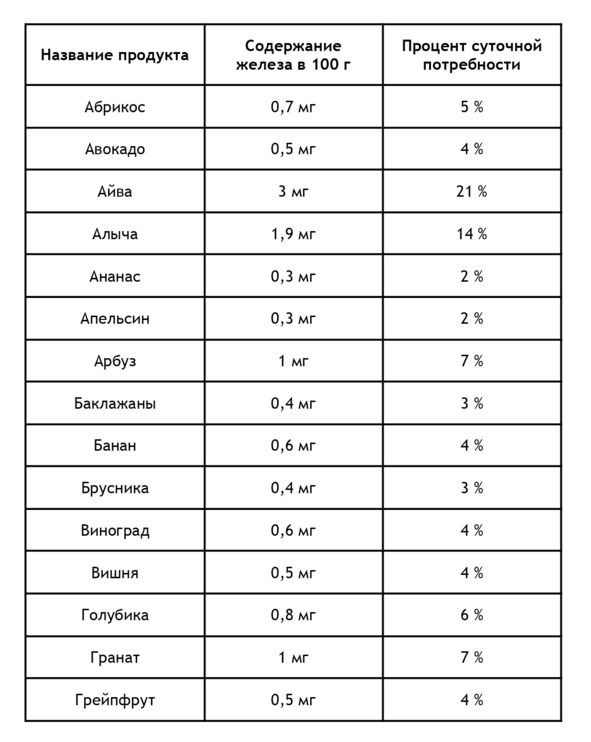
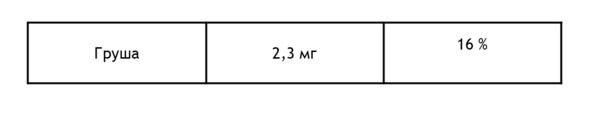
При обнаружении недостатка железа необходимо:
– Нормализовать состояние кишечника, для чего надо вывести паразитов, кандидов, другую патогенную флору, заболевания желудочно-кишечного тракта.
– Устранить гинекологические проблемы (у женщин).
– Нормализовать уровень белка в крови.
– Употреблять необходимые кофакторы для повышения усвоения железа из продуктов питания.
Гомоцистеин и холестерин
Гомоцистеин является крайне важной аминокислотой, обеспечивающей синтез, развитие и регенерацию клеток организма. Он содержится во всех клеточных структурах. Гомоцистеин образуется в организме из другой аминокислоты – метионина, находящегося в основном в продуктах животного происхождения: в мясе, молоке, рыбе, яйцах, а также в бобах, фасоли, чечевице, сои. Как повышение, так и снижение уровня гомоцистеина негативно сказывается на здоровье. Эта аминокислота очень токсична. Патологическое влияние гомоцистеина заключается в поражении внутренней стенки артерий, в результате чего образуются повреждения: «оцарапывания» или разрывы внутреннего слоя стенки сосуда – эндотелия. Этот разрыв «цементируется» с помощью холестерина и других липидов, что зачастую и является причиной развития атеросклероза. Так, обширное исследование пациентов, госпитализированных из-за сердечного приступа в США, обнаружило, что у 75% уровень холестерина был в пределах нормы. Это исследование выявило, что самым точным предвестником смерти от сердечно-сосудистых заболеваний (ССЗ) является высокий уровень гомоцистеина. Две трети пациентов с уровнем гомоцистеина более 13 ммоль/литр уходили из жизни в течение пяти лет. Более того, гомоцистеин теперь считается наиболее достоверным прогнозом риска преждевременной смерти от всех причин. Так, например, при эффективной терапии онкологического заболевания уровень гомоцистеина понижается, а если лечение не дает положительного эффекта, он повышается. Вообще, шансы на долгую жизнь тем выше, чем ниже уровень гомоцистеина.
Кроме того, при выходе уровня гомоцистеина из референтных значений могут наступать нарушения со стороны почек (и наоборот заболевание почек способствуют росту уровня гомоцистеина, так как примерно 70% гомоцистеина в почках преобразуется обратно в метионин), легких, структур сердца, эндокринных органов. Негативное влияние гомоцистеина на этом не заканчивается. Гомоцистеин ингибирует действие антитромбина, что вызывает повышение тромбина в крови и усиление активности свертывающей системы, что приводит в свою очередь к повышенному риску тромбообразования. Избыток гомоцистеина может вызывать окислительный стресс, генетические мутации, апоптоз клеток, повреждать нервные клетки и митохондрии, метилизацию ДНК. Гомоцистеин блокирует взаимодействие тромбомодулина с тромбином, в результате чего блокируется активация протеина С, играющего важную роль в антикоагулянтной системе.
В организме гомоцистеин осуществляет следующие основные функции:
– Обеспечение метаболических процессов. Без необходимого содержания гомоцистеина обмен белков, жиров и других соединений становится неполноценным.
– Поддержание в нормальном состоянии внутренней выстилки артерий, вен, капилляров. Без необходимой концентрации данной аминокислоты сосуды тоже могут разрушаться.
– Являясь строительным материалом, гомоцистеин способствует синтезу с нуля и реструктуризации клеток, а также обеспечивает эластичность и прочность цитоплазматических мембран.
– Опосредованно гомоцистеин способствует быстрому и качественному току жидкой соединительной ткани.
Для организма опасны обе ситуации и превышение и понижение концентрации данной аминокислоты. Повышенные уровни гомоцистеина связаны с такими заболеваниями, как:
– сердечно-сосудистые заболевания;
– хроническая сердечная недостаточность;
– инсульт;
– мигрень;
– возрастная макулярная дегенерация;
– потеря слуха;
– атрофия мозга;
– болезнь Альцгеймера.
Почему может расти уровень гомоцистеина? Как правило, он повышается с возрастом, при нарушении в работе фолатного цикла, при изменениях в работе почек, из-за чего он плохо выводится из организма, при недостатке в организме витаминов группы В, при гипотиреозе, при чрезмерном употреблении продуктов, содержащих метионин, – прежде всего мяса, молочных продуктов, яиц, при избыточном употреблении кофе (более 3—5 чашек в день), при псориазе, гормонозависимых заболеваниях, курении и т. д.
Под фолатным циклом понимается совокупность сложных биохимических реакций, в результате которых происходит трансформация фолиевой кислоты, поступающей в организм с пищей в ее активную форму. В активной форме фолиевая кислота принимает участие в обмене гомоцистеина и уменьшает его концентрацию в крови. Существует еще один путь обезвреживания гомоцистеина – превращение его в цистоционин с участием пиридоксальфосфата. Оба эти превращения координируются S-аденозилметионином (SAM).
Для полноценной реализации фолатного цикла требуются определенные ферменты: метилентетрагидрофолатредуктаза (MTHFR), метионинсинтаза (MTR), метионинсинтазаредуктаза (MTRR), цистатион-B-синтаза (ЦВС), транспортер фолатов (SLC19A1). Эти ферменты, как и все другие белки, закодированы одноименными генами, которые называются генами фолатного цикла. Эти гены могут иметь свои особенности, так называемые полиморфизмы, и у каждого они могут быть свои. Причиной полиморфизма генов являются различные модификации в молекуле ДНК, приводящие к изменению свойств гена и, как следствие, к изменению производимых белков, ферментов и т. д. Модификации в молекуле ДНК происходят вследствие того, что в процессе митоза клетка в первую очередь копирует свою ДНК так, чтобы новая клетка получила идентичный набор генетических инструкций. Однако в процессе репликации могут возникать ошибки («опечатки»), которые и приводят к возникновению изменений (полиморфизму) в последовательности ДНК. Эти полиморфизмы оказывают сильное влияние на очень важный для организма процесс метилирования.
Метилирование – это присоединение одного атома углерода и трех атомов водорода (называемых метильной группой CH3) к другой молекуле. В организме человека за секунду происходит около миллиарда реакций метилирования. От метилирования зависит процесс выработки энергии, гормональный баланс, иммунный ответ, процессы восстановления нервов, хрящей, ДНК, баланс нейротрансмиттеров, скорость старения организма, стабильность химического состава тела, сохранение памяти, и, что очень важно, – риск сердечно-сосудистых и онкологических заболеваний, и многое другое. Метильные группы осуществляют контроль: процессов воспаления, детоксикации токсичных микроорганизмов, выработки глутатиона, производства лимфоцитов, процессов экспрессии и репрессии генов, стресс-реакции организма и т. д. Таким образом крайне важно, чтобы метилирование происходило с максимальной эффективностью, так как от него зависит слишком большое количество химических реакций в организме. Возникает вопрос: а при чем здесь гомоцистеин? Дело в том, что эффективность метилирования как раз определяют по уровню гомоцистеина. Желательно, чтобы он был меньше 8 ммоль/л, хотя некоторые лаборатории прописывают как норму значительно более высокие значения. Правда, в последние годы происходит ревизия нормы гомоцистеина и уменьшение ее верхнего значения до 12 мкмоль/л.
Считается, что гены даны человеку при рождении, и изменить уже ничего нельзя. Правда техническая возможность таких изменений в настоящее время существует, но вмешиваться в этот процесс на данном этапе очень опасно ввиду неизученности плейотропного эффекта, оказываемого каждым геном. Но как выяснилось сравнительно недавно, гены можно включать и выключать, можно усиливать их действие и можно уменьшать их активность. Более того, большинство генов, находящихся в ядерном ДНК во всех клетках, почти все время выключены. В противном случае гены, находящиеся в клетках, например, мышц, стали бы производить в них и белки, необходимые для формирования зубов. Все клетки одного человека обладают одной и той же ДНК, и, следовательно, одними и теми же генами. Различия между клетками заключаются в том, какие конкретно гены активны и насколько они активны. Таким образом, в каждый конкретный момент в клетке активны лишь те гены, которые ей в этот момент необходимы, остальные гены инактивированы. Включение и выключение генов производится различными методами, один из которых заключается в присоединении к определенным участкам ДНК метильных меток. Более конкретно, при метилировании CH3 добавляется в С5 позиции к цитозиновому кольцу, являющемуся частью CpG—динуклеотида (два нуклеотида соединяясь путем конденсации образуют динуклеотид). В дальнейшем, возможно, ферменты окислят метилированный цитозин и в результате деметилирования превратят его обратно в цитозин. Это и есть метилирование ДНК, которое осуществляется белками, называемыми метилтрансферазами. Метилирование ДНК инактивирует экспрессию эндогенных ретровирусных генов, встроенных в геном хозяина, и тем самым нейтрализует их. Но самое главное – метилирование ДНК оказывает самое непосредственное влияние на развитие практически всех типов онкозаболеваний. Установлено, что метилирование в раковых клетках сильно отличается от нормальных в основном за счет деметилирования генома и локального гиперметилирования в области генов-онкосупрессоров, что приводит к их блокированию. Вообще метилирование ДНК является важным маркером для диагностики онкологии ввиду следующих причин:
– Метилирование – одно из ранних событий в канцерогенезе.
– Метилирование генов, вовлеченных в канцерогенез, отсутствует в ДНК из нормальных тканей.
– Определенное число генов, вовлеченных в канцерогенез, инактивируется вследствие метилирования.
– В настоящее время существуют эффективные методы, позволяющие проводить анализ метилирования ДНК.
В качестве примера, выявление метилирования гена p16 в гиперплазированном эпителии бронхолегочной системы может свидетельствовать о возникновении рака легких за 3—5 лет до клинических проявлений.
Полиморфизмы в генах, по инструкциям которых производятся ранее перечисленные ферменты фолатного цикла, оказывают определенное влияние на процесс метилирования. Однако самые серьезные последствия, особенно когда речь идет о риске возникновения рака, оказывают вариации в гене MTHFR, которые имеются примерно у 50% населения. Этот ген кодирует одноименный фермент MTHFR, мутации в котором, как доказано в многочисленных исследованиях, повышают риск возникновения различных видов онкозаболеваний, в том числе рака молочной железы, причем не в меньшей степени, чем мутации в печально известном гене BRCA23. Подтверждением данного факта является то, что в онкоклетках постоянно обнаруживают изменения в профиле метилирования ДНК. Уменьшение метилирования ДНК (гипометилирование) может привести к высокой активности онкогенов и развитию рака, а гиперметилирование (избыточная экспрессия) – к заглушению (сайленсингу) генов-супрессоров, которые способствуют сдерживанию развития опухолей. Надо иметь в виду, что мутации в гене MTHFR могут снизить активность соответствующего фермента до 70% ниже нормы. Фермент MTHFR преобразует фолат (витамин В9) в биологически активную форму – метилфолат, который необходим как источник углерода, используемого для производства метильных групп, осуществляющих репрессию определенных генов. Вообще фолат необходим для многих функций. Он участвует в образовании оснований ДНК – аденина и гуанина, он необходим для синтеза ДНК, для формирования клеток, для производства красных кровяных телец, для метаболизма, для исключения дефектов нервной трубки плода и расщепления позвоночника. Недостаточное содержание фолатов в пище может не только привести к множеству патологических состояний (фолат-дефицитной анемии, тревожности, заболеваниям щитовидной железы, утомляемости, повышенному риску выкидышей), но и снизить процесс метилирования ДНК, т. е. привести к гипометилированию.









