 полная версия
полная версияДолгая жизнь с муковисцидозом

Европейское общество муковисцидоза
Долгая жизнь с муковисцидозом
Благодарности
Редакторы хотели бы выразить свою искреннюю благодарность за постоянную помощь, которую Кристин Дюбуа оказывала в течение всего времени создания настоящего руководства, и без которой написание этой книги было бы невозможным. Мы также хотели бы поблагодарить профессора Крис Де Бёк за ее постоянные советы и поддержку. Также благодарим Дэвида Дебисшопа за перевод сообщений пациентов на французский язык. Наконец, мы хотели бы выразить свою признательность группе медицинских писателей и компании K.I.T. Group GmbH за предоставление таких эффективных и полезных услуг.
Предисловие
«Долгая жизнь с муковисцидозом» – уже само это название не может не радовать. Действительно, в развитых странах число взрослых людей, страдающих MB, в настоящее время превышает число детей с MB.
Большая благодарность Доминику Хаберту и Николасу Симмондсу за сведение всех материалов воедино в одну книгу. Они провели большую работу по определению необходимых глав книги. Затем они выявили необходимых авторов и мотивировали их не только представить обзор базы литературных данных, но также поделиться с читателями своим личным опытом. Конечным результатом стала книга, которая представляет большой интерес и легко читается.
Надеемся, что эта книга поможет привлечь внимание большего числа врачей, оказывающих медицинскую помощь взрослым, к проблеме MB. При постоянно увеличивающемся числе взрослых, страдающих муковисцидозом, во всех странах существует острая необходимость подготовки молодых терапевтов – специалистов по комплексному лечению взрослых, страдающих муковисцидозом.
Европейское общество муковисцидоза (ECFS) с радостью представляет книгу «Долгая жизнь с муковисцидозом» всем членам ECFS.
Крис Де Бёк, доктор медицины, профессор, Президент Европейского общества муковисцидозаВведение
За последние несколько десятилетий демография муковисцидоза (MB) значительно изменилась, при этом в наиболее развитых странах медиана продолжительности жизни составляет около 40 лет. Эта патология больше не является болезнью исключительно детского возраста, поскольку во многих регионах число взрослых, живущих с диагнозом «муковисцидоз», превышает число детей с данным диагнозом. Хотя это не может не радовать, важно также признать, что при таком увеличении продолжительности жизни у пациентов и лиц, оказывающих им помощь, возникает ряд новых проблем. Именно поэтому после издания в 2012 г. первой книги «Медицинские вопросы и проблемы подростков, больных муковисцидозом» Европейское общество муковисцидоза приняло решение опубликовать книгу, касающуюся проблем взрослых, – «Долгая жизнь с муковисцидозом».
Наша цель состояла в том, чтобы охватить широкий круг вопросов оказания медицинской помощи, важных для популяции взрослых и пожилых людей, и обеспечить всем членам группы, занимающейся проблемой MB, справочный ресурс, к которому можно было бы обратиться при рассмотрении некоторых трудных вопросов, возникающих, когда люди, страдающие MB, становятся старше. Мы также хотели дать некоторое представление о предстоящих проблемах, чтобы службы здравоохранения могли шагать в ногу со временем и предоставить эффективные услуги в будущем.
Мы благодарим авторов из разных стран, которые совместно работали для составления всеобъемлющего обзора основных проблем у взрослых и которые поделились своим опытом. Мы также благодарим взрослых пациентов, которые внесли свой вклад в написание этой книги, предоставив бесценные сведения, позволяющие понять, что значит для взрослого человека жить с диагнозом «муковисцидоз».
Доминик Юбер и Николас Симмондс (Dominique Hubert, Nicholas Simmonds)Глава 1
Изменения в эпидемиологии: новые проблемы, связанные с МВ
Nicholas Simmonds, Barry Plant
Введение
За семь десятилетий, прошедших с того времени, когда был впервые описан муковисцидоз (MB), произошли значительные изменения как в течении болезни, так и в выживаемости пациентов. Улучшение нашего понимания естественного развития MB, а также прогресс в диагностике и лечении привели к тому, что большинство пациентов в настоящее время достигают взрослого возраста и пользуются многими возможностями трудоустройства, имеют социальные и личные достижения, которые их здоровые сверстники воспринимают как само собой разумеющиеся. Хотя такие изменения не могут не радовать, мы также должны знать проблемы взрослеющей популяции пациентов и представлять себе вопросы, связанные с увеличением нагрузки на систему здравоохранения, с осложнением болезни сопутствующими заболеваниями, с увеличением возраста, а также с назначением антибиотиков и развитием инфекций. В настоящей главе обсуждаются эти новые проблемы и предлагаются подходы для управления течением заболевания в популяции взрослых пациентов с MB в будущем.
1. Изменение демографических показателей
Со времени первого описания MB как отдельной нозологической формы патологоанатомом Дороти Андерсен в 1938 г. демографические показатели популяции пациентов изменились до неузнаваемости[1]. В то время диагноз был страшным, и более 70 % детей умирали в течение первого года жизни, обычно от мекониевой непроходимости кишечника, тяжелого нарушения питания и/или дыхательной недостаточности. Болезнь первоначально называли «кистозным фиброзом поджелудочной железы», поскольку деструкция поджелудочной железы считалась основным нарушением, а проявления со стороны дыхательной системы рассматривались как вторичное осложнение нарушения всасывания. С тех пор наше понимание патофизиологии и механизмов, лежащих в основе заболевания, значительно улучшилось, однако конечную цель лечения еще предстоит осознать. К счастью, смерть в детском возрасте теперь является редкой и ожидаемая продолжительность жизни постоянно увеличивается (рис. 1)[2].
В США медиана выживаемости увеличилась с 14 лет в 1968 г. до 20 лет в середине 1970-х гг.[3]. Среднее значение прогнозируемой продолжительности жизни во многих развитых странах в настоящее время составляет более 40 лет, но только в последние 30 лет достижение взрослого возраста стало реальной перспективой для большинства пациентов. Сейчас мы переживаем период, когда число взрослых с MB скоро превысит количество детей[4]. Это уже фиксируется в регистрах, где взрослым считается человек достигший 16, а не 18 лет; например, в ежегодном отчете за 2012 г. в Великобритании 57,6 % всех пациентов с MB были классифицированы как взрослые[5]. Появление национальных и многонациональных регистров, в которых собираются большие объемы клинических данных, стало инструментом для улучшения нашего понимания MB и изменений демографических показателей. Регистр пациентов Фонда муковисцидоза США (CFFPR) содержит данные о почти 30000 пациентах и ведется в течение нескольких десятилетий.
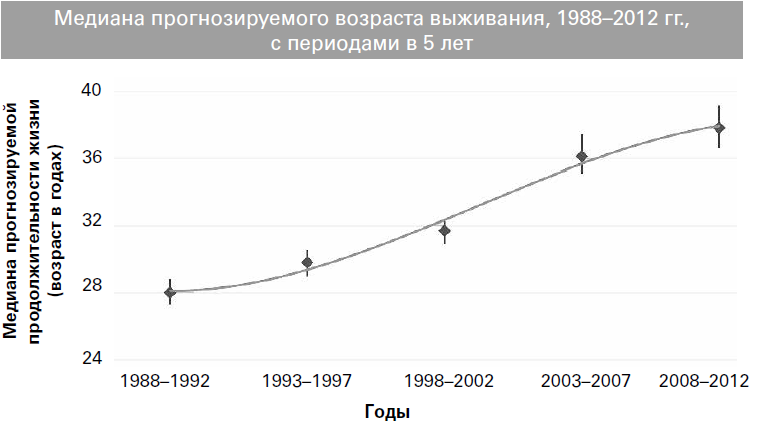
Рис. 1. Пациенты с муковисцидозом, наблюдавшиеся в центрах медицинской помощи, аккредитованных Фондом МВ в Соединенных Штатах, которые согласились на включение своих данных в регистр в 2012 г. – медиана прогнозируемой продолжительности жизни в 1986–2012 гг. с использованием 5-летних периодов по оси х для уменьшения вариабельности при сравнении данных разных лет (воспроизведено с разрешения Фонда муковисцидоза[6])
Касательно 2012 г. в регистре США сообщалось, что 49,1 % популяции составляли взрослые (18 лет и старше) при диапазоне возраста от рождения до 82 лет и медиане возраста, равной 17,7 лет (средняя – 19,8 лет)[7]. Регистр пациентов Европейского общества муковисцидоза (ECFSPR) является более новым, но в настоящее время содержит данные о более чем 32 000 пациентов из 22 европейских стран и охватывает широкий спектр социально-демографических и культурных характеристик[8]. В целом европейские данные очень сходны с данными из США: 49,3 % пациентов были классифицированы как взрослые (18 лет и старше) при широком диапазоне возраста от рождения до 80,1 лет и медиане возраста, равной 17,8 (средняя – 19,5) лет (рис. 2).
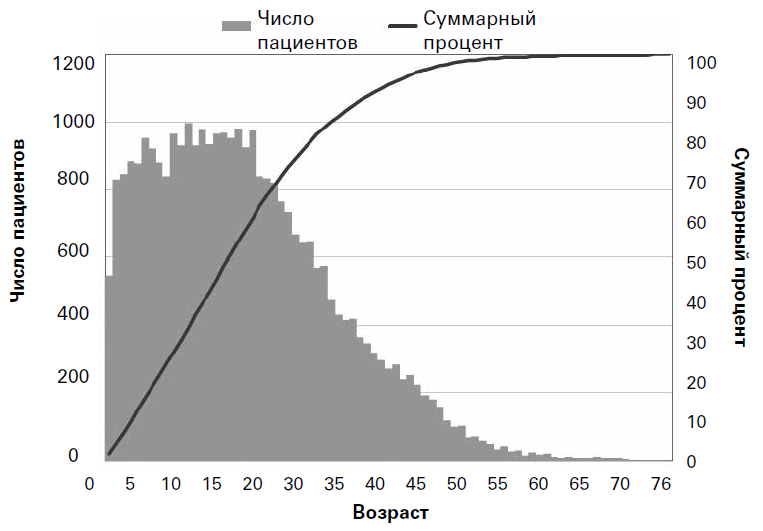
Рис. 2. Кросс-секционные данные о возрасте пациентов в Европе в 2010 г. (воспроизведено с разрешения Европейского общества муковисцидоза[9])
Каждый вертикальный столбик представляет число пациентов этого возраста в 2010 г. Суммарный процент (черная линия, правая вертикальная ось) показывает, сколько было пациентов (в процентах) младше определенного возраста (например, 50 % пациентов были младше 18 лет).
В некоторых европейских странах доля взрослых пациентов особенно высока – как в Дании, где минимум 56 % больных MB являются взрослыми (18 лет и старше). Примерно 20 % популяции Европейского регистра составляют люди в возрасте старше 30 лет и 6 % – люди старше 40 лет.
Однако существуют значимые вариации между регионами по социально-демографическим показателям, предположительно отражающие такие проблемы, как доступность медицинской помощи, поздняя диагностика, наличие средств и политика в области здравоохранения. Кросс-секционный анализ данных ECFSPR подчеркнул это, показав некоторые важные демографические различия между европейскими странами[10]. Медиана возраста пациентов из стран Европейского союза (ЕС) оказалась на 4,9 лет больше, чем в странах, не входящих в ЕС, и доля пациентов в возрасте 40 лет и старше также была более высокой в странах ЕС (5 % против 2 %). Важно то, что когда демографические показатели стран ЕС применили в моделях к странам, не являющимся членами ЕС, оказалось, что популяция пациентов с MB в этих странах может увеличиться на 84 %, что показывает поразительное потенциальное влияние, которое социально-демографические факторы могут оказывать на выживаемость. В Великобритании, согласно оценке, популяция взрослых пациентов с MB будет увеличиваться примерно на 145 пациентов в год[11]. Поскольку это соответствует числу больных в клинике для взрослых среднего размера, то имеет важные последствия не только для пациентов, но также и для обеспечения медицинской помощи и обучения персонала в будущем.
2. Почему пациенты, страдающие MB, теперь живут дольше?
Причиной стабильного роста медианы продолжительности жизни с увеличением популяции взрослых является сочетание множества факторов. Они могут быть грубо классифицированы как генетические и негенетические факторы, которые включают условия окружающей среды (например, патогенные микроорганизмы, пол, воздействие табачного дыма и климат), факторы, связанные с системой оказания медицинской помощи (например, доступ к специализированным клиникам, меры по контролю инфекций и соблюдение пациентами рекомендаций врача), и социально-экономические факторы. Вследствие этого некоторые определяющие факторы выживаемости в большей мере поддаются модификации, чем другие; например, факторы, связанные с лечением, легче контролировать, чем факторы, связанные с климатом. С 1938 г. ключевые научные достижения, в том числе выявление повышенного содержания хлоридов в потовой жидкости в 1950 г. и открытие гена MB (регулятора трансмембранной проводимости при муковисцидозе (СFТR)) в 1989 г., являлись инструментами для улучшения нашего понимания патофизиологии MB[12][13][14]. Однако даже до этих событий имело место значительное улучшение оказания помощи в результате тщательного клинического наблюдения и системного подхода к лечению осложнений болезни (например, инфекции и недостаточности питания). Недостаточное питание, инфицирование патогенными микроорганизмами, такими как Pseudomonas aeruginosa и Burkholderia cenocepacia, отсутствие лечения диабета, связанного с MB, и женский пол являются точно установленными факторами, коррелирующими с более неблагоприятными исходами при MB[15][16][17][18].
Краеугольными камнями лечения в течение многих лет были внедрение интенсивных схем антибиотикотерапии, применение ферментов поджелудочной железы и оптимизация питания, эффективное очищение дыхательных путей, трансплантация легких, противовоспалительные препараты, препараты, усиливающие удаление мокроты (например, дорназа альфа), и, позже, внедрение специфических препаратов, воздействующих на CFTR при разных типах мутаций[19][20][21][22]. Эти факторы в сочетании с многоуровневым подходом к помощи при MB, обеспечиваемым мультидисциплинарной группой специалистов (MDT), играли главную роль в увеличении продолжительность жизни пациентов и послужили моделью для лечения других хронических заболеваний[23].
Когда был открыт ген CFTR, предположили, что некоторую вариабельность выживаемости при MB можно объяснить различиями мутаций; однако неоднократно было показано, что корреляция генотипа с фенотипом является слабой, за исключением состояния поджелудочной железы (например, достаточная функция или нарушенная)[24]. Мутации CFTR можно разделить на шесть классов в соответствии с их влиянием на функцию CFTR. Классы I–III обычно связаны с более тяжелым течением заболевания. В типичном случае у пациента, являющегося носителем одной из этих мутаций на каждой аллеле, MB диагностируется рано (т. е. в возрасте младше 1 года), и у него имеет место недостаточность поджелудочной железы[25][26]. Заболевание у пациентов с по меньшей мере одной мутацией классов IV–VI часто диагностируется позже, функция поджелудочной железы у них нередко сохранена и поэтому состояние питания лучше[27][28]. Некоторые мутации, связанные с сохранением функции CFTR, проявляются как нетяжелое поражение легких, но для огромного количества других мутаций это не так, и могут иметься различия между двумя субъектами с одним и тем же генотипом[29]. Предполагаемые механизмы для объяснения этого факта включают многочисленные влияния инфекций, питания и окружающей среды, хотя, вероятно, ни один из этих механизмов полностью не объясняет различия[30]. Мутации других генов (не CFTR) или полиморфизмы – обозначаемые термином «модификаторы генов» – по-видимому, вносят свой вклад в ситуацию, но до настоящего времени идентифицировано лишь ограниченное число модификаторов[31][32][33].
Совершенствование диагностики MB также повлияло на увеличение выживаемости. Даже у пациентов с атипичными признаками лучшее понимание механизмов, лежащих в основе заболевания, и разработка более чувствительных методов исследования, таких как секвенирование генов, привели к улучшению диагностики. В большинстве случаев диагностика является простой и подтверждается, если у субъекта имеется по крайней мере один фенотипический признак (например, распространенные бронхоэктазы), данные о нарушении функции CFTR (например, по результатам потовой пробы) и/или две распознанные мутации CFTR[34][35]. Однако, поскольку проявления болезни при MB очень вариабельны, постановка диагноза не всегда проста, и это особенно верно в отношении взрослых, впервые обратившихся за медицинской помощью. Такие пациенты иногда представляют проблему при диагностике, поскольку у них может наблюдаться сомнительный (или нормальный) уровень хлоридов в поте и только одна идентифицируемая мутация CFTR (или даже ее отсутствие) при генотипировании первой линии[36]. В таких случаях обычно имеет место достаточная функция поджелудочной железы, и болезнь при этом часто называют «неклассическим» или «атипичным» MB. У подобных пациентов болезнь может впервые проявиться симптомами, не связанными с легкими, и вследствие этого они иногда впервые попадают в поле зрения врачей в клиниках непульмонологического профиля, как, например, мужчины с азооспермией в клинических центрах репродуктивного здоровья. По этой причине диагноз иногда ставится с промедлением (зачастую на многие годы), что может вызывать чувство неудовлетворенности и тревогу. Поскольку во многих странах в настоящее время стандартно проводится скрининг новорожденных, частота запоздалой диагностики в будущем значимо снизится. Однако вместо этого появится ряд новых проблем, связанных с выявлением пациентов, у которых симптоматика отсутствует и болезнь может оставаться бессимптомной в течение многих лет. Результаты этого у пациентов с неклассическим MB, у которых может иметь место более низкий риск развития болезни с развернутыми проявлениями, очень разнообразны и включают нагрузку на систему здравоохранения вследствие проведения исследований, посещения клиник и лечения, а также психологическую нагрузку на пациентов и их семьи. Однако если в итоге состояние здоровья пациентов улучшается и их выживаемость растет, как показывают исследования классического MB[37], то скрининг новорожденных будет оправданным. Следующие 40 лет дадут решающие данные в этой дискуссии.
Результатом роста выживаемости является увеличивающееся старение популяции пациентов с MB. Сообщения пациентов в возрасте старше 40 лет позволяют выявить их характеристики и потенциальные причины долголетия[38][39][40]. Несмотря на то что у более высокой доли пациентов, чем в общей популяции больных с MB, заболевание классифицировано как неклассический MB, исследования показывают, что многие пациенты с классическим заболеванием также достигают возраста 40 лет и более[41][42]. Международное исследование 366 пациентов в возрасте старше 40 лет выявило, что 68 % пациентов имели недостаточность функции поджелудочной железы и 33 % являлись гомозиготными по мутации F508del[43]. Подгруппа пациентов из США и Великобритании включала более высокую долю пациентов с классическим заболеванием, при этом у 81 % отмечалась недостаточность функции поджелудочной железы и 44 % имели гомозиготный генотип по мутации F508del[44]. В целом факторы, обеспечивающие общее увеличение выживаемости, как обсуждалось выше (например, улучшение питания и отсроченное инфицирование P. aeruginosa)[45], вероятно, являются наиболее важными детерминантами долголетия, но могут быть значимыми и другие факторы, которые трудно оценить количественно, такие как физическая нагрузка и образование. По мере того как пациенты становятся старше, их потребности, по-видимому, растут, и системе обслуживания будет необходимо адаптироваться для их удовлетворения. Эти вопросы и некоторые проблемы, связанные с удовлетворением таких меняющихся потребностей, обсуждаются ниже.
3. Проблемы, связанные с большей ожидаемой продолжительностью жизни
3.1. Нагрузка, связанная с лечением
Повышение выживаемости увеличивает нагрузку, связанную с лечением, что представляет собой новую растущую проблему для пациентов, персонала, оказывающего им медицинскую помощь, и системы финансирования здравоохранения. При постоянно увеличивающемся числе назначаемых лекарств вопросы приверженности к лечению, по-видимому, остаются постоянной и важной проблемой. Например, в течение многих лет ингаляционные препараты являлись неотъемлемой частью контроля состояния дыхательных путей при MB[46][47][48], и в настоящее время имеется множество различных лекарств, которые доставляются этим путем (например, антибиотики и муколитики). Однако их польза вне рамок клинических испытаний основана на допущении должной приверженности к лечению в «реальном мире». Группа исследователей из Великобритании сравнивала уровни приверженности к лечению согласно собственной оценке пациентов и по сообщениям врачей, а также фактическую приверженность при использовании электронного мониторинга с помощью небулайзерной системы l-Neb[49] и показала, что медиана фактической приверженности по результатам загрузок l-Neb составила всего 36 % по сравнению с 80 % по оценке приверженности самими пациентами. Недавние данные по повторному заполнению небулайзеров, полученные в ходе другого исследования, показали, что у пациентов с высокой приверженностью к лечению антибиотиками с помощью небулайзера наблюдалось значимое сокращение числа госпитализаций по сравнению с субъектами с более низкой приверженностью, что демонстрирует пользу в реальных условиях[50]. Однако существенными являются затраты времени, связанные с достаточной приверженностью к лечению: в недавнем исследовании в США среднее время, затраченное на выполнение процедур в день (исключая очистку), составляло 108 минут, если пациенты выполняли все назначения[51].
Для пациента является проблемой соблюдение всех лечебных назначений с целью максимально увеличить шансы благоприятного исхода заболевания. Специалисты, предоставляющие медицинские услуги, и практикующие врачи должны поддерживать эти усилия и, при наличии возможности, переходить к системам доставки и лекарственным формам (например, сухим порошкам), которые сводят к минимуму время, необходимое на лечение, и, следовательно, нагрузку на пациента. Системы быстрой доставки[52][53][54] являются многообещающими, и данные, полученные из реальной практики, подтверждают связь между устойчивой приверженностью к лечению и его эффективностью[55]. Новой проблемой для пациентов с MB и медицинского персонала, оказывающего помощь, является поддержка этих усилий в условиях, когда у некоторых пациентов может наблюдаться относительно меньше симптомов.
3.2. Восстановление функции CFTR
Восстановление функции CFTR нацелено скорее на причину, лежащую в основе MB, чем на последствия, и остается «святым Граалем» терапии MB. До недавнего времени это являлось основной целью исследований[56][57]. Однако появление персонализированных фармакологических потенциаторов и корректоров CFTR[58][59][60], основанных на генотипе CFTR, открывает замечательные новые возможности для всех пациентов с MB.
Ивакафтор представляет собой новый класс лекарственных препаратов (модуляторов CFTR), который недавно был лицензирован во многих регионах для лечения пациентов с MB, возраст которых составляет 6 лет и старше и у которых имеется по крайней мере одна копия «gating» («воротной») мутации G551D[61][62] или одна из восьми других мутаций (не-G551 D-gating-мутаций)[63]. В крупном 48-недельном рандомизированном контролируемом испытании, проведенном среди пациентов с MB в возрасте 12 лет и старше с по крайней мере одной копией мутации G551D, наблюдалось увеличение среднего абсолютного значения объема форсированного выдоха за 1 секунду (FEV,) на 10,6 % от прогнозируемого[64]. Аналогичные результаты были получены позже в других когортах[65][66]. Во всем мире это принесет пользу примерно 5 % от всех пациентов с MB, при этом согласно оценке это справедливо для 2000 пациентов в возрасте 6 лет и старше, являющихся носителями по меньшей мере одной копии мутации G551D, и для 400 пациентов в возрасте 6 лет и старше с по меньшей мере одной не-G551D-gating-мутаций. В данной когорте ключевой является проблема поддержания устойчивой клинической эффективности, безопасности и результативности. Данные недавно проведенного клинического испытания показали устойчивый эффект, сохраняющийся до 144 недель[67]; сведения из реальной практики многих центров также продемонстрировали устойчивые положительные эффекты[68][69][70].
Несмотря на продвижение вперед, проблемы остаются. Например, концепция «ненаращивания» других видов лечения была бы очень хорошо воспринята пациентами, а также медицинскими работниками, но в настоящее время эффективность этого неизвестна. Межлекарственное взаимодействие является важной развивающейся областью, поскольку одновременное назначение ивакафтора с сильными ингибиторами или индукторами CYP3A (ферменты, участвующие в метаболизме ксенобиотиков) соответственно значительно повышает или снижает уровни системного воздействия ивакафтора[71]. К пациентам без gating-мутаций еще предстоит разработать персонализированный подход, а противоречивые результаты порождают важные вопросы[72][73], ключевым из которых является то, как специалисты, оказывающие медицинские услуги, оценивают и регулируют ожидания пациентов в отношении этих лечебных средств.
3.3. Устойчивость к лекарствам и возникающие инфекции
В популяциях взрослых людей возрастает частота случаев устойчивости к антибиотикам[74][75], и связанные с этим токсичность, непереносимость и/или аллергия представляют собой проблемы, приобретающие все большее значение для медицинских работников[76][77]. Кроме того, многие средства для длительной терапии ранее изучались таким образом или в то время, когда эффект добавления этих препаратов к существующим лекарствам не оценивался, а также еще недостаточно изучены потенциальные межлекарственные взаимодействия[78][79]. Предполагается, что дополнительные препараты могут оказать дополнительные положительные эффекты. Однако недавнее ретроспективное исследование, в котором изучалось возможное взаимодействие между ингаляционным тобрамицином и оральным азитромицином, показало снижение эффективности и поставило важные вопросы на будущее[80]. В этой области необходима дальнейшая работа.









