
Полная версия
Тропические и паразитарные болезни
Клиническая картина. У вирусных ГЛ сходные клинические проявления, но все они различаются по этиологии и эпидемическим проявлениям. Для этих заболеваний характерны короткий инкубационный период (3-18 дней); постепенное или острое развитие симптомов интоксикации в течение трех дней, после которых развивается короткий период ремиссии на несколько часов; внезапное и быстрое ухудшение состояния на 3—4-й день болезни. Среди клинических симптомов последнего периода наиболее вероятна склонность к кровотечениям: кожные геморрагии, носовые кровотечения, кровотечения из десен. Внутренние кровотечения проявляются в виде кровавой рвоты, мелены, гематурии и вагинальных кровотечений. Вторая клиническая отличительная черта – кардиоваскулярные проявления, которые ведут к шоковому синдрому (обратимому или необратимому). Могут развиваться и другие осложнения: обезвоживание, печеночная кома, гемолиз, ацидоз, поражение центральной нервной системы (ЦНС), вторичная бактериальная инфекция.
Клиническая картина может очень сильно варьировать от легких, эфемерных форм до тяжелых, приводящих к летальным исходам. Более того, арбовирусные инфекции чаще протекают совершенно незаметно, субклинически, оставляя после себя стойкий иммунитет. Соотношение клинически выраженных и инаппарантных форм составляет от 1: 40 до 1: 400, т. е. из 40 400 заразившихся только у одного наблюдаются клинические проявления. Восприимчивость к арбовирусам высокая, особенно для приезжих лиц. Местное население переносит легкие и стертые формы.
Диагностика геморрагических лихорадок сложна. При этом учитывается:
• географический (эпидемиологический) анамнез;
• выделение вируса из крови в первые 3–4 дня (самое позднее до 7-го дня) или из тканей, полученных посмертно. Его осуществляют путем заражения мышей-сосунков (церебрально) или чувствительных клеток позвоночных или насекомых (переносчиков). После инкубации в течение 3–4 дней клетки исследуют на наличие вируса методом иммунофлюоресценции;
• серологические тесты – в динамике с интервалом в 2–3 недели, включая наиболее чувствительные методы – реакцию нейтрализации (PH), иммуноферментный анализ (ИФА), реакцию торможения гемагглютинации (РТГА). Вируснейтрализующие антитела появляются на 1-й неделе заболевания и сохраняются многие годы, а комплементсвязывающие антитела – со 2-й недели;
• гистопатология – изменения во внутренних органах не носят специфического характера.
Лечение. Больных госпитализируют в инфекционную больницу с максимальными предосторожностями, избегая сильных толчков и тряски (опасность разрыва коркового слоя почек и внутренних кровотечений). Необходим строгий постельный режим, а также диета (стол № 4) без ограничения соли. Этиотропного лечения нет. Проводится патогенетическая и симптоматическая терапия: дезинтоксикация, купирование острой почечной недостаточности и синдрома диссеминированного внутрисосудистого свертывания.
Прогноз зависит от тяжести течения заболевания (варьирует в широких пределах). В большинстве случаев при своевременной медицинской помощи прогноз благоприятен – инфекция заканчивается выздоровлением. Иногда возможно развитие терминальных состояний, которое заканчивается летально.
Профилактика. Медперсонал должен соблюдать особые меры предосторожности при контакте с пациентами, их кровью и другими биологическими жидкостями. Обязательны дератизация, дезинфекция, защита пищевых продуктов от грызунов, санитарно-просветительная работа.
Желтая лихорадка
Желтая лихорадка – острое арбовирусное заболевание, передаваемое комарами. Характеризуется высокой двухфазной лихорадкой, геморрагическим синдромом, тяжелой интоксикацией, поражением почек, печени и других органов.
Этиология. Возбудитель – вирус Viscerophilus tropicus, РНК-содержащий, относящийся к роду Flaviviridae семейства Togaviridae, является арбовирусом антигенной группы В. Диаметр вирусных частиц до 40 нм. Вирусы желтой лихорадки имеют антигенное родство со многими другими флавивирусами: лихорадки Западного Нила, японского энцефалита, лихорадки денге и энцефалита Сент-Луис. Вирус желтой лихорадки представлен одним серотипом, но двумя серологическими вариантами (африканский и южноамериканский). Он культивируется в развивающихся куриных эмбрионах и культурах тканей, вызывает заболевания у обезьян, белых мышей, а при внутримозговом заражении патогенен и для морских свинок. При длительном культивировании вируса на куриных эмбрионах получены авирулентные штаммы (например, 17-D), которые используются как вакцинальные. Вирус весьма чувствителен к действию высоких температур, губительны для них многие дезинфицирующие средства. Длительно выдерживает замораживание (сохраняется годами) и высушивание.
Эпидемиология. Желтая лихорадка относится к карантинным болезням. Случаи заболевания желтой лихорадкой регистрируются в Центральной и Западной Африке и Южной Америке (Боливия, Бразилия, Колумбия, Перу, Эквадор и др.) (рис. 1). Переносчики – комары. Известно два эпидемиологических типа желтой лихорадки: городской (антропонозный) и сельский (желтая лихорадка джунглей). В первом случае заражение комара (Aedes aegypti) происходит при укусе больного человека в конце инкубационного периода или в первые 3 дня заболевания. При сельском типе желтой лихорадки источником инфекции являются обезьяны-мармозеты, а переносчиком – комары Aedes africanus, Aedes simpsoni. Иногда источником и резервуаром инфекции служат другие дикие животные (опоссумы, редко прочие виды). Врожденного иммунитета к желтой лихорадке не существует, переболевшие приобретают стойкий пожизненный иммунитет.
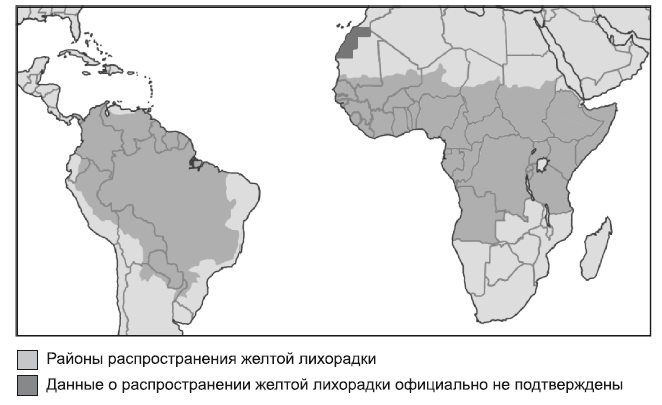
Рис. 1. Распространение желтой лихорадки по материалам ВОЗ, 2009 (Tropical Infectious Diseases, 2011)
Патогенез. Вирус желтой лихорадки проникает в организм человека со слюной при укусе инфицированным комаром, не вызывая реакции в области входных ворот. Известны случаи лабораторных заражений аэрогенным путем. От места внедрения возбудитель распространяется лимфогенным путем и достигает регионарных лимфатических узлов, где происходит его размножение и накопление в течение 3–6, реже 9-10 дней (инкубационный период). Затем вирус проникает в кровь – фаза вирусемии, которая продолжается в течение 3–5 дней. Вирус в это время распространяется практически по всем органам и тканям (печень, селезенка, почки, костный мозг, лимфатические узлы), вызывая их поражение. Развивается универсальный капилляротоксикоз, что приводит к геморрагическому синдрому, появляются множественные кровоизлияния в различных органах. Увеличивается печень, в ней происходит очаговый некроз печеночных клеток. Характерно образование телец Каунсилмена (внутриклеточные гиалиновые отложения) и Торреса (внутриядерные эозинофильные включения). В центральных зонах печеночных долек отмечают белковую и жировую дегенерацию гепатоцитов. Поражение печени проявляется синдромами цитолиза и холестаза. В основе повреждений других органов также лежат сосудистые нарушения. В почках, селезенке, миокарде, лимфатических узлах обнаруживаются отек, кровоизлияния, некроз почечных канальцев. После перенесенной болезни развивается напряженный иммунитет.
Клиническая картина. Инкубационный период колеблется от 3 до 6 суток (до 10 дней). В клиническом течении желтой лихорадки можно выделить четыре периода: начальный лихорадочный (стадия гиперемии), ремиссии, реактивный (стадия венозного стаза), реконвалесценции.
При тяжелых формах болезни период ремиссии может отсутствовать.
Характерно острое начало с выраженным ознобом и появлением сильной головной боли, болей в пояснице, спине, конечностях. Температура тела уже к концу первых суток достигает 40–41 °C и выше. Пациенты жалуются на тошноту, многократную рвоту. При осмотре обращают на себя внимание гиперемия и одутловатость лица, отечность век, инъекция сосудов склер и конъюнктив («кроличьи глаза»), слизистая оболочка полости рта гиперемирована, язык сухой, края языка покрасневшие. Пульс учащается до 100–130 в 1 мин. В дальнейшем состояние больного ухудшается, присоединяются мучительная жажда, возникают носовые кровотечения, примесь крови обнаруживается в рвотных массах и кале. К концу первого периода (3—4-й день болезни) появляется желтуха, цианоз. На 4-5-й день болезни стадия гиперемии сменяется кратковременной ремиссией: самочувствие больного улучшается, температура тела снижается до субфебрильной, но через несколько часов (иногда 1–2 сут) вновь повышается, состояние больного прогрессивно ухудшается – наступает реактивный период (период венозных стазов). Нарастает слабость, появляется бред, более выраженной становится желтуха. Геморрагический синдром усиливается: наблюдается кровавая рвота, кровотечения из носа, кишечника, матки, на коже появляются петехии и даже крупные кровоизлияния. Гиперемия лица сменяется цианозом. Пульс редкий (до 60 уд/мин), значительно отстает от температуры (симптом Фаже), АД падает. Развивается олигурия, иногда вплоть до анурии. В моче повышено содержание белка, появляются гиалиновые и зернистые цилиндры. В тяжелых случаях смерть наступает от почечной/печеночной недостаточности или инфекционно-токсического или геморрагического шока.
Если больной не погибает, то с 7-9-го дня его состояние постепенно улучшается. В легких случаях симптомы болезни не выражены, желтуха и геморрагический синдром могут отсутствовать. Наблюдаются и молниеносные формы, когда больные умирают на 3-й день и даже раньше, еще до появления желтухи.
Осложнения: пневмония, миокардит, гангрена мягких тканей или конечностей, абсцессы в различных органах, чаще в почках, сепсис в результате наслоения вторичной бактериальной микрофлоры.
Диагностика. Большое значение в диагностике имеют эпидемиологические предпосылки (пребывание в эндемичной местности, уровень заболеваемости желтой лихорадкой и др.). При лабораторном исследовании наблюдаются лейкопения, нейтропения, обнаружение белка и цилиндров в моче, увеличение содержания билирубина в сыворотке крови, остаточного азота и значительное повышение активности сывороточных аминотрансфераз (больше аспартатаминотрансфераза (ACT), чем аланинаминотрансфераза (АЛТ)). При гистологическом исследовании биоптатов печени появляются специфические изменения.
Вирусологическая диагностика: выделение вируса из биологических жидкостей (цереброспинальная жидкость, кровь, моча) путем заражения клеточных культур (культура клеток москитов, Vero) или путем введения материала в грудную полость москитов. Возможно заражение новорожденных и взрослых мышей. Идентификация вируса – в реакции нейтрализации или в полимеразной цепной реакции (ПЦР).
Иногда используют реакцию связывания комплемента (РСК), PH и РТГА, однако последняя часто дает положительные реакции и с другими вирусами. Серологические исследования проводят в динамике, результат оценивают по нарастанию титра антител.
Все шире применяется ИФА для диагностики желтой лихорадки: обнаружение антител класса IgM к вирусу желтой лихорадки, а также антигенов вируса с помощью твердофазного ИФА. Последний метод позволяет подтвердить диагноз в течение 3 ч.
Лечение. Этиотропное лечение не достаточно разработано. Можно применять препараты интерферонов, но эффект лечения неубедителен. Полезно назначение плазмы или иммуноглобулинов, приготовленных из крови доноров, перенесших желтую лихорадку.
Необходим строгий постельный режим, молочно-растительная диета, комплекс витаминов, обязательны Р-витаминные препараты. Для коррекции ДВС-синдрома назначают гепарин в дозе 20 000-60 000 ЕД/сут (внутривенно по 5000-10 000 ЕД каждые 4 ч или капельно с растворами глюкозы). Действие препарата контролируется коагулограммой. Применяют преднизолон по 40–60 мг/сут как противовоспалительное, десенсибилизирующее и сосудоукрепляющее средство, при упорной рвоте – парентерально гидрокортизон до 300 мг/сут.
Дезинтоксикационная терапия осуществляется во все периоды болезни. Основа патогенетической терапии при желтой лихорадке – коррекция всех нарушенных функций организма. Очередность назначения и комбинации препаратов определяются врачом.
В случае острой почечной недостаточности и угрозе уремической комы проводят гемодиализ, при наслоении вторичной бактериальной инфекции назначают антибиотики.
Прогноз. Своевременно начатое лечение характеризуется относительно благоприятным прогнозом. При тяжелом течении во время последних эпидемических вспышек летальность достигала 40–80 %. Прогностически неблагоприятно появление «черной рвоты» и анурии. Количество летальных исходов можно считать несколько завышенным, так как легкие формы желтой лихорадки обычно не выявляются и не учитываются.
Профилактика. Профилактика желтой лихорадки предполагает своевременное выявление, изоляцию и лечение больных, уничтожение комаров – переносчиков болезни и защиту человека от их укусов. Основа специфической профилактики желтой лихорадки – это иммунизация населения. В соответствии с решением ВОЗ (1989) прививки против желтой лихорадки включены в расширенную программу иммунизации.
«Подозрительные» лица и больные, прибывшие из эндемических мест, подвергаются изоляции на 6 сут. Лица, направляющиеся в эндемичные районы Южной Америки и Африки, прививаются не позднее чем за 10 дней до выезда.
Контигиозные геморрагические лихорадки
В данную группу заболеваний входят:
• геморрагические лихорадки, вызываемые ареновирусами: лихорадка Ласса, аргентинская геморрагическая лихорадка (АГЛ) и боливийская геморрагическая лихорадка (БГЛ);
• геморрагические лихорадки, вызываемые филовирусами: Марбургская вирусная болезнь и лихорадка Эбола;
• геморрагическая лихорадка с почечным синдромом.
Актуальность заболеваний определяется тяжелым течением с высокой частотой летальных исходов (от 10 до 90 %) и возможностью их завозов в различные регионы мира.
Геморрагические лихорадки, вызываемые ареновирусами, – природно-очаговые болезни.
Этиология. Ареновирусы получили свое название от лат. arena – песок. Геном вируса представлен РНК; репликация до конца не изучена; новые вирусные частицы образуются в результате почкования части липидной оболочки клетки хозяина.
Впервые ареновирусы были выделены в 1933 г. во время изучения эпидемии Санкт-Луи энцефалита. Они не были причиной вспышки, однако способствовали развитию асептического (небактериального) менингита. В дальнейшем выделено еше несколько ареновирусов возбудителей геморрагической лихорадки. Вирус Такарйбе обнаружен в 1956 г., а вирус Хунин выделен в 1958 г., он вызывает АГЛ. В 1963 г. в удаленных саваннах провинции Бени Боливии выделен вирус Мачупо (БГЛ). Вирус Ласса выделен в Африке в 1969 г. во время вспышки эпидемии лихорадки (лихорадка Ласса). Совсем недавно были выявлены вирусы Гуанарито (венесуэльская геморрагическая лихорадка) и Сабиа (бразильская геморрагическая лихорадка).
Эпидемиология. В естественных условиях возбудители циркулируют среди грызунов, обитающих в экваториальной, субэкваториальной, тропической и субтропической зонах. С этим связана эндемичность ареновирусных лихорадок.
Лихорадка Ласса встречается на территории Западной Африки, где обитают многососковая крыса и другие мышевидные, являющиеся резервуаром вируса Ласса в природе. АГЛ регистрируется в северо-восточных сельскохозяйственных провинциях Аргентины, БГЛ – на северо-востоке Боливии.
Природный резервуар вирусов Хунин и Мачупо – хомяковые грызуны. В эпизоотию вовлекаются синантропные грызуны, особенно в периоды миграции диких грызунов к населенным пунктам. Ареновирусная инфекция у них протекает бессимптомно, при этом они выделяют большое количество вируса с выделениями (прежде всего с мочой) и загрязняют ими элементы внешней среды.
Заражение людей от грызунов происходит во время сельскохозяйственных работ и других видов деятельности человека на земле, а также в жилищах, где обитают грызуны. Факторы передачи возбудителей – пища, вода, предметы обихода, загрязненные выделениями грызунов, воздух, содержащий инфицированный аэрозоль (капельки мочи, пыль из подсохших выделений). Ареновирусным лихорадкам свойственна сезонность с сельскохозяйственными работами и миграцией грызунов.
При лихорадках Лаоса и БГЛ больной человек заразен, он наряду с грызунами является источником инфекции. Этим объясняется возникновение вторичных заболеваний в семьях, а также внутрибольничные заражения больных и персонала.
Факторы риска для медицинского персонала – работа с кровью и выделениями пациентов, перевязки, манипуляции в полости рта, порезы и уколы при выполнении этих работ. Средством передачи может быть плохо обеззараженный медицинский инструментарий.
Патогенез ареновирусных геморрагических лихорадок связан с прямым повреждающим действием вирусов. Входные ворота – пищеварительный, дыхательный тракт, поврежденная кожа. Вирусы размножаются в региональных лимфатических узлах и распространяются по всей ретикулоэндотелиальной системе. Происходит массивное повреждение капилляров.
Основной синдром – геморрагический, проявляющийся различными кровотечениями, геморрагической сыпью. Механизм развития геморрагий включает внутрисосудистый тромбоз, повреждение клеток костного мозга, поражение печени (снижение продукции факторов свертывания крови). Возникают органные поражения (некроз гепатоцитов, почечных канальцев), поражения головного мозга, селезенки, миокардит, интерстициальная пневмония.
Инфекционный процесс у человека может проявляться различно: от бессимптомных и субклинических до тяжелых, летальных форм с молниеносным течением. Доля тяжелых форм сильно варьируется и может достигать 30–50 %. Летальность составляет от 10 до 30 % (в Сьерра-Леоне при лихорадке Ласса летальность госпитализированных – 16 %, всех больных – 1–2%).
Клиническая картина. Инкубационный период – 7-14 дней, продрома нет. Начало болезни всегда включает лихорадочный и болевой синдромы (головная, мышечные боли). Специфические симптомы отдельных лихорадок в начальном периодефарингит (часто некротический) при лихорадке Ласса; парестезии кожи, конъюнктивы при АГЛ; неврологические нарушения в виде тремора конечностей, языка при БГЛ. С 5-7-го дня при нарастании интоксикации развивается геморрагический диатез. Вследствие повышенной проницаемости капилляров могут развиваться отеки, экссудаты (плевральный, перикардиальный). Течение осложняют миокардит, отек легких, уремия, энцефалопатия. В тяжелых случаях заболевание длится до 2 недель и заканчивается летально. Период реконвалесценции длительный, особенно при лихорадке Ласса и БГЛ, с астенией, неврологическими нарушениями, выпадением волос и др. Иммунитет длительный и стойкий.
Диагностика ареновирусных геморрагических лихорадок основывается на клинических и эпидемиологических данных. Дифференциальный диагноз следует проводить с малярией, брюшным тифом, гриппом, дифтерией (при наличии некротического фарингита). Диагноз подтверждается вирусологическими и иммунологическими исследованиями.
Материал для вирусологического исследования (кровь, моча, глоточные смывы) берут в первые дни болезни. Ими заражают культуры клеток Vero или лабораторных животных. Идентификация вирусов осуществляется с помощью реакции иммунофлюоресценции (РИФ) или ИФА. Клинический диагноз должен быть уточнен на 3-4-й день болезни, поскольку в последующие дни состояние пациента может резко ухудшиться. В более поздние сроки (не ранее 2-3-й недели) диагноз может быть подтвержден с помощью серологических тестов: РИФ, ИФА и РТГА (четырехкратное диагностическое нарастание титров).
Прогноз. Летальность при АГЛ и БГЛ составляет от 1 до 10 %, а при лихорадке Ласса – 43 %.
Лечение геморрагических лихорадок основывается в целом на патогенетической и симптоматической терапии. Специфической терапии нет. В тяжелых случаях могут быть использованы иммуноплазма реконвалесцентов и интерферон в больших дозах. При лихорадке Ласса применяют рибавирин. При тяжелом течении требуется биохимический мониторинг жизненно важных функций организма.
Профилактика. Специфическая профилактика разработана только в отношении АГЛ. Необходимы мероприятия, препятствующие проникновению грызунов в жилища, и истребительная дератизация в населенных пунктах. Противоэпидемические мероприятия при контагиозных лихорадках Ласса и БГЛ включают:
• своевременную изоляцию больных;
• дезинфекцию в жилищах препаратами хлора;
• карантин соприкасавшихся с больными, состоящий из их изоляции дома или в стационаре и наблюдения;
• строгий противоэпидемический режим в стационарах при поступлении больных (размещение их в боксы, текущая дезинфекция препаратами хлора, защитная одежда персонала).
Геморрагические лихорадки, вызываемые филовирусами Марбург и Эбола, – это особо опасные эндемичные инфекции. Они отличаются тяжелым течением с частыми летальными исходами и контагиозностью больных. Большой риск возникновения внутрибольничных заражений и завозов из эндемичных регионов во все страны мира определяет актуальность геморрагических лихорадок Марбург и Эбола. Согласно данным ВОЗ на сентябрь 2014 г., число жертв лихорадки Эбола в странах Западной Африки составило более 3 тыс. человек, инфицировано свыше 6,2 тыс. Подавляющее количество заражений приходится на Либерию, Сьерра-Леоне и Гвинею.
Этиология. Вирусы Марбург и Эбола характеризуются уникальной морфологией и антигенной структурой, в связи с чем они выделены в самостоятельное семейство Filoviridae. Вирусы имеют вид длинных филаментов (80-1000 нм) с оболочкой и однонитевой РНК отрицательной полярности. Этиология этих возбудителей не изучена.
Эпидемиология. Заболевания распространены на африканском континенте и носят эндемичный характер. Вспышки их регистрировались в Кении, Судане, Заире, ЦАР, Гвинее, Габоне, Нигерии, Эфиопии (рис. 2, цв. вкл.). Зафиксированы завозы инфекции больными в страны Западной Европы. Несмотря на то что во время вспышки в г. Марбург (Германия) в 1967 г. все заболевшие имели контакт с завезенными из Африки обезьянами (зелеными мартышками), роль этих животных как резервуара вирусов в природе не доказана. Документально подтверждены случаи инфицирования вирусом Эбола человека от обезьян, летучих мышей, антилоп и дикобразов, которые могут быть случайными носителями вируса. Летучие мыши рассматриваются как резервуар вируса Эбола в природе. Естественные носители вируса Марбург – это летучие мыши рода Rousettus.
Условия первичных заражений людей в эндемической зоне неизвестны. Достоверно установлена возможность заражения человека от человека. С самого начала болезни вирусы содержатся в крови, носоглоточной слизи, длительно содержатся в моче и сперме (до 12 недель); описаны случаи выделения вирусов из конъюнктивальной жидкости. Все эпидемиологические наблюдения указывают, что заражение от больного происходит при тесном контакте с ним.
Факторы передачи – предметы, загрязненные кровью и выделениями больных. Риск заражения увеличивается при нарушении целости кожных покровов и слизистых. Возможен половой путь заражения. Воздушно-капельный путь вероятен, но не доказан. Большую опасность для персонала и пациентов представляют внутрибольничные заражения лихорадками Марбург и Эбола. В больницах возможны не только вторичные, но и третичные заболевания. Очень высок риск заражения при работе с кровью, выделениями пациентов, а также при уходе за ними. Доказана роль плохо обеззараженных инструментов в передаче вирусов. В Заире описаны случаи парентерального заражения со 100 %-й летальностью.
Патогенез. При попадании в организм человека вирус с током крови проникает в паренхиматозные органы, где размножаются, а затем снова переходит в кровь. Развитию геморрагий способствуют тромбоцитопения и уменьшение содержания в крови факторов, обусловливающих ее свертывание.
Клиническая картина. Инкубационный период – 2-21 день. Начало внезапное, быстро развивается болевой синдром – головная, мышечные боли, боли в груди.
Ранние признаки – конъюнктивит и энантема. В первые несколько часов температура тела поднимается до 39 °C без озноба (через 7–8 дней она снижается, но уже через 12–14 дней – второй подъем температуры). Характерны желудочно-кишечные расстройства – тошнота, рвота, жидкий водянистый стул с кровью. Диарея может приводить к дегидратации. Лихорадка Эбола сопровождается ангиной и поражением легких. При лихорадке Марбург увеличиваются преимущественно затылочные, шейные и подмышечные лимфатические узлы. На 5-8-й день у всех больных появляется макулопапулезная сыпь. Почти у половины пациентов развивается геморрагический диатез: различные кровотечения, гематурия, петехиальная сыпь, кровотечения на месте уколов. Кровотечения прогнозируют возможный летальный исход болезни. В тяжелых случаях развиваются нарушения ЦНС; смерть наступает на 6-14-й день от токсемии, церебральной комы, сердечно-сосудистой и почечной недостаточности.

