Полная версия
Каверномы ЦНС. cavernoma.net
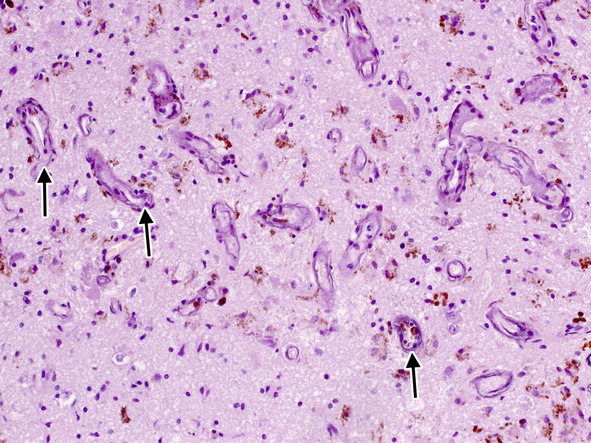
Рис. 16. Кальциноз стенок капилляров в прилежащей к кавернозной мальформации ткани мозга (стрелки). Ув. х 200
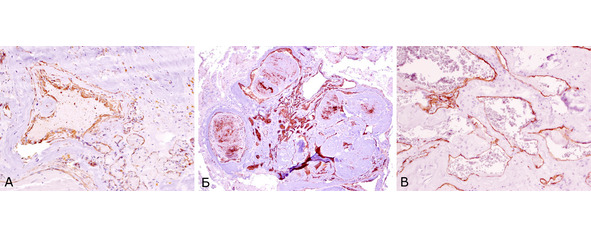
Рис. 17. Иммуногистохимическое исследование кавернозных мальформаций. А. Экспрессия гладкомышечного актина (HHF 35) в стенках сосудистых полостей КМ (коричневое рашивание). ув. х 400. Б. Экспрессия эндотелиального маркера CD31 в эндотелии и тромбах, облитерирурющих сосудистые полости (коричневое окрашивание) Ув. х 200. В. Экспрессия эндотелиального маркера CD34 в эндотелии, выстилающем сосудистые полости (коричневое окрашивание). Ув. х 400
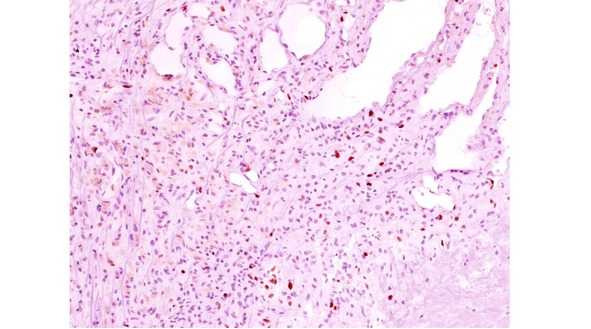
Рис. 18. Экспрессия пролиферативного маркера Ki-67 в КМ (коричневое ядерное окрашивание, индекс 5%) в формирующейся капсуле гематомы. Ув. х 200

Рис. 19. Экспрессия VEGF в формирующемся тромбе (1) и в эндотелии (2) сосудистой полости КМ (коричневое окрашивание). Ув. х 400
Морфологические исследования, выполненные в институте нейрохирургии, также показали разнообразие гистологического строения образований, объединяемых термином «кавернозная мальформация» (2). На основании этих исследований выделено три основных гистологических типа каверном:
I тип (классический) – кавернома, состоящая из плотно прилежащих друг к другу каверн, в стенках которых нет мышечных и эластических волокон. Прослойки мозговой ткани между кавернами отсутствуют. Кавернома имеет четкую границу с мозгом и капсулу (см. рис. 11). Этот вариант оказался наиболее распространенным и составил 93,7% всех каверном.
II тип (смешанный) характеризуется тем, что в периферических отделах мальформации наряду с типичной для каверномы тканью обнаруживаются плохо дифференцированные сосуды с элементами артериального и венозного строения в виде мышечных и эластических волокон, с прослойками мозговой ткани между ними. Частота каверном этого типа составила 5,1% (рис. 20).
Для III типа (пролиферативный) характерно наличие в ткани КМ микроскопических участков выраженной клеточной (эндотелиальной) пролиферации. Эти микроочаги напоминают строение капиллярной гемангиомы. КМ такого типа встречались очень редко – 0,5% случаев (рис. 21).
Помимо этих вариантов, в трех наблюдениях (0,5% биопсий) в биопсийном материале выявлено сочетание кавернозной ткани и опухоли. Опухолевая ткань была представлена астроцитомой, ганглиглиомой и гемангиоперицитомой (рис. 22). Образования располагались в веществе больших полушарий и на операции имели вид типичных КМ.
По данным литературы, сочетание каверномы и опухоли встречается крайне редко (151, 269). Следует также иметь в виду, что в некоторых опухолях возможен выраженный ангиоматоз с образованием каверномоподобных структур, которые могут быть ошибочно приняты за кавернозную мальформацию (137).

Рис. 20. Смешанная мальформация – тонкостенные сосудистые полости кавернозной мальформации (1) с прилежащими сосудами артериального типа (2). Ув. х 100
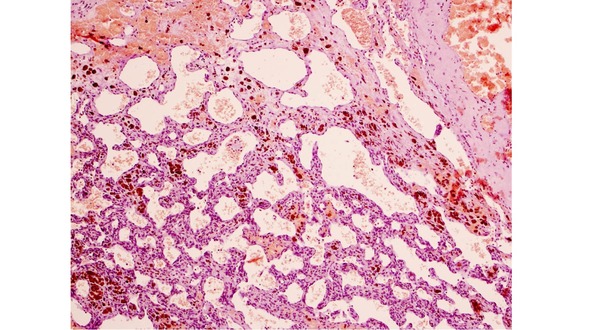
Рис. 21. Очаги пролиферации капилляров по типу капиллярной гемангиомы в КМ. Ув. х 200
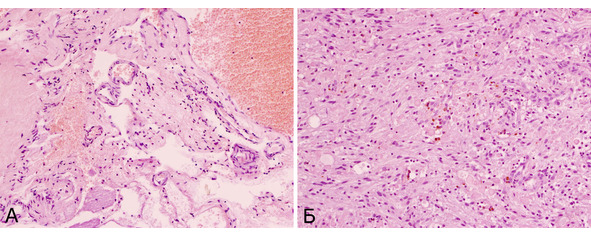
Рис. 22. Сочетание кавернозной мальформации и внутримозговой опухоли. Б-ной З-ев, 17 лет. Предоперационный диагноз: объемное образование левой лобной доли неуточненной этиологии. Симптоматическая эпилепсия. Гистологический диагноз: сочетание кавернозной мальформации классического типа (А) и пилоидной астроцитомы (Б) в удаленном образовании. Ув. х 200

Рис. 23. Отложения гемосидерина в окружающей кавернозную мальформацию мозговой ткани. Ув. x 200
Венозные ангиомы или их фрагменты в биопсийном материале представлены не были. Расхождение между частым выявлением патологических вен в непосредственной близости от каверном в ходе операции или при СКТ-АГ и МР-АГ и их крайне редкой гистологической идентификацией обусловлено тем, что хирурги практически никогда не иссекают эти вены, даже если они представляются непосредственно связанными с мальформацией. Кроме того, при выявлении сочетания каверномы и типичной венозной ангиомы, расположенных в непосредственной близости друг к другу, хирургическое вмешательство, как правило, не проводится. Гистологически подтвержденные случаи сочетания каверномы с телеангиэктазией в материале биопсий в институте также не встречались.
При микроскопическом исследовании мозгового вещества, окружающего каверному, практически облигатным признаком является присутствие отложений гемосидерина, что является показателем кровоизлияний из каверномы (рис. 23).
Микроскопическое исследование также подтверждает видимые невооруженным глазом глиозные изменения мозгового вещества.
При оценке результатов гистологических исследований необходимо учитывать, что в биопсийном материале морфолог имеет возможность исследовать не всю мальформацию, а только ее фрагменты. Часть мальформаций, особенно тонкостенных, разрушается в ходе операции или предшествующего кровоизлияния. Крайне сложно получить материал для биопсии при каверномах малого размера, что особенно характерно для каверном ствола мозга. Гистологическое исследование в подобных случаях может ограничиваться обнаружением капсулы хронической гематомы и следов кровоизлияний разной давности (рис. 24).
Еще один вариант гистологического диагноза – недифференцированный сосудистый порок развития – также чаще всего связан с отсутствием достаточного материала для исследования, хотя нельзя исключить существования мальформаций, которые невозможно классифицировать.
Рис. 24. Фрагмент стенки сосудистой полости в гематоме: пример малоинформативного биоптата. Ув. x 400
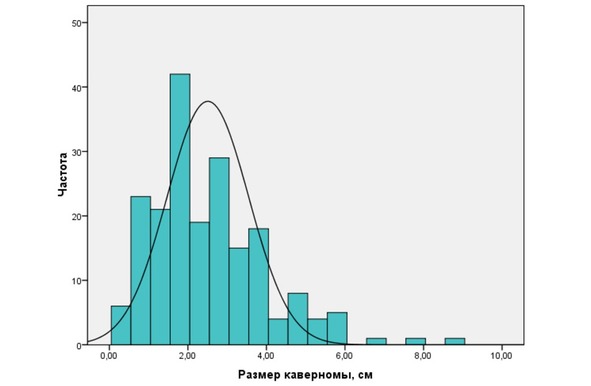
Рис. 25. Распределение кавернозных мальформаций по размеру
В нашей серии удаленные образования супратенториальной локализации были идентифицированы как кавернозные мальформации в 90,4% случаев при поверхностном расположении и в 70,2% случаев при глубинном расположении. Для образований мозжечка и ствола мозга эти цифры были существенно ниже – 64,1% и 43,2% соответственно. Во всех остальных случаях результаты биопсий были сомнительны, либо определялись недифференцированные пороки развития (преимущественно при супратенториальных образованиях) или капсула хронической гематомы (преимущественно при субтенториальных образованиях). Эти различия, вероятнее всего, обусловлены причинами, приведенными выше. Можно также предположить, что глубинные каверномы и каверномы ствола чаще удаляют на более ранних стадиях формирования, так как их, как правило, выявляют при первых кровоизлияниях. Результатом является более частое выявление гематом, а не типичных кавернозных мальформаций.
3.3. Локализация и размеры
Каверномы могут располагаться в любом отделе ЦНС. Распределение каверном по локализации в нашей серии представлено в табл. I. 69,5% каверном располагались супратенториально. Среди них 84,9% образований имели корковую или субкортикальную локализацию, 14,1% находились в глубинных структурах. Среди корковых и субкортикальных КМ подавляющее большинство было представлено каверномами лобных и височных долей. Субтенториальные КМ составили 27,4% от всех каверном. Наиболее часто они располагались в стволе мозга – 76,3% каверном задней черепной ямки. КМ спинного мозга встречались редко и составили только 2,1% от каверном других локализаций. Полученные нами данные по частоте КМ разного расположения в целом соответствуют сведениям, представленным в различных публикациях (96, 235, 294). Отличие составляет значительное преобладание каверном ствола над каверномами мозжечка – в большинстве исследований их соотношение составляет примерно 1:1, а в нашей серии – 3:1. Мы объясняем этот факт тем, что многие годы институт был единственным в России учреждением, где выполняли операции по поводу КМ ствола, что привело к большому числу больных с этой локализацией мальформаций. Касаясь распределения каверном в головном и спинном мозге, следует упомянуть, что, по общему мнению, число каверном, обнаруживаемых в определенных отделах мозга, пропорционально объемам этих отделов и не зависит от каких-либо других факторов. В нашей серии, помимо традиционных, часто встречающихся локализаций, представлены также такие редко встречающиеся каверномы, как каверномы хиазмально-селлярной области, передних и задних отделов гипоталамуса, III желудочка, пинеальной области, среднего и продолговатого мозга, краниоспинальной области. В литературе описаны как эти, так и другие редкие локализации каверном: отдельные случаи каверном черепных нервов, кавернозного синуса, ТМО передней и средней черепной ямок, мозжечкового намета, меккелевой капсулы, мосто-мозжечкового угла (7, 71, 103, 105, 126, 132, 181, 231, 249, 255, 261, 290).
Размеры каверном могут быть самыми разнообразными. В нашей серии эта величина варьировала от нескольких миллиметров до 9см в диаметре. Средний размер каверном составил 2,6 ± 1,5см. В целом крупные каверномы (более 4см в диаметре) встречались реже, чем каверномы средних и небольших размеров (рис. 25).
Динамические исследования показывают, что размеры, форма и структура каверном не являются статичными и могут меняться. Существуют также доказательства возможности новообразования кавернозных мальформаций (см. главу 5).
4. Этиология и патогенез кавернозных мальформаций
4.1. Механизмы образования
Кавернозные ангиомы встречаются в виде двух основных форм – спорадической и наследственной.
В настоящее время этиопатогенез каверном наиболее хорошо изучен на модели наследственных форм заболевания. Существование семейных каверном и аутосомно-доминантный тип наследования патологии был доказан еще на этапе анализа клинических наблюдений (55, 156). На основе полученных данных L. Hayman с соавт. в работе 1982г. (156) впервые показали, что при обследовании кровных родственников больных с клинически проявившимися каверномами можно выявить бессимптомные формы заболевания. J. Dubovksy с соавт. (107) и A. Gil-Nagel с соавт. (142) удалось локализовать первый из генов, ответственных за формирование каверном, в длинном плече 7-ой хромосомы – ген ССМ1 (KRIT1). M. Guenl с соавт. заподозрили и начали поиск мутаций этого гена (149), а S. Laberge-le с соавт. описали связанные с развитием заболевания мутации, вызывающие преждевременное прекращения синтеза белка (201). Впоследствии H. Craig и соавт. (91) установили наличие еще двух локусов, связанных с семейными формами каверном: CCM2 (MGC4607) в коротком плече 7-ой хромосомы и CCM3 (PDCD10) в длинном плече 3-й хромосомы. Согласно последним данным, предполагается наличие четвертого гена (212).
В последние годы количество публикаций по генетике каверном возрастает лавинообразно. Основным направлением исследований является изучение молекулярных механизмов формирования каверном. К настоящему времени уже сформировано представление о том, что кодируемые тремя генами белки, «работают» в тесном взаимодействии, создавая сложный протеиновый комплекс, который обеспечивает морфогенез и стабильность сосудов мозга. Выявлен ряд генных мутаций и расшифровано несколько паттернов нарушения белкового синтеза, ведущих к нарушению формирования эндотелиальных клеток, их миграции и соединения (адгезии) в процессе ангиогенеза, что приводит к формированию каверном (50, 123, 140, 166, 167, 200, 201, 210, 216, 268, 288). Изучаются также генетические основы ассоциации церебральных кавернозных мальформаций с различными видами сосудистых мальформаций кожи, сетчатки, ангиомами печени, клинические описания которых все чаще встречаются в литературе (61, 66, 101, 106, 131, 202, 330). Исследования ведутся как на экспериментальных моделях (75, 91, 93, 98, 216, 237), так и путем изучения генома в семьях с наследственными каверномами (36, 45, 142, 144, 149, 212, 258). Для более полного понимания процессов формирования каверном и процессов, лежащих в основе клинических проявлений патологии, необходимы дальнейшие исследования, которые должны привести к возможности терапевтического лечения заболевания на генном уровне (40, 193, 241, 273).
Пусковой механизм формирования спорадических каверном неизвестен. Считается, что спорадические каверномы в подавляющем большинстве случаев являются врожденными, и образуются на 3—8 неделе беременности, в период, когда происходит закладка и формирование сосудистой системы мозга плода (74). Врожденный характер патологии подтверждается случаями обнаружения каверном у детей первого года жизни, хотя следует признать, что такие случаи довольно редки.
Одним из доказанных факторов новообразования спорадических КМ является лучевое воздействие (радиоиндуцированные каверномы). Первые сообщения о таких случаях появились в начале 90-х годов (133, 282, 348). В этих ретроспективных исследованиях описаны отдельные наблюдения, в которых кавернозные мальформации были обнаружены спустя несколько лет у больных, получавших лучевое лечение по поводу различной патологии головного мозга, главным образом, опухолей различной локализации и гистологической структуры. Необходимо отметить, что в большинстве из этих случаев первоначальное обследование включало только КТ, что не позволяет достоверно судить о состоянии мозга до облучения. Показательным в этом отношении служит одно из наблюдений E. Pozzatti с соавт., когда у больной, облученной по поводу одиночной каверномы головки хвостатого ядра, спустя несколько лет при МРТ были обнаружены множественные каверномы головного мозга. Авторы работы справедливо указывают на то, что в данном случае могло иметь место либо спонтанное новообразование каверном у больной с генетически обусловленной патологией, либо постепенное увеличение уже имевшихся микромальформаций, которые не были диагностированы в силу технологических ограничений (первоначальное обследование выполнено в 1982 г.) (282). На важность качества и сопоставимости разных исследований обращают внимание многие нейрохирурги. Примером может служить следующее наблюдение нашей серии (рис. 26).
Это наблюдение демонстрирует необходимость внимательного отношения к трактовке инструментальных исследований мозга, а также тот факт, что точные оценки ряда исследований, сделанных десятилетия назад, невозможны.
В последние годы формирование радиоиндуцированных мальформаций находит все новые подтверждения (110, 133, 187, 238, 322). В зависимости от дизайна исследований, приводимая частота таких каверном варьирует в достаточно широких пределах. В ретроспективных исследованиях она не превышает 10%, в то время как в появившихся в последнее время проспективных работах эта цифра возросла в несколько раз. Так, R. Duhem R соавт в публикации 2005 г сообщают о выявлении каверном у 2,1% пациентов (9 случаев из 419), прошедших в детстве лучевую терапию по поводу опухолей мозга (110). Дозы облучения составляли от 25 до 55 Gy, а срок после облучения – от 4 до 22 лет. Авторы делают вывод о том, что проблема формирования кавернозных ангиом в поздние сроки после лучевой терапии недооценена и предлагают обязательное МРТ обследование пациентам после лучевой терапии в период до 15 лет после лечения.
V. Strenger с соавт. (2008 г) проследили за судьбой 171 человека, которым в детстве проводили облучение головы по поводу различных злокачественных заболеваний, как интракраниальных, так и системных. У 8-ми из них (4,7%) в сроки от 2,9 до 18,4 лет после облучения были выявлены внутримозговые КМ, причем при анализе 5-летних периодов кумулятивный эффект нарастал (322). Авторы показали, что наибольший риск развития каверном существует у детей, облученных до 10-летнего возраста. О значительно более высокой частоте постлучевых КМ сообщили японскиу исследователи. В проспективной работе с использованием МРТ в режиме GRE они обнаружили каверномы у 41,2% детей (28 из 68), прошедших тотальное облучение в связи с пересадкой костного мозга. Частота появления каверном находилась в прямой зависимости от дозы облучения (187). M. Faraci, G. Morana в проспективном исследовании (МРТ 56 человек в сроки более 2-х лет после облучения) также показали высокий уровень различной радиоиндуцированной патологии мозга после облучения детей по поводу лейкоза, причем каверномы оказались самой частой находкой – выявлено 32 образования, составивших 54% среди 7 различных видов патологии, но только в одном из этих случаев кавернома проявилась клинически в виде микрокровоизлияний и неспецифических неврологических проявлений, остальные образования были бессимптомными (122). Наша серия предположительно радиоиндуцированных каверном включает 11 больных. Они составили 0,8% всех обследованных. Лучевую терапию с облучением головы проводили по поводу различных заболеваний: в 9 случаях по поводу опухолей мозга или головы, в двух – в рамках протокола лечения острого лимфобластного лейкоза.
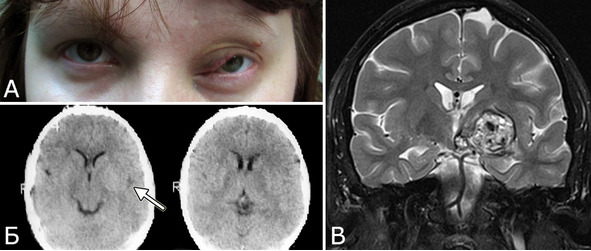
Рис. 26. Б-ная В-ва, 1982 г. р. Радиоиндуцированная (?) кавернозная мальформация. Амбулаторное обследование в НХИ в 2011 г (29 лет). А – внешний вид больной, 2011 г. Б – КТ головы, 1995г. В – МРТ головы, 2011 г (режим Т2, фронтальная проекция). Клинический диагноз: Врожденная капиллярная гемангиома левой половины лица и орбиты. Кавернозная мальформация базальных ганглиев, зрительного бугра и ножки мозга слева. Клиническое течение и лечение: с рождения – увеличение и деформация мягких тканей левой половины лица. Наблюдалась в НИИ глазных б-ней им. Гельмгольца с диагнозом «капиллярная гемангиома лица и орбиты». Проведено 5 курсов рентгенотерапии, курс радиотерапии. В 13-летнем возрасте (1995 г) выполнена коагуляция сосудов орбиты. При КТ головы в НИИ нейрохирургии патологии не обнаружено. В 2011 г (29 лет) постепенно развился правосторонний гемипарез, правосторонняя гемигипестезия. Обратилась в институт. При обследовании: глубокий правосторонний пирамидный гемипарез, гемигипестезия, гомонимная гемигипопсия. При МРТ выявлена типичная крупная кавернома базальных ганглиев справа (В). При ретроспективном рассмотрении КТ 1995 г (Б) можно предполагать наличие практически изоплотностного по отношению к ткани мозга округлого образования базальных ганглиев слева (стрелка), совпадающее по локализации с КМ, выявленной в 2011 г.
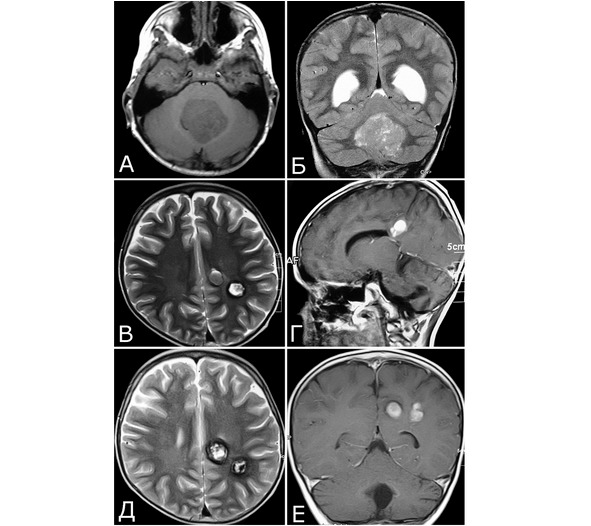
Рис. 27. Радиоиндуцированные кавернозные мальформации. Б-ной С-р, 2005 г. р. Клинический диагноз: медуллобластома IV желудочка. Состояние после удаления опухоли (2009 г) и адьювантной комбинированной терапии (лучевая терапия, 5 курсов химиотерапии). Радиоиндуцированные КМ. А, Б – 2009 г: крупная опухоль IV желудочка. МРТ, режимы Т1 и Т2. В, Г – 30.05.12г: при контрольном обследовании выявлены два бессимптомных объемных образования в правой теменной области, по МРТ—характеристкам соответствующие сосудистой патологии (радиоиндуцированные КМ?). Признаков рецидива опухоли нет. Д, Е – 10.05.13 г.: при контрольном обследовании объем и структура сосудистых образований остаются прежними. Учитывая отсутствие клинических симптомов, хирургическое вмешательство не проводили
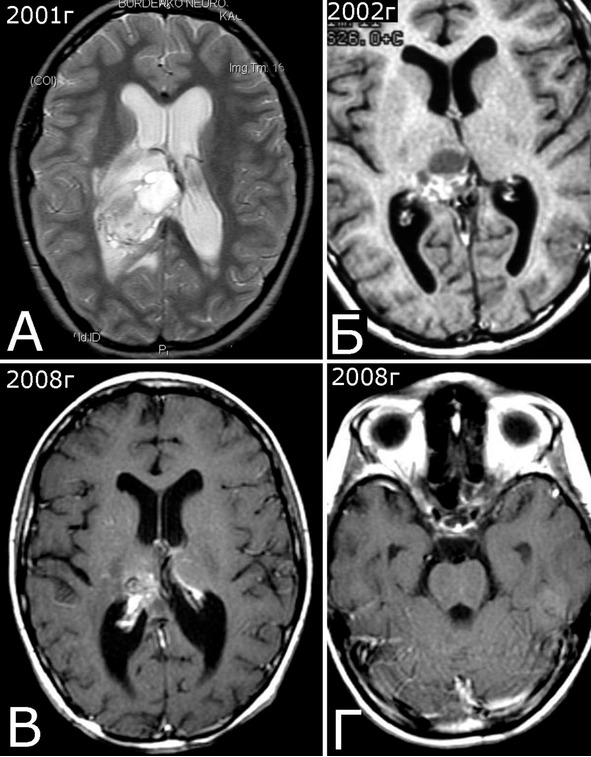
Рис. 28.I. Радиоиндуцированная кавернозная мальформация и множественный дисангиогенез (?) (см. далее)
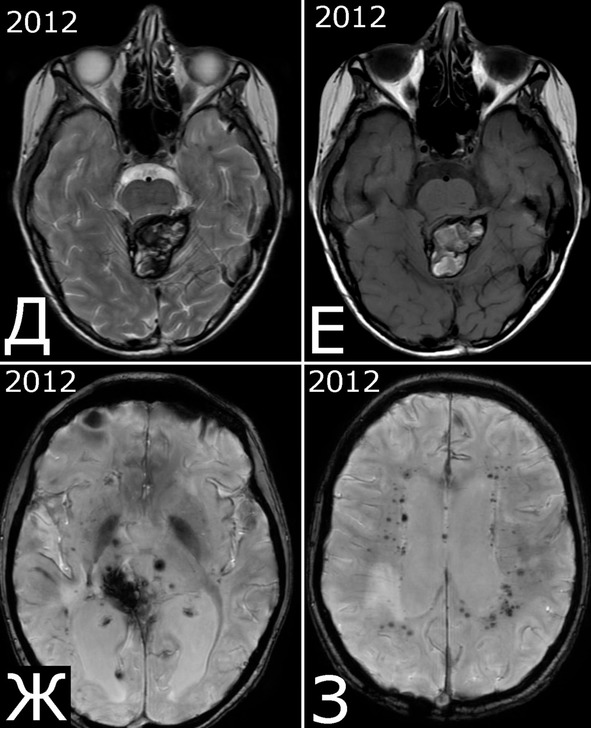
Рис. 28.II. Радиоиндуцированная кавернозная мальформация и множественный дисангиогенез (?) (см. далее)
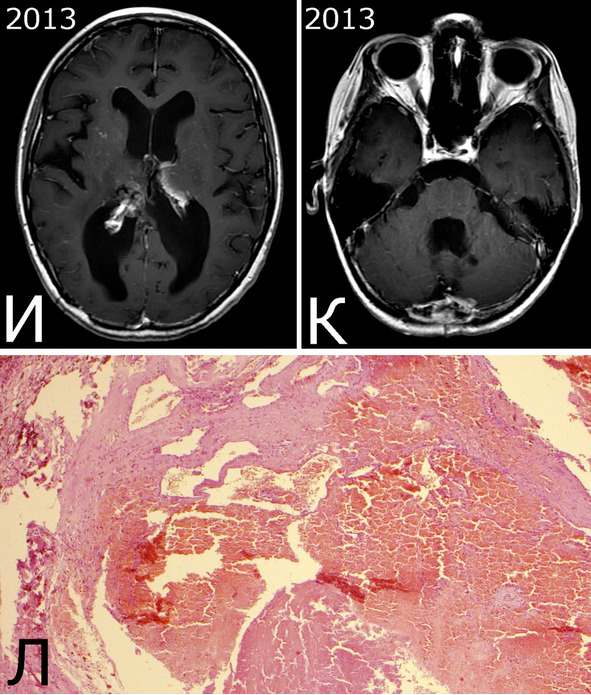
Рис. 28.III. Б-ная К-я, 1988 г. р. Радиоиндуцированная кавернозная мальформация и множественный дисангиогенез (?).
Анамнез (б-ная К-я, 1988 г. р.): в 2001 г (13 лет) обнаружена и удалена (субтотально) глиобластома задних отделов зрительного бугра справа. Проведен курс лучевой терапии. (А – МРТ до операции, режим Т2; Б – МРТ после операции и лучевой терапии, режим Т1). В августе 2002 г произведено радиохирургическое лечение оставшейся части опухоли. При последущих ежегодных обследованиях признаков продолженного роста опухоли не было (В – контрольная МРТ в 2008 г, режим Т1). Неврологического дефицита не было. С января 2011 г после падения на улице появилось пошатывание при ходьбе, которое через несколько месяцев регрессировало. При очередном контрольном обследовании в 2012 г выявлено объемное образование червя мозжечка, расцененное как хроническая гематома (Д, Е – МРТ, режимы Т2, Т1). Кроме того, в режиме SWAN обнаружено множество мелких очагов низкого сигнала, преимущественно перивентрикулярно, имеющих вид КМ IV типа (Ж, З – МРТ, режим SWAN). 01.11.2012 выполнена операция удаления гематомы: Поверхность червя мозжечка в средних его отделах резко изменена, желтого цвета и выбухает. Произведена коагуляция прилежащих участков коры и на глубине нескольких мм обнаружена капсула хронической гематомы. Капсула очень плотная. Она рассечена скальпелем. Содержимое ее – организовавшиеся кровяные сгустки. Помимо основной организовавшейся гематомы было еще несколько крупных полостей с такими же плотными стенками, заполненными кровяными сгустками. С передней части к упомянутому выше новообразованию подходили ветви мозжечковых артерий, которые коагулированы и пересечены. Основные стволы были смещены в сторону и сохранены. Постепенно путем кускования и иссечения фрагментов гематомы, по всей вероятности, и кавернозной мальформации, это новообразование удалено полностью. Оно было окружено измененной мозговой тканью желтого цвета. Ложе удаленной гематомы выложено гемостатической ватой. Образовалась больших размеров полость в пределах верхних и средних отделов червя и прилежащих отделов мозжечка. Гистологический диагноз: ткань мозжечка с капсулой гематомы с кровоизлияниями различной давности, скоплениями макрофагов и сидерофагов, очаговыми лимфоидными инфильтратами. В капсуле гематомы обнаружен микроскопический фрагмент кавернозной мальформации (Л – гистологический препарат, ув. Х 50). МРТ после операции – полное удаление гематомы (И, К – МРТ, режим Т1).
Срок от облучения до выявления каверномы в большинстве случаев был длительным и составил в среднем 12 лет. У двух больных этот период был менее 2-х лет. Все больные были облучены в возрасте до 20 лет, причем 7 из 10-ти – в раннем детском возрасте (до 6 лет). У 8 больных каверномы проявились клинически, либо в виде кровоизлияний (7 наблюдений) либо в виде эпилептических припадков (1 наблюдение). У 3-х больных каверномы были бессимптомными и явились случайной находкой при очередном обследовании в связи с основным заболеванием ((рис. 27).
7-ми больным выполнено удаление каверном, в том числе, бессимптомных. Все образования в ходе операции имели вид типичных КМ. Гистологический диагноз каверномы подтвердился в 4-х случаях, у 3 больных выявлена только капсула хронической гематомы (рис. 28).
Одному больному с каверномой ствола выполнено радиохирургическое лечение. В трех случаях решено было от операции воздержаться в связи с отсутствием клинических проявлений или высоким риском нарастания очаговых симптомов. Как уже сказано выше, несмотря на более чем вероятную связь между облучением и появлением КМ, однозначно утверждать, что обнаруженные в нашей серии мальформации явились следствием лучевой терапии, невозможно. Это связано, прежде всего, с отсутствием в ряде случаев качественного исследования состояния мозга до начала лучевой терапии.

