
Полная версия
Сборник основных формул по химии для ВУЗов
II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
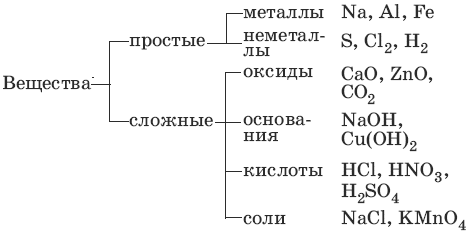
1. Основные классы неорганических соединений
1.1. Оксиды
Оксиды – сложные вещества, состоящие из атомов кислорода в степени окисления -2 и атомов другого элемента.
Номенклатура: Fe2O3 – оксид железа(III), Cl2O – оксид хлора(I).
Классификация оксидовНесолеобразующие (безразличные) оксиды: CO, SiO, NO, N2O.
Солеобразующие оксиды:
основные – оксиды металлов в степени окисления +1, +2,
амфотерные – оксиды металлов в степени окисления +2, +3, +4,
кислотные – оксиды металлов в степени окисления +5, +6, +7 и
оксиды неметаллов в степени окисления +1 – +7.
Получение оксидовГорение простых веществ:
С + O2 = CO2
2Са + O2 = 2СаО
Горение (обжиг) сложных веществ:
CH4 + 2O2 = CO2 + 2Н2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Разложение сложных веществ:
CaCO3 →t→ СаО + CO2
2Fe(OH)3 →t→ Fe2O3 + ЗН2O
Химические свойства оксидовОсновным оксидам (Na2O, CaO, CuO, FeO) соответствуют основания.
СаО + Н2O = Са(OH)2 (растворимы оксиды металлов IA– и IIА-групп, кроме Be, Mg)
CuO + Н2O ≠ (оксиды остальных металлов нерастворимы)
СаО + CO2 = CaCO3
СаО + 2HCl = CaCl2 + Н2O
Кислотным оксидам (CO2, Р2O5, СrO3, Mn2O7) соответствуют кислоты.
SO2 + Н2O = H2SO3 (кислотные оксиды, кроме SiO2, растворимы в воде)
SO2 + СаО = CaSO3
SO2 + 2NaOH = Na2SO3 + Н2O
Амфотерным оксидам (ZnO, Al2O3, Cr2O3, ВеО, РЬО) соответствуют амфотерные гидроксиды.
ZnO + H2O ≠ (амфотерные оксиды нерастворимы в воде)
ZnO + 2HCl = ZnCl2 + Н2O
ZnO + 2NaOH →t→ Na2ZnO2 + Н2O (при нагревании или сплавлении)
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] (в разбавленном растворе)
1.2. Основания
Основания – сложные вещества, состоящие из атомов металла и гидроксиль-ных групп; основания – электролиты, образующие при диссоциации в качестве анионов только анионы гидроксила.
Номенклатура: Fe(OH)3 – гидроксид железа(III).
Классификация оснований:– растворимые (щелочи) NaOH, KOH;
– нерастворимые Fe(OH)2, Mg(OH)2;
– амфотерные Zn(OH)2, Al(OH)3, Ве(OH)2, Сr(OH)3;
– однокислотные NaOH, KOH;
– двухкислотные Ва(OH)2, Zn(OH)2;
– трехкислотные Al(OH)3, Сr(OH)3.
Получение основанийПолучение щелочей:
2Na + 2Н2O = 2NaOH + Н2
Na2O + Н2O = 2NaOH
Получение нерастворимых и амфотер-ных оснований:
FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
Свойства щелочей:NaOH → Na+ + OH¯ (α = 1, фенолфталеин – красный)
NaOH + HCl = NaCl + H2O (реакция нейтрализации)
2NaOH + CO2 = Na2CO3 + H2O
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
2NaOH + Al2O3 →t→ 2NaAlO2 + H2O
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2
2NaOH + Si + H2O = Na2SiO3 + 2H2
Свойства нерастворимых оснований:Fe(OH)2 ↔ FeOH+ + OH¯ (α << 1);
FeOH+ ↔ Fe2+ + OH‾ (α << 1)
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
Fe(OH)2 →t→ FeO + H2O
Свойства амфотерных оснований:Al3++ ЗOH¯ + Н2O ↔ Al(OH)3↓ + Н2O ↔ [Al(OH)4]¯ + Н+
Al(OH)3 + ЗHCl = AlCl3 + ЗН2O
Al(OH)3 + NaOH = Na[Al(OH)4]
2Al(OH)3 →t→ Al2O3 + ЗН2O
1.3. Кислоты
Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка; кислоты – электролиты, образующие при диссоциации в качестве катионов только катионы водорода.
Номенклатура кислот и кислотных остатков:
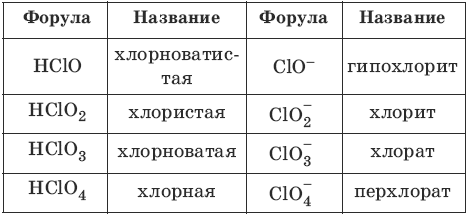
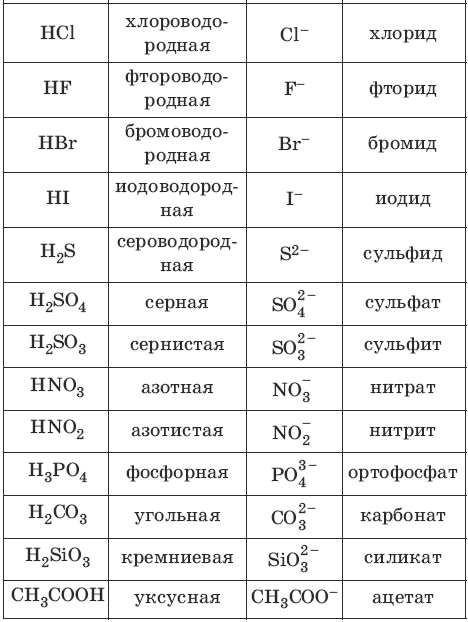
– одноосновные HCl
– двухосновные H2S
– трехосновные Н3PO4
– кислородсодержащие HNO3
– бескислородные HCl
Получение кислотCO2 + Н2O = Н2CO3 (кроме SiO2)
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
H2 + Cl2 = 2HCl
Химические свойства кислотHCl → H+ + CI¯ (α =1) (лакмус – красный)
CH3COOH ↔ CH3COO¯ + H+ (α << 1)
Fe + 2HCl = FeCl2 + H2 (металл в ряду напряжений до Н)
Cu + HCl ≠ (не идет, металл в ряду напряжений после Н)
2HCl + CuO = CuCl2 + Н2O
2HCl + Cu(OH)2 = CuCl2 + 2Н2O
2HCl + ZnO = ZnCl2 + Н2O
3HCl + Al(OH)3 = AlCl3 + 3Н2O
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑ (выделяется газ)
HCl + AgNO3 = AgCl↓ + HNO3 (образуется осадок)
1.4. Соли
Соли – сложные вещества, состоящие из атомов металла и кислотного остатка.
Соли – электролиты, образующие при диссоциации катионы металла или аммония и анионы кислотного остатка.
Конец ознакомительного фрагмента.
Текст предоставлен ООО «Литрес».
Прочитайте эту книгу целиком, купив полную легальную версию на Литрес.
Безопасно оплатить книгу можно банковской картой Visa, MasterCard, Maestro, со счета мобильного телефона, с платежного терминала, в салоне МТС или Связной, через PayPal, WebMoney, Яндекс.Деньги, QIWI Кошелек, бонусными картами или другим удобным Вам способом.



