
Полная версия
Сборник основных формул по химии для ВУЗов
Порядок реакции равен сумме показателей степеней концентрации в экспериментальном выражении скорости химической реакции. Так, для сложной реакции
mA + nB → рС + qD экспериментальное выражение скорости реакции имеет вид
v1 = k1 × [А]α × [В]β и порядок реакции равен (α + β). При этом α и β находятся экспериментально и могут не совпадать с m и n соответственно, поскольку уравнение сложной реакции представляет собой итог нескольких простых реакций.
Влияние температуры. Скорость реакции зависит от числа эффективных столкновений молекул. Увеличение температуры увеличивает число активных молекул, сообщая им необходимую для протекания реакции энергию активации Еакт и увеличивает скорость химической реакции.
Правило Вант-Гоффа. При увеличении температуры на 10° скорость реакции увеличивается в 2–4 раза. Математически это записывается в виде:
v2 = v1 × γ(t2 – t1)/10
где v1 и v2 – скорости реакции при начальной (t1) и конечной (t2) температурах, γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции при увеличении температуры на 10°.
Более точно зависимость скорости реакции от температуры выражается уравнением Аррениуса:
k = A × e—E/(RT),
где k – константа скорости, А – постоянная, не зависящая от температуры, е = 2,71828, Е – энергия активации, R = 8,314 Дж/(К × моль) – газовая постоянная; Т – температура (К). Видно, что константа скорости увеличивается с увеличением температуры и уменьшением энергии активации.
4.3. Химическое равновесие
Система находится в равновесии, если ее состояние не изменяется во времени. Равенство скоростей прямой и обратной реакции – условие сохранения равновесия системы.
Примером обратимой реакции является реакция
N2 + 3H2 ↔ 2NH3.
Закон действия масс: отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ (все концентрации указывают в степенях, равных их стехиометрическим коэффициентам) есть постоянная, называемая константой равновесия.
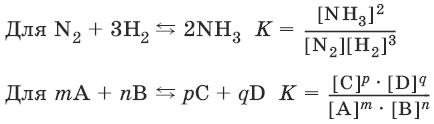
Константа равновесия – это мера протекания прямой реакции.
К = О – прямая реакция не идет;
К = ∞ – прямая реакция идет до конца;
К > 1 – равновесие сдвинуто вправо;
К < 1 – равновесие сдвинуто влево.
Константа равновесия реакции К связана с величиной изменения стандартной энергии Гиббса ΔG для этой же реакции:
ΔG = – RTlnK, или ΔG = -2,3RTlgK, или К= 10-0,435ΔG/RT
Если К > 1, то lgK > 0 и ΔG < 0, т. е. если равновесие сдвинуто вправо, то реакция – переход от исходного состояния к равновесному – идет самопроизвольно.
Если К < 1, то lgK < 0 и ΔG > 0, т. е. если равновесие сдвинуто влево, то реакция самопроизвольно вправо не идет.
Закон смещения равновесия: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, в системе возникает процесс, который противодействует внешнему воздействию.
5. Окислительно-восстановительные реакции
Окислительно-восстановите льные реакции – реакции, которые идут с изменением степеней окисления элементов.
Окисление – процесс отдачи электронов.
Восстановление – процесс присоединения электронов.
Окислитель – атом, молекула или ион, который принимает электроны.
Восстановитель – атом, молекула или ион, который отдает электроны.
Окислители, принимая электроны, переходят в восстановленную форму:
F2 [ок. ] + 2ē → 2F¯ [восст.].
Восстановители, отдавая электроны, переходят в окисленную форму:
Na0 [восст. ] – 1ē → Na+ [ок.].
Равновесие между окисленной и восстановленной формами характеризуется с помощью уравнения Нернста для окислительно-восстановительного потенциала:
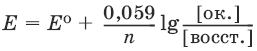
где Е0 – стандартное значение окислительно-восстановительного потенциала; n – число переданных электронов; [восст. ] и [ок. ] – молярные концентрации соединения в восстановленной и окисленной формах соответственно.
Величины стандартных электродных потенциалов Е0 приведены в таблицах и характеризуют окислительные и восстановительные свойства соединений: чем поло-жительнее величина Е0, тем сильнее окислительные свойства, и чем отрицательнее значение Е0, тем сильнее восстановительные свойства.
Например, для F2 + 2ē ↔ 2F¯Е0 = 2,87 вольт, а для Na+ + 1ē ↔ Na0Е0 = -2,71 вольт (процесс всегда записывается для реакций восстановления).
Окислительно-восстановительная реакция представляет собой совокупность двух полуреакций, окисления и восстановления, и характеризуется электродвижущей силой (э.д.с.) ΔЕ0: ΔЕ0 = ΔЕ0ок – ΔЕ0восст, где Е0ок и ΔЕ0восст – стандартные потенциалы окислителя и восстановителя для данной реакции.
Э.д.с. реакции ΔЕ0 связана с изменением свободной энергии Гиббса ΔG и константой равновесия реакции К:
ΔG = – nFΔЕ0 или ΔЕ = (RT/nF)lnK.
Э.д.с. реакции при нестандартных концентрациях ΔЕ равна: ΔЕ = ΔЕ0 – (RT/nF) × IgK или ΔЕ = ΔЕ0 – (0,059/n)lgK.
В случае равновесия ΔG = 0 и ΔЕ = 0, откуда ΔЕ = (0,059/n)lgK и К = 10nΔE/0,059.
Для самопроизвольного протекания реакции должны выполняться соотношения: ΔG < 0 или К >> 1, которым соответствует условие ΔЕ0 > 0. Поэтому для определения возможности протекания данной окислительно-восстановительной реакции необходимо вычислить значение ΔЕ0. Если ΔЕ0 > 0, реакция идет. Если ΔЕ0 < 0, реакция не идет.
Химические источники токаГальванические элементы – устройства, преобразующие энергию химической реакции в электрическую энергию.
Гальванический элемент Даниэля состоит из цинкового и медного электродов, погруженных в растворы ZnSO4 и CuSO4 соответственно. Растворы электролитов сообщаются через пористую перегородку. При этом на цинковом электроде идет окисление: Zn → Zn2+ + 2ē, а на медном электроде – восстановление: Cu2+ + 2ē → Cu. В целом идет реакция: Zn + CuSO4 = ZnSO4 + Cu.
Анод – электрод, на котором идет окисление. Катод – электрод, на котором идет восстановление. В гальванических элементах анод заряжен отрицательно, а катод – положительно. На схемах элементов металл и раствор отделены вертикальной чертой, а два раствора – двойной вертикальной чертой.
Так, для реакции Zn + CuSO4 = ZnSO4 + Cu схемой гальванического элемента является запись: (-)Zn | ZnSO4 || CuSO4 | Cu(+).
Электродвижущая сила (э.д.с.) реакции равна ΔЕ0 = Е0ок – Е0восст = Е0(Cu2+/Cu) – Е0(Zn2+/Zn) = 0,34 – (-0,76) = 1,10 В. Из-за потерь напряжение, создаваемое элементом, будет несколько меньше, чем ΔЕ0. Если концентрации растворов отличаются от стандартных, равных 1 моль/л, то Е0ок и Е0восст вычисляются по уравнению Нернста, а затем вычисляется э.д.с. соответствующего гальванического элемента.
Сухой элемент состоит их цинкового корпуса, пасты NH4Cl с крахмалом или мукой, смеси MnO2 с графитом и графитового электрода. В ходе его работы идет реакция: Zn + 2NH4Cl + 2MnO2 = [Zn(NH3)2]Cl + 2MnOOH.
Схема элемента: (-)Zn | NH4Cl | MnO2, C(+). Э.д.с. элемента – 1,5 В.
Аккумуляторы. Свинцовый аккумулятор представляет собой две свинцовые пластины, погруженные в 30%-ный раствор серной кислоты и покрытые слоем нерастворимого PbSO4. При заряде аккумулятора на электродах идут процессы:
PbSO4(тв) + 2ē → Рb(тв) + SO42-
PbSO4(тв) + 2H2O → РbO2(тв) + 4H+ + SO42- + 2ē
При разряде аккумулятора на электродах идут процессы:
РЬ(тв) + SO42- → PbSO4(тв) + 2ē
РbO2(тв) + 4H+ + SO42- + 2ē → PbSO4(тв) + 2Н2O
Суммарную реакцию можно записать в виде:
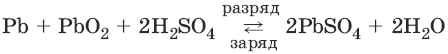
Для работы аккумулятор нуждается в регулярной зарядке и контроле концентрации серной кислоты, которая может несколько уменьшаться при работе аккумулятора.
6. Растворы
6.1. Концентрация растворов
Массовая доля вещества в растворе w равна отношению массы растворенного вещества к массе раствора: w = mв-ва/mр-ра или w = mв-вa/(V × ρ), так как mр-ра = Vp-pa × ρр-ра.
Молярная концентрация с равна отношению числа молей растворенного вещества к объему раствора: с = n(моль)/V(л) или с = m/(М × V(л)).
Молярная концентрация эквивалентов (нормальная или эквивалентная концентрация) сэ равна отношению числа эквивалентов растворенного вещества к объему раствора: сэ = n(моль экв.)/V(л) или сэ = m/(Мэ × V(л)).
6.2. Электролитическая диссоциация
Электролитическая диссоциация – распад электролита на катионы и анионы под действием полярных молекул растворителя.
Степень диссоциации α – отношение концентрации диссоциированных молекул (сдисс) к общей концентрации растворенных молекул (соб): α = сдисс/соб.
Электролиты можно разделить на сильные (α ~ 1) и слабые.
Сильные электролиты (для них α ~ 1) – соли и основания, растворимые в воде, а также некоторые кислоты: HNO3, HCl, H2SO4, HI, HBr, HClO4 и другие.
Слабые электролиты (для них α << 1) – Н2O, NH4OH, малорастворимые основания и соли и многие кислоты: HF, H2SO3, H2CO3, H2S, CH3COOH и другие.
Ионные уравнения реакций. В ионных уравнениях реакций сильные электролиты записываются в виде ионов, а слабые электролиты, малорастворимые вещества и газы – в виде молекул. Например:
CaCO3↓ + 2HCl = CaCl2 + Н2O + CO2↑
CaCO3↓ + 2H+ + 2Cl¯ = Са2+ + 2Cl¯ + Н2O + CO2↑
CaCO3↓ + 2Н+ = Са2+ + Н2O + CO2↑
Реакции между ионами идут в сторону образования вещества, дающего меньше ионов, т. е. в сторону более слабого электролита или менее растворимого вещества.
6.3. Диссоциация слабых электролитов
Применим закон действия масс к равновесию между ионами и молекулами в растворе слабого электролита, например уксусной кислоты:
CH3COOH ↔ CH3COО¯ + Н+
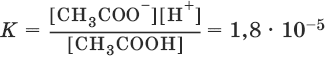
Константы равновесия реакций диссоциации называются константами диссоциации. Константы диссоциации характеризуют диссоциацию слабых электролитов: чем меньше константа, тем меньше диссоциирует слабый электролит, тем он слабее.
Многоосновные кислоты диссоциируют ступенчато:
Н3PO4 ↔ Н+ + Н2PO4¯
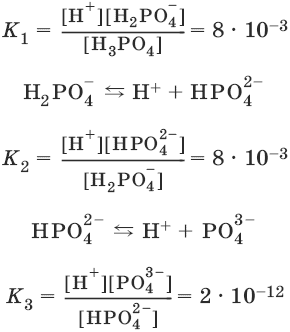
Константа равновесия суммарной реакции диссоциации равна произведению констант отдельных стадий диссоциации:
Н3PO4 ↔ ЗН+ + PO43-
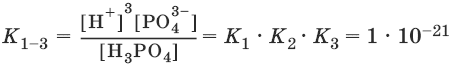
Закон разбавления Оствальда: степень диссоциации слабого электролита (а) увеличивается при уменьшении его концентрации, т. е. при разбавлении:
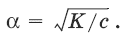
Влияние общего иона на диссоциацию слабого электролита: добавление общего иона уменьшает диссоциацию слабого электролита. Так, при добавлении к раствору слабого электролита CH3COOH
CH3COOH ↔ CH3COО¯ + Н+ α << 1
сильного электролита, содержащего общий с CH3COOH ион, т. е. ацетат-ион, например CH3COОNa
CH3COОNa ↔ CH3COО¯ + Na+ α = 1
концентрация ацетат-иона увеличивается, и равновесие диссоциации CH3COOH сдвигается влево, т. е. диссоциация кислоты уменьшается.
6.4. Диссоциация сильных электролитов
Активность иона а – концентрация иона, проявляющаяся в его свойствах.
Коэффициент активности f – отношение активности иона а к концентрации с: f = а/с или а = fc.
Если f = 1, то ионы свободны и не взаимодействуют между собой. Это имеет место в очень разбавленных растворах, в растворах слабых электролитов и т. д.
Если f < 1, то ионы взаимодействуют между собой. Чем меньше f, тем больше взаимодействие между ионами.
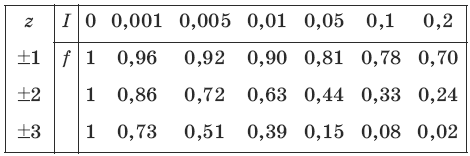
Коэффициент активности зависит от ионной силы раствора I: чем больше ионная сила, тем меньше коэффициент активности.
Ионная сила раствора I зависит от зарядов z и концентраций с ионов:
I = 0,52Σс • z2.
Коэффициент активности зависит от заряда иона: чем больше заряд иона, тем меньше коэффициент активности. Математически зависимость коэффициента активности f от ионной силы I и заряда иона z записывается с помощью формулы Дебая-Хюккеля:
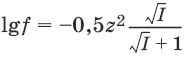
Коэффициенты активности ионов можно определить с помощью следующей таблицы:
6.5 Ионное произведение воды. Водородный показатель
Вода – слабый электролит – диссоциирует, образуя ионы Н+ и OH¯. Эти ионы гидратированы, т. е. соединены с несколькими молекулами воды, но для простоты их записывают в негидратированной форме
Н2O ↔ Н+ + OH¯.
На основании закона действия масс, для этого равновесия:
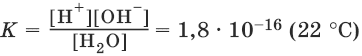
Концентрацию молекул воды [Н2O], т. е. число молей в 1 л воды, можно считать постоянной и равной [Н2O] = 1000 г/л : 18 г/моль = 55,6 моль/л. Отсюда:
К • [Н2O] = К(Н2O) = [Н+] • [OH¯] = 10-14 (22°C).
Ионное произведение воды – произведение концентраций [Н+] и [OH¯] – есть величина постоянная при постоянной температуре и равная 10-14 при 22°C.
Ионное произведение воды увеличивается с увеличением температуры.
Водородный показатель рН – отрицательный логарифм концентрации ионов водорода: рН = – lg[H+]. Аналогично: pOH = – lg[OH¯].
Логарифмирование ионного произведения воды дает: рН + рOH = 14.
Величина рН характеризует реакцию среды.
Если рН = 7, то [Н+] = [OH¯] – нейтральная среда.
Если рН < 7, то [Н+] > [OH¯] – кислотная среда.
Если рН > 7, то [Н+] < [OH¯] – щелочная среда.
6.6. Буферные растворы
Буферные растворы – растворы, имеющие определенную концентрацию ионов водорода. рН этих растворов не меняется при разбавлении и мало меняется при добавлении небольших количеств кислот и щелочей.
I. Раствор слабой кислоты НА, концентрация – скисл, и ее соли с сильным основанием ВА, концентрация – ссоли. Например, ацетатный буфер – раствор уксусной кислоты и ацетата натрия: CH3COOH + CHgCOONa.
рН = рКкисл + lg(ссоли/скисл).
II. Раствор слабого основания ВOH, концентрация – сосн, и его соли с сильной кислотой ВА, концентрация – ссоли. Например, аммиачный буфер – раствор гидроксида аммония и хлорида аммония NH4OH + NH4Cl.
рН = 14 – рКосн – lg(ссоли/сосн).
6.7. Гидролиз солей
Гидролиз солей – взаимодействие ионов соли с водой с образованием слабого электролита.
Примеры уравнений реакций гидролиза.
I. Соль образована сильным основанием и слабой кислотой:
Na2CO3 + H2O ↔ NaHCO3 + NaOH
2Na+ + CO32- + H2O ↔ 2Na+ + HCO3¯ + OH¯
CO32- + H2O ↔ HCO3¯ + OH¯, pH > 7, щелочная среда.
По второй ступени гидролиз практически не идет.
II. Соль образована слабым основанием и сильной кислотой:
AlCl3 + H2O ↔ (AlOH)Cl2 + HCl
Al3+ + ЗCl¯ + H2O ↔ AlOH2+ + 2Cl¯ + Н+ + Cl¯
Al3+ + H2O ↔ AlOH2+ + Н+, рН < 7.
По второй ступени гидролиз идет меньше, а по третьей ступени практически не идет.
III. Соль образована сильным основанием и сильной кислотой:
KNO3 + H2O ≠
К+ + NO3¯ + Н2O ≠ нет гидролиза, рН ≈ 7.
IV. Соль образована слабым основанием и слабой кислотой:
CH3COONH4 + H2O ↔ CH3COOH + NH4OH
CH3COO¯ + NH4+ + H2O ↔ CH3COOH + NH4OH, рН = 7.
В ряде случаев, когда соль образована очень слабыми основаниями и кислотами, идет полный гидролиз. В таблице растворимости у таких солей символ – «разлагаются водой»:
Al2S3 + 6Н2O = 2Al(OH)3↓ + 3H2S↑
Возможность полного гидролиза следует учитывать в обменных реакциях:
Al2(SO4)3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3Na2SO4 + 3CO2↑
Степень гидролиза h – отношение концентрации гидролизованных молекул к общей концентрации растворенных молекул.
Для солей, образованных сильным основанием и слабой кислотой:
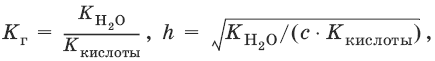
[OH¯] = ch, рOH = – lg[OH¯], рН = 14 – рOH.
Из выражения следует, что степень гидролиза h (т. е. гидролиз) увеличивается:
а) с увеличением температуры, так как увеличивается K(H2O);
б) с уменьшением диссоциации кислоты, образующей соль: чем слабее кислота, тем больше гидролиз;
в) с разбавлением: чем меньше с, тем больше гидролиз.
Для солей, образованных слабым основанием и сильной кислотой
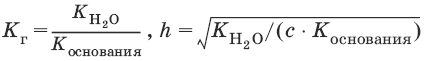
[Н+] = ch, рН = – lg[H+].
Для солей, образованных слабым основанием и слабой кислотой
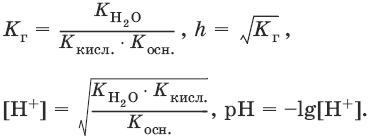
6.8. Протолитическая теория кислот и оснований
Протолиз – процесс передачи протона.
Протолиты – кислоты и основания, отдающие и принимающие протоны.
Кислота – молекула или ион, способные отдавать протон. Каждой кислоте соответствует сопряженное с нею основание. Сила кислот характеризуется константой кислоты Кк.
Н2CO3 + Н2O ↔ Н3O+ + HCO3¯
Кк = 4 × 10-7
[Al(Н2O)6]3+ + Н2O ↔ [Al(Н2O)5OH]2+ + Н3O+
Кк = 9 × 10-6
Основание – молекула или ион, способные принимать протон. Каждому основанию соответствует сопряженная с ним кислота. Сила оснований характеризуется константой основания К0.
NH3 × Н2O (Н2O) ↔ NH4+ + OH¯
К0= 1,8 ×10-5
Амфолиты – протолиты, способные к отдаче и к присоединению протона.
HCO3¯ + H2O ↔ Н3O+ + CO32-
HCO3¯ – кислота.
HCO3¯ + H2O ↔ Н2CO3 + OH¯
HCO3¯ – основание.
Для воды: Н2O+ Н2O ↔ Н3O+ + OH¯
K(H2O) = [Н3O+][OH¯] = 10-14 и рН = – lg[H3O+].
Константы Кк и К0 для сопряженных кислот и оснований связаны между собой.
НА + Н2O ↔ Н3O+ + А¯,
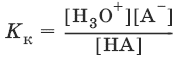
А¯ + Н2O ↔ НА + OH¯,
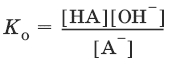
Отсюда
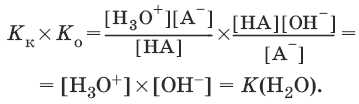
7. Константа растворимости. Растворимость
В системе, состоящей из раствора и осадка, идут два процесса – растворение осадка и осаждение. Равенство скоростей этих двух процессов является условием равновесия.
Насыщенный раствор – раствор, который находится в равновесии с осадком.
Закон действия масс в применении к равновесию между осадком и раствором дает:
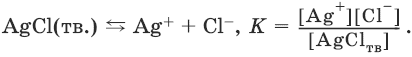
Поскольку [AgClтв] = const,
К • [AgClтв] = Ks(AgCl) = [Ag+] • [Cl¯].
В общем виде имеем:
АmBn(тв.) ↔ mA+n + nB-m
Ks(AmBn) = [А+n]m • [В-m]n.
Константа растворимости Ks (или произведение растворимости ПР) – произведение концентраций ионов в насыщенном растворе малорастворимого электролита – есть величина постоянная и зависит лишь от температуры.
Растворимость малорастворимого вещества s может быть выражена в молях на литр. В зависимости от величины s вещества могут быть разделены на малорастворимые – s < 10-4 моль/л, среднерастворимые – 10-4 моль/л ≤ s ≤ 10-2 моль/л и хорошо растворимые s >10-2 моль/л.
Растворимость соединений связана с их произведением растворимости.
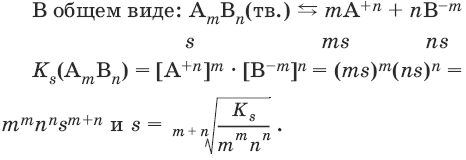
В случае AgCl: AgCl ↔ Ag+ + Cl¯
Ks = [Ag+] • [CI¯]:
а) условие равновесия между осадком и раствором: [Ag+] • [Cl¯] = Ks.
б) условие осаждения: [Ag+] • [Cl¯] > Ks; в ходе осаждения концентрации ионов уменьшаются до установления равновесия;
в) условие растворения осадка или существования насыщенного раствора: [Ag+] • [Cl¯] < Ks; в ходе растворения осадка концентрация ионов увеличивается до установления равновесия.
8. Координационные соединения
Координационные (комплексные) соединения – соединения с донорно-акцеп-торной связью.
Для K3[Fe(CN)6]:
ионы внешней сферы – 3К+,
ион внутренней сферы – [Fe(CN)6]3-,
комплексообразователь – Fe3+,
лиганды – 6CN¯, их дентатность – 1,
координационное число – 6.
Примеры комплексообразователей: Ag+, Cu2+, Hg2+, Zn2+, Ni2+, Fe3+, Pt4+ и др.
Примеры лигандов: полярные молекулы Н2O, NH3, CO и анионы CN¯, Cl¯, OH¯ и др.
Координационные числа: обычно 4 или 6, реже 2, 3 и др.
Номенклатура. Называют сначала анион (в именительном падеже), затем катион (в родительном падеже). Названия некоторых лигандов: NH3 – аммин, Н2O – акво, CN¯ – циано, Cl¯ – хлоро, OH¯ – гидроксо. Названия координационных чисел: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Указывают степень окисления комплек-сообразователя:
[Ag(NH3)2]Cl – хлорид диамминсеребра(I);
[Cu(NH3)4]SO4 – сульфат тетрамминмеди(II);
K3[Fe(CN)6] – гексацианоферрат(III) калия.
Химическая связь.Теория валентных связей предполагает гибридизацию орбиталей центрального атома. Расположение образующихся при этом гибридных орбиталей определяет геометрию комплексов.
Диамагнитный комплексный ион Fe(CN)64-.
Цианид-ион – донор
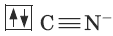
Ион железа Fe2+ – акцептор – имеет формулу 3d64s04p0. С учетом диамагнитности комплекса (все электроны спарены) и координационного числа (нужны 6 свободных орбиталей) имеем d2sp3-гибридизацию:
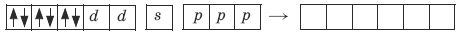
Комплекс диамагнитный, низкоспиновый, внутриорбитальный, стабильный (не используются внешние электроны), октаэд-рический (d2sp3-гибридизация).
Парамагнитный комплексный ион FeF63-.
Фторид-ион – донор.
Ион железа Fe3+ – акцептор – имеет формулу 3d54s04p0. С учетом парамагнитности комплекса (электроны распарены) и координационного числа (нужны 6 свободных орбиталей) имеем sp3d2-гибридизацию:
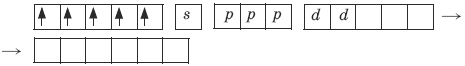
Комплекс парамагнитный, высокоспиновый, внешнеорбитальный, нестабильный (использованы внешние 4d-орбитали), октаэдрический (sp3d2-гибридизация).
Диссоциация координационных соединений.Координационные соединения в растворе полностью диссоциируют на ионы внутренней и внешней сфер.
[Ag(NH3)2]NO3 → Ag(NH3)2+ + NO3¯, α = 1.
Ионы внутренней сферы, т. е. комплексные ионы, диссоциируют на ионы металла и лиганды, как слабые электролиты, по ступеням.

где K1, К2, К1_2 называются константами нестойкости и характеризуют диссоциацию комплексов: чем меньше константа нестойкости, тем меньше диссоциирует комплекс, тем он устойчивее.



