
Полная версия
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ ХРОМОСОМ И ДИФФЕРЕНЦИРОВКА КЛЕТОК КРОВИ. STRUCTURAL ORGANIZATION OF CHROMOSOMES AND BLOOD CELL DIFFERENTIATION
Для у животных после анестезии эфиром брали стерильно 2—5 мл крови из яремной вены. Затем эритроциты осаждали 10%-м раствором желатины, плазму отсасывали и разводили в соотношении 1:2 питательной средой Игла или №199. После этого добавляли фитогемагглютинин в количестве 0,01 мл фирмы «Difco P» на 5 мл культуральной среды. Культивирование клеток проводили при 37 °С 72 ч. За 2 ч до окончания культивирования вводили колхицин из расчета 0,25 мкг на 1 мл культуры. Затем клетки осаждали центрифугированием (Захаров А. Ф., Бенюш В. А., Кулешов Н. П., Барановская Л. И., 1982). Все последующие манипуляции по обработке материала сходны с приготовлением хромосом из костного мозга животных. культивирования клеток периферической крови
методами равномерной и дифференциальной окрасок. Препараты хромосом красили
хромосом заблаговременно готовили 0,1% растворы азура и эозина на дистиллированной воде. Рабочий раствор красителя составляли в соотношении: 6 частей азура, 3 части эозина и 9 частей водопроводной воды, длительность окраски была около 15 мин. Затем препараты ополаскивали водопроводной водой и высушивали. Кроме того, для окраски использовали и готовую краску Романовского-Гимза. Ее разведение подбирали в зависимости от качества, чтобы время окраски было 10— 15 мин. Для равномерной окраски
хромосом проводили с учетом рекомендаций А. П. Дыбана и В. С. Баранова (1978). Перед окраской препараты погружали в этиловый спирт на 10— 15 мин, после чего высушивали их на воздухе. Затем препараты обрабатывали около 20 с 0,01% раствором трипсина производства фирмы «Spofa», ополаскивали в спирте и промывали водопроводной водой. Покраску проводили красителем Романовского-Гимза при разведении 1:10 фосфатным буфером (рН 7,0). Оптимальное время окрашивания подбирали эмпирически в зависимости от качества краски. Дифференциальную G -окраску
А также использовали рекомендации А. Ф. Захарова и соавторов (1982) о возможности добавления трипсина в раствор красителя на фосфатном буфере. Для получения G-окраски на каждые 10 мл красителя добавляли 0,3—0,5 мл 0,01% раствора трипсина, окраску препаратов проводили сразу после обработки этиловым спиртом.
Воспроизведение G-окраски зависело от индивидуальных особенностей крыс и сроков хранения препаратов, поэтому в каждом опыте подбор условий для окрашивания проводили эмпирически. При этом лучше красились препараты одно-двухнедельного хранения, хромосомные наборы самок были несколько устойчивее к трипсину и их подвергали большему воздействию фермента. В случае отсутствия дифференциальной окраски препараты отмывали в спирте и вновь повторяли обработку хромосом. А. Ф. Захаров и соавторы (1982) также отмечали, что ни одна из методик не дает хорошего воспроизведения дифференциальной окраски от опыта к опыту.
хромосом осуществляли с использова-нием гидрата окиси бария (Sumner А. Т., Evans H. J., Buckland R. A., 1971; Sumner A.T., 1972). Препараты в начале инкубировали в 0,2 М растворе соляной кислоты в течение 1 ч, затем промывали водой и обрабатывали в насыщенном растворе Ba (OH) 5—10 мин при комнатной температуре. После очередного ополаскивания водой стекла помещали в раствор 2xSSC (0,3 М NaCl и 0,3 М цитрата натрия, рН 7,0) при 60С на 1— 1,5 ч и отмывали в трех сменах этилового спирта. Высушенные препараты окрашивали раствором красителя Романовского-Гимза на фосфатном буфере при рН 6,8. Дифференциальную С-окраску 2 0
На С-окраску влияли также сроки хранения препаратов. Хромосомы с лучшей окраской получили при хранении препаратов 3—5 суток в условиях комнатной температуры, воздействии Ва (ОН) – 5 мин и инкубировании в 2xSSC 1 ч. 2
для анализа, как известно (Орлов B.Н., Чудиновская Г. А., Крюкова Е. П., 1976), принято проводить в количестве 20—50 шт. с полным числом хромосом, четко различимой морфологией и минимальным наложением, что нами и соблюдалось. При этом мы отбирали все пластинки с хорошей морфологией из популяции клеток костного мозга и из культуры периферической крови без выбора по степени спирализации. Отбор метафазных пластинок
Для исследования микропрепаратов применяли микроскопы Биолам, МББ-1А, МБИ-6, JENAVAL. Поиск метафазных пластинок вели при малом увеличении микроскопа, просматривая предметные стекла «челноком». Изучение хромосомных наборов осуществляли при большом увеличении под микроскопом, а также после микрофотосъемки на фотографиях и рисунках.
в метафазных пластинкахосуществляли на микрофотографиях и под микроскопом визуально с учетом положения центромеры и соотношения линейных параметров плеч. Морфологические типы определяли на основе известных рекомендаций по положению центромеры и длине плеч (Прокофьева-Бельговская А. А., 1969; Орлов B.Н., Чудиновская Г. А., Крюкова Е. П., 1976; Levan A., Fredga К., Sanderson A.A., 1964). При оценке считали, что у метацентрических хромосом плечи почти равной длины, у субметацентрических – положение центромеры несколько смещено от середины, у субтелоцентрических – плечи резко неравной длины, у акроцентрических хромосом центромера имеет терминальное расположение и второе плечо почти незаметно. Морфометрический анализ и идентификацию морфоструктуры также осуществляли по соотношению линейных параметров плеч: у метацентрических хромосом – 1—1,7, субметацентрических – 1,7—3, субтелоцентрических —3,0—7,0 и акроцентрических – 7 и более (Орлов B.Н., Чудиновская Г. А., Крюкова Е. П.,1976). Идентификацию морфологии хромосом
провели по известным рекомендациям для изучения кариотипа человека (Захаров А. Ф., Бенюш В.А, Кулешов Н. П., Барановская Л. И., 1982). Распределение метафазных хромосом по группам
осуществляли с учетом количестваакроцентрических и метацентрических хромосом. При одинаковом числе хромосом 42 в типе I имелось 26 акроцентрических и 14 метацентрических, соответственно в типе II – 24 и 16 и в типе III – 22 и 18. Кроме того, в каждом из типов присутствовала одна пара самых больших субтелоцентрических хромосом. Идентификацию трех типов хромосомных наборов
хромосом выполняли с учетом известных приемов (Паушева З. П.,1970; Орлов B.Н., Чудиновская Г. А., Крюкова Е. П.,1976), но в нашей модификации (Чабала Л. И., 1988), что позволило точнее снимать параметры в микрометрах с рисунков или отображения с негатива. Измерение линейных параметров
Известен способ измерения микрообъектов в микрометрах под микроскопом с помощью шкалы окуляр-микрометра (Паушева З. П.,1970). При изучении хромосом на микроскопе МББ-1 под объективом 90 используют окуляр с увеличением 7, имеющий приспособление для окуляр-микрометра. В этом случае цена одного деления окуляр-микрометра равна 2 мкм.
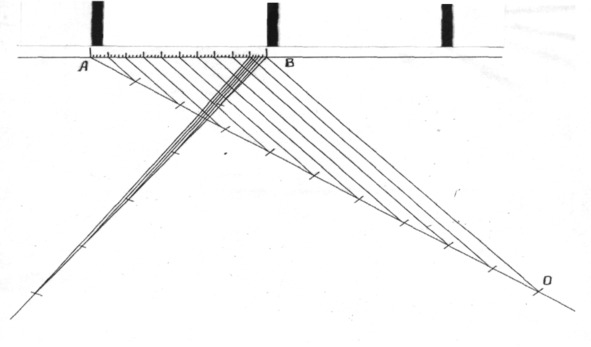
Но у крыс большинство хромосом имеют линейные параметры 2 мкм и меньше. Следовательно, цена одного деления окуляр-микрометра 2 мкм является довольно большой величиной и не позволяет точно снять параметры с изучаемых нами объектов. Кроме того, при большом числе хромосом в кариотипе последовательно выделить и измерить каждую из них под микроскопом чрезвычайно трудно. В этой связи нами разработан способ измерения абсолютных линейных параметров хромосом, который позволяет проводить анализы с более высокой точностью. Для этого мы фотографировали при одном и том же увеличении хромосомные наборы и линейку объект-микрометра, затем их с негатива увеличивали также при одних и тех же условиях и измерение хромосом проводили линейкой-шкалой, построенной на основе линейки объект-микрометра (рис. 2).
Рис.2. Микрофотография линейки объект-микрометра и
построение линейки-шкалы для измерения хромосом
Цена 1-ого деления линейки объект – микрометра, как известно, составляет 0,01 мм или 10 мкм. Фотографии таких участков в 10 мкм после увеличения показаны на рис. 2. На одном из них строили по теореме Фалеса линейку-шкалу для измерения хромосом. Для этого из крайней точки А провели под углом луч АО, отложили на нем 10 конгруэнтных отрезков и последнюю точку О соединили с точкой В калибруемого участка. Затем параллельно прямой ОВ из остальных 9 точек луча провели линии, разделившие калибруемый участок на 10 конгруэнтных отрезков, каждый из которых соответствовал 1 мкм. Последние аналогичным образом поделили еще на пять частей и получили отрезки с ценой 0,2 мкм. Эту линейку-шкалу использовали для измерения линейных параметров хромосом.
проводили с помощью фотонасадочной камеры и аппаратом «Зенит» или «Зоркий» на пленку микрат-300. Фотосъемку осуществляли при увеличении объектива 90, апп. 1,30, ок.10 или 15 с фиолетовым светофильтром. Микрофотографирование
клеток в костном мозге определяли путем подсчета числа клеток во всех фазах митоза, встречающихся при просмотре 6000 клеток, а затем пересчитывали их количество на 1000 штук (Бобкова Н. Н., 1981). Митотическую активность
2.4. Методы исследования кроветворных клеток
распознавали с учетом данных гемма-тологического атласа М. Г. Абрамова (1979, 1985) и «Руководства по гемато-логии» (Тодоров И., 1963). Морфологические типы клеток
изучали на микропрепаратах клеток костного мозга. Для этого делали отпечатки клеток на предметные стекла, их фиксировали в метиловом спирте и для покраски использовали азур-эозин по Романовскому-Гимзе. Концентрацию рабочего раствора и время окраски подбирали эмпирически. Разбавление краски проводили дистиллированной водой с рН 6,8—7,0. Это обусловлено тем, что при кислой или щелочной реакции рабочего раствора изменяется тональность окраски органоидов клетки и время прокрашивания. Кислую воду (рН ниже 6,8) подщелачивали по каплям 1%-ым раствором карбоната натрия, щелочную (рН выше 7,0) подкисляли 1% – ым раствором уксусной кислоты (Тодоров И., 1963). Лейкоэритробластическое соотношение
Рабочий раствор готовили перед окраской препаратов в небольшом количестве. Например, для покраски одного препарата разводили 4 капли краски в 2 мл дистиллированной воды, время окраски было 13 минут.
На препаратах отпечатков клеток костного мозга считали соотношение клеток эритроидного и лейкоцитарного рядов в расчете на 500 клеток.
считали на препаратах из костного мозга для анализа хромосом, их количество определяли на 6000 клеток костного мозга и затем пересчитывали на 1000 штук. Мегакариоциты
проводили по следующей методике. Кровь для анализа брали у крысы из хвостовой вены, при этом хвост подогревали в теплой воде, затем надрезали. После взятия крови надрез смазывали йодом (Ахметов И. З., 1981). Подсчет клеток крови выполняли в счетной камере Горяева определенного объема, поделенной на квадраты, которые вышлифованы в особой стеклянной пластинке. Подсчет лейкоцитов в крови
Кровь разводили в пробирках в отношении 1:20 3%-ым раствором уксусной кислоты, подкрашенной генцианфиолетом. Камеру заполняли разведенной кровью, накрывали покровным стеклом и под микроскопом проводили подсчет в 100 средних квадратах, имеющих длину 1/5 мм, то есть в объеме 2/5 куб. мм. Для пересчета количества лейкоцитов в 1 куб. мм умножали число лейкоцитов, обнаруженных в камере, на число, показывающее во сколько раз подсчитанный объем меньше 1 куб. мм (число, обратное величине подсчитанного объема, то есть 5/2), и степень разведения (Тодоров И., 1963).
2.5. Статистическая обработка
Статистическую обработкурезультатов исследований осуществляли на основе рекомендаций Е. К. Меркурьевой (1970), Е. М. Четыркина, И. Л. Калихмана (1982). Мы определяли ошибку средней арифметической и средней взвешенной по методу Стъюдента, а также достоверность разности между средними арифметическими двух выборок. Взаимосвязь исследуемых признаков оценивали с помощью коэффициента корреляции и корреляционного отношения.
Статистическую обработку экспериментальных данных проводили и по соответствующим программам с использованием ЭВМ.
Кроме того, при анализе полученных опытных результатов наблюдений от разных периодов онтогенеза и сроков использовали множественный регрессионный анализ и создали аппроксимирующие уравнения. Выбор класса аппроксимирующей функции осуществляли с учетом характера связи исследуемых признаков и на основе значений, полученных экспериментальным путем. Расчет коэффициентов уравнений проведен по специальной программе, реализованной на ЭВМ ЕС-1840 (Исследования…, 1991). Она предназначена для решения задач, связанных с построением аппроксимирующих уравнений исследуемых зависимостей малоинформативных членов из предварительно полученного уравнения. В качестве показателей точности и адекватности аппроксимации описываемых зависимостей использованы коэффициенты детерминации регрессии (квадрат коэффициента множественной корреляции) и стандартное отклонение полученной аппроксимирующей функции.
Коэффициент детерминации регрессии является мерой эффективности регрессионной модели и выражает собой отношение суммы квадратов отклонений значений от среднего, обусловленных регрессией, к сумме квадратов полных отклонений экспериментальных данных от среднего в соответствующих точках. Таким образом, коэффициент детерминации регрессии измеряет долю общего разброса относительно среднего, а также показывает насколько полно выбранное уравнение аппроксимации характеризует рассматриваемую зависимость.
Стандартное отклонение остатков показывает разброс отклонений выборочных значений зависимой переменной от поверхности отклика, описываемой аппроксимирующим уравнением.
Глава 3 Структурно-функциональные преобразования метафазных хромосом в популяции клеток костного мозга
3.1. Явление вариабельности метафазных хромосом в костном мозге и классификация хромосомных наборов
У объекта наших исследований в популяции клеток костного мозга мы находили в клетках диплоидное число хромосом 42 (Чабала Л. И., 1986, 1988, 1991; Чабала Л. И., Машкин С. И., 1990; Чабала Л. И., Сливкин А. И., Чабала В. А., 2011), что совпадало с данными других исследователей. Но нами на уровне клеточной популяции костного мозга выявлено явление структурно-функциональных изменений в организации метафазных хромосом в популяции клеток костного мозга у каждой особи Rattus norvegicus. А это является новым фактом в науке и отличием от ранее описанного в литературе полиморфизма хромосом при характеристике вида.
Для анализа обнаруженного явления нами разработана новая условная классификация с учетом линейных параметров, формы и структурной изменчивости хромосом. При этом мы использовали известные подходы к классификации хромосом человека, выработанные на международных совещаниях (Захаров А. Ф. и др., 1982).
Хромосомы в нашей классификации распределили на 7 групп от A до G в порядке уменьшения линейных параметров, с учетом морфологической структуры и дифференциальной окраски различных пар. Аутосомные пары пронумеровали с 1 по 20, последовательность их расположения совпадала с ранее принятой классификацией лишь по 1 – 6 паре. Для идентификации половых хромосом использовали принятый принцип исключения их из гомологичных пар с учетом индивидуальной морфологии и особенностей окраски, а также выводы Бекасовой Т. С. (1980) и других авторов (Yosida T.H., Sagai T., 1973; Satoh R. и др., 1989), что X – хромосома большая и Y – самая мелкая акроцентрические.
Групповая идентификация хромосом показана на идеограмме (рис. 3). В группах А, В и С расположены наиболее крупные хромосомы, но А имеет одну пару субтелоцентриков (1), В – пять пар акроцентриков и Х- хромосому (2-Х-6), а С содержит три пары метацентрических аутосом (7—9).
В следующих двух группах D и Е находятся по три пары средних по размерам хромосом, в первой из них акроцентрические (10—12), а во второй – метацентрические (13 – 15 пары). Группы F и G включили остальные самые мелкие хромосомы, но в F – акроцентрические и V- хромосому, а в G – метацентрические.
Итак, самые крупные легко распознаваемые субтелоцентрические хромосомы находятся в группе A. Соотношение плеч у них варьировало в большинстве случаев от 3 до 4,5, но иногда это значение было около 5.
Рис. 3. Идиограммы хромосомных наборов трех типов
из клеток костного мозга самцов крыс
Группа B имеет 5 пар самых больших акроцентрических одноплечих аутосом и X – хромосому. Среди них по наибольшим размерам выделяется пара 2. Следующая пара чаще всего выглядела как резко акроцентрическая с расположением центромеры в конце плеч, но иногда у одного или обоих гомологов наблюдали спутники. При этом соотношение плеч у хромосом было от 6,6 до 9, то есть форма варьировала в принятых пределах акроцентрического типа. Полиморфизм у этой пары хромосом, связанный с появлением спутников, был ранее описан для разных популяций крыс (Бекасова Т. С., 1980; Yosida Т. H., Amano K., 1965). Но в наших исследованиях спутники у пары 3, а иногда у более мелких хромосом в этой группе наблюдали на уровне популяции клеток костного мозга.
Группа C содержит три пары наиболее крупных метацентрических хромосом и близких к ним. У аутосом этой группы иногда наблюдали изменение соотношений плеч, и их значение было 2 – 2,3, следовательно, форма таких хромосом приближалась к субметацентрической.
Группы D и E имеют по три пары аутосом, средних по размерам и константным по форме, но в D – акроцентрические, а в E – метацентрические.
Группы F и G объединяют самые мелкие хромосомы, но в F – акроцентрические и близкие к ним со смещением центромеры к концу плеч, а в G – метацентрические с соотношением плеч от 1 до 1,7.
В некоторых клетках хромосомы 16 пары из группы F имели спутники. Соотношение плеч у них было от 4,6 до 7,6, то есть имели субтелоцентрический фенотип. Более значительные изменения вследствие варьирования длины плеч обнаружили у двух других пар хромосом: 18 и 19, морфологическая структура которых изменялась от акроцентрической до метацентрической. Поэтому их относили или к группе F или G. С учетом этой изменчивости выделили три типа хромосомных наборов в популяции клеток костного мозга и по количеству пар метацентриков в группе G их обозначили как типы I, II и III.
Таким образом, первые пять групп: A, B, C, D и E состояли из хромосом с относительно стабильной формой. Две последние группы F и G включали хромосомы с лабильной формой вследствие различной структурной организации 18 и 19 пар хромосом в популяции кроветворных клеток костного мозга. В результате изменения длины плеч у хромосом наблюдали явление фенотипического их разнообразия и формирование разновидностей структурного полиморфизма у каждой особи. В этой связи имели тип I: 26 акроцентрических и 14 метацентрических, тип II: 24 акроцентрических и 16 метацентрических, тип III: 22 акроцентрических и 18 метацентрических хромосом и, кроме того, в каждом из них находилось по одной паре крупных субтелоцентрических аутосом (Чабала Л. И., 1986, 1987, 1988, 1991; Чабала Л. И., Машкин С. И., 1990; Чабала Л. И., Сливкин А. И., Чабала В. А., 2011).
Мы провели морфометрический анализ 40 метафазных пластинок, из них было типа I – 9, типа II – 17 и типа III – 14 шт., которые были получены от двух самцов и после 2 – часового воздействия колхицина. Морфометрические параметры хромосом в группах трех типов были следующими (табл. 2).
Таблица 2
Средние морфометрические параметры хромосомных наборов
трех типов из популяции клеток костного мозга
Р> 0,999
Многие исследователи достоверным критерием однородности метафазных хромосом по степени спирализации считали близкую длину одной или нескольких пар хромосом (Павульсоне С. А., Иорданский А. Б., 1971; Орлов В. Н., Булатова Н. Ш., 1983). Этот принцип прослеживается и в нашей выборке. Линейные параметры последней 20-ой метацентрической пары аутосом, то есть хромосом 41 и 42, были близкими. У первой из них в типах I, II и III, соответственно, составили 1,8±0,10; 1,8±0,06 и 1,9±0,06, а у второй – 1,7±0,12; 1,7±0,07 и 1,7±0,7 мкм (Р> 0,999) и при центромерном индексе выше 44%. Это свидетельствует о близкой степени спирализации ДНК у хромосом на стадии метафазы в наборах трех типов.
В группе A гомологи субтелоцентрических хромосом различались между собой в разных типах по длине на 0,2—0,3 мкм, а по центромерному индексу – на 0,1—0,4%. Наименьшие хромосомы 4,3 и 4,1 мкм в среднем и с самым малым центромерным индексом 18,2 и 18,6% в среднем находили в типе I. В типах II и III эти показатели были несколько выше.
В группе B, то есть у 2 – 6 пар акроцентриков, линейные параметры наименьшие были также в типе I: от 3,8 до 2,3 мкм. В типе II они уменьшались от 4,5 до 2,7 мкм и в типе III – от 4,6 до 2,7 мкм в среднем. В этой группе больше сходства по длине было среди хромосом из типов II и III.
В группе С у 7- 9 пар метацентриков имеет место дальнейшее плавное уменьшение длины и в типе I с 2,5 до 2,3 мкм, в типе II – с 2,8 до 2,4 мкм и в типе III – с 2,8 до 2,6 мкм, центромерный индекс был выше 40%. При этом у хромосом №16 и 19 в типах I и II значения линейных параметров отличались незначительно при центромерном индексе выше 43%.
В группах D и E, объединивших средние по линейным параметрам хромосомы, но в первой из них акроцентрические, а во второй метацентрические, размеры также убывали. В типе I аутосомы были от 2,3 до 2,1 и от 2,2 до 2,0 мкм, в типе II – от 2,7 до 2,4 и от 2,3 до 2,0 мкм, в типе III – от 2,7 до 2,4 и от 2,5 до 2,2 мкм в среднем.
Центромерный индекс у хромосом группы Е был выше 43% в типе I, в типах II и III – выше 46%. При этом у метацентрических хромосом №№26 и 31 из типов I и II значения линейных параметров отличались незначительно или совпадали при центромерном индексе выше 44%.
В группах F и G, где расположены наименьшие акроцентрические и метацентрические хромосомы, наблюдали дальнейшее уменьшение линейных параметров, соответственно: в типе I от 2,0 до 1,0 и 1,8 – 1,7 мкм, в типе II – от 2,4 до 1,6 и от 1,9 до 1,7 мкм, в типе III – от 2,3 до 1,8 и от 2,1 до 1,7 мкм. в среднем. В типах II и III акроцентрические хромосомы по размерам мало отличались. У хромосом группы G центромерный индекс был во всех типах выше 44,5% в среднем и их длина была близкой.
У полиморфных хромосом линейные размеры находили наибольшими в типе III, где они метацентрические, и наименьшими в типе I, где они акроцентрические. Так, хромосомы №№39 и 40 имели линейные параметры в типе I, соответственно, 1,2 ± 0,06 и 1,0 ± 0,05 мкм, а в типе III гомологи были одинаковые и составили 2,0 ± 0,05 мкм.
Таким образом, среди трех типов наблюдали наименьшие линейные параметры у хромосом в типе I. Морфометрические исследования показали, что у субтелоцентрических и большинства акроцентрических хромосом в трех типах процесс спирализации проходит неодинаково и наиболее интенсивно в типе I, за счет чего формировались более мелкие хромосомы. У метацентрических хромосом различия между тремя типами были менее значительные. Эти особенности определяются индивидуальными свойствами хромосом и режимами упаковки ДНК в метафазных хромосомах из разных клеток. Ранее А. Б. Иорданский и соавторы (1974) также пришли к выводу, что каждая хромосома в процессе митоза имеет свой режим конденсации вследствие индивидуальных структурно-функциональных свойств.
Морфометрический анализ метафазных хромосом из популяции клеток костного мозга крыс также показал специфический режим конденсации по упаковке ДНК на уровне трех типов. Это связано с их подготовкой к дифференцировке в направлении лейкоцитов, мегакариоцитов и эритроцитов.
На идиограмме (см. рис. 3) видно, что при расположении хромосом в порядке уменьшения их длины и с выделением групп больших, средних, малых акроцентриков и метацентриков имеются отдельные исключения. В группе G метацентрики были несколько крупнее в сравнении с рядом расположенной пары акроцентриков и особенно в типе I. В этом же типе последняя пара хромосом имела линейные параметры несколько больше предпоследней пары из группы F. Центромерный индекс варьировал в трех типах незначительно. В основном визуально прослеживается уменьшение линейных параметров хромосом по группам. Наименьшие хромосомы были в типе I.
По средним данным морфометрии хромосом построены поликариограммы (рис. 4) в системе двух координат, где на одной из них отображали длину хромосом в мкм, а на другой – центромерный индекс в процентах.
· – субтелоцентрические, акроцентрические и большие
метацентрические хромосомы; x – средние метацентрические хромосомы; o – малые метацентрические хромосомы
Рис. 4. Поликариограммы хромосомных наборов трех типов самцов крыс
В результате были наименьшие границы изменчивости линейных параметров хромосом из типа I и наибольшие – в типе II, тип III занимает промежуточное положение. Следовательно, у субтелоцентрических и акроцентрических хромосом в разных типах наборов процесс спирализации и упаковки ДНК проходит неодинаково и более интенсивно в типе I. За счет этого там образуются хромосомы с наименьшими линейными параметрами. В неадекватности линейных параметров по степени спирализации и упаковки ДНК одних и тех же хромосомных пар из разных типов проявляются их различные функционально-генетические, а затем и физиологические свойства в разных ростках кроветворных клеток. Через различную изменчивость морфологии хромосом в трех типах проявляются функциональные и генетические различия между ними.

