
Полная версия
Кислотно-щелочное состояние и процесс кислотообразования

Алексей Орган
Кислотно-щелочное состояние и процесс кислотообразования

«Существует прямая зависимость между концентрацией углекислоты в крови и интенсивностью функционирования пищеварительных желез (слюнных, поджелудочной, печени), а так желез слизистой желудка,
образующих соляную кислоту»
Зубков А.Н., Очаповский А.П.
Кишинэу 2025
Глава I. Физиологические механизмы
Кислотно-щелочное состояние или равновесие (КЩР) является одним из основных показателей состояния обменных процессов крови и тканей, которое наряду с белковым, углеводным, жировым и водно-солевым обменом принадлежит к основным условиям гомеостаза.
Кровь и ткани человека в основном состоят из воды, содержание ее достигает 70% от веса тела. Вода обладает способностью распадаться на положительно заряженные ионы водорода Н+ (катионы) и отрицательно заряженные ионы так называемых гидроксильных групп ОН- (анионы). Перевес тех или иных зарядов сдвигает химический состав воды, а значит, крови и тканей человека либо в сторону кислотности (при избытке катионов), либо в сторону щелочности (при избытке анионов). Соотношение положительных и отрицательных зарядов определяет активную реакцию раствора, величина которой характеризуется водородным показателем рН.
Кислотно.щелочное равновесие в организме человека и есть то равновесное состояние водородных и гидроксильных ионов. Норма величины рН – 7,37-7,47. Сдвиг рН ниже 7,0 (превалирование катионов) приводит к закислению крови и угнетению функций центральной нервной системы. Сдвиг рН выше 7,8 (превалирование анионов) приводит к защелачиванию организма и чрезмерному психическому возбуждению
(см. сх. 91).
Норма и патология рН . Таблица №1
рН 7,47
ОН- Рост концентрации ОН-
Защелачивание-алкалоз
Перевозбуждение ЦНС
(патология)
Равновесие Н+ и ОН- в крови
(норма)
рН 7,37
Рост концентрации Н+
Закисление – ацидоз
Угнетение ЦНС
Н+ (патология)
По данным некоторых авторов (Зильбер А.П., 1984) рН крови в нормальных условиях обмена составляет 7,36-7,44.
В реальной жизни человека всегда имеются факторы для сдвига КЩС в ту или иную сторону (B.Pacк, 2007).
На физиологическом плане отклонение рН в сторону закисления предрасполагает к:
– повышению (выше нормы) кислотности желудочного сока;
– загустению плазмы крови;
– гипотонии;
– тромбозам;
– ожирению;
– запорам.
Отклонение рН в сторону защелачивания приводит к:
– снижению (ниже нормы) кислотности желудочного сока;
– разжижению плазмы крови;
– гипертонии;
–артритам;
– поносам.
Кроме того, сбой кислотно-щелочного равновесия оказывает негативное влияние на активность ферментов и витаминов, а следовательно, на обмен веществ и работу иммунной системы, подсистема комплемента которой целиком состоит из ферментов – золотого фонда человеческого организма.
Учитывая разносторонний механизм воздействия отклонений рН на организм, можно даже утверждать, что эти отклонения зачастую конструируют характер и поведенческие функции человека, а именно;
– повышенная кислотность-инертность, слабость, пассивность, т.е. те же симптомы, что провоцирует работа женских половых гормонов – эстрогенов;
– повышенная щелочность – возбудимость, агрессивность, подвижность, т.е. те же симптомы, что провоцирует работа мужских половых гормонов – андрогенов. (В.Раск, 2007).
Некоторые авторы считают, что в общем случае КЩР крови у каждого человека можно определить по цвету конъюнктивы глаз;
– бледно-розовый – отклонение в сторону повышенной кислотности;
– темно-розовый – отклонение в сторону повышенной щелочности;
– ярко-розовый – норма.
Основными продуктами метаболизма в клетке являются кислоты, которые диссоциируют с освобождением активных ионов Н+. Внутриклеточная жидкость окисляется, часть ионов нейтрализуется буферной системой клетки. Если концентрация ионов водорода превышает предел мощности клеточной буферной системы, то они покидают клетку вместе с ионами Na+ и HCO3 _ (механизм «натриевого насоса»). В межклеточной среде ионы Н+ вступают в контакт с буферной системой тканевой жидкости, затем включаются почечные механизмы компенсации и концентрация ионов водорода во внеклеточной жидкости выравнивается. В клетку в обмен на Н+ проникает ион К+, который обладает способностью деполяризовать клеточную мембрану. Калий стимулирует окислительно-восстановительные процессы в клетке, восстанавливает потенциал клеточной мембраны, и в результате обмена вновь освобождаются ионы Н+.
Часть кислых продуктов получается также в результате жирового (жирные кислоты, кетоновые тела) и белкового катаболизма (серная, фосфорная и мочевая кислоты, аминокислоты). Перечисленные выше кислоты в умеренном количестве образуются в процессе нормального метаболизма, но ритм их синтеза совпадает с ритмом нейтрализации. Если же по каким-либо причинам обменные процессы нарушаются, продукция нелетучих кислот повышается, а функциональная активность печеночно-почечного барьера заметно снижается.
Превышение буферной ёмкости крови и тканей, ведёт к декомпенсации метаболического ацидоза, сдвигу рН крови в кислую сторону, что сопровождается стимуляцией дыхательного центра, гипервентиляцией и сбросом углекислоты, т.е. к метаболическому ацидозу присоединяется дыхательный алкалоз.
Интегральным показателем кислотно-щелочного состояния является рН – символ, который отражает концентрацию ионов водорода в биологических жидкостях (отрицательный логарифм концентрации ионов водорода в 1 л раствора).
О рН внеклеточной жидкости судят по концентрации этих ионов в плазме. Клеточные жидкости изучены в этом отношении значительно меньше. Предполагают, что они менее щелочные (рН ниже на 0,1-0,3), больше зависят от электролитных сдвигов и что при одних и тех же условиях реакция внутри- и внеклеточной жидкости может меняться в противоположном направлении.
Доступных методов определения рН клеточных жидкостей пока нет, и на данном уровне знаний и практических возможностей реакция внеклеточных жидкостей представляет фон для регуляции внутриклеточных процессов.
Основные механизмы, обеспечивающие уравновешивание кислых ионов:
1) буферные системы крови и тканей;
2) электролитная перестройка во внутриклеточной и внеклеточной жидкостях;
3) изменение легочной вентиляции;
4) изменение выделительной функции почек.
Буферные системы крови многообразны и неравноценны по мощности и управляемости. Эти системы можно расположить в порядке снижения ёмкости буферных свойств в процентах от всей ёмкости крови:
Гидрокарбонатная система плазмы и эритроцитов 53.
Система гемоглобин-оксигемоглобин 35.
Протеиновая система плазмы 7.
Фосфатная система 5.
На основе клинико-физиологических исследований можно сделать следующие выводы (Зильбер А.П., 1984).
1. Повышение буферной ёмкости крови – это не только введение гидрокарбоната (что обычно практикуется), но и введение фосфатов, и коррекция гипопротеинемии, анемии, водно-электролитных сдвигов, и нормализация микроциркуляции.
2. Нормализация легочной вентиляции обеспечивает функциональную полноценность почек (секреция ионов Н+ в зависимости от Рсо2) и нормализацию буферной ёмкости плазмы (за счёт сдвигов НСО3 / Н2СО3).
3. Бесконтрольное применение осмодиуретиков и алкалинизации мочи может привести к тяжелому метаболическому ацидозу (повышенный сброс осмотически активных ионов Na+, Cl- подавляет секрецию H+).
4. Появление сдвигов кислотно-щелочного состояния, имеющего высокоэффективные механизмы компенсации, свидетельствует о тяжелых поражениях общего метаболизма и требует своевременной и целенаправленной коррекции.
Кислотообразование желудка и кислотно-щелочное равновесие
В литературе имеются отдельные данные о связи кислотообразования желудка от кислотно-щелочного состояния организма (B.Pacк, 2007; Зубков А.Н., Очаповский А.П., 1991; Horst A., 1959 и др.).
По мнению Зубкова А.Н. существует прямая зависимость между концентрацией углекислоты в крови и интенсивностью функционирования пищеварительных желез (слюнных, поджелудочной железы, печени), а также желез слизистой желудка, образующих соляную кислоту. Углекислота играет важную роль в постоянстве кислотно-щелочного равновесия. Horst A. пишет, что при чрезмерном выделении желудком соляной кислоты, например, при повышенной кислотности, наступает задержка углекислого газа в крови (и давление СО2 в крови возрастает). В такой ситуации резервная щелочность в крови увеличивается, а при пониженной кислотности уменьшается.
Однако этот вопрос требует дальнейшего и более детального научного изучения.
Вместе с тем из вышеизложенного очевидно, что для регуляции кислотообразующей функции желудка необходимо сохранять кислотно-щелочное равновесие организма в оптимальных параметрах.
Kokot F., Kuska J. постулируют, что в организме происходит постоянное смещение кислотно-щелочного равновесия организма то в кислую, то в щелочную сторону. Его регуляцию обеспечивают многие механизмы: прежде всего, на страже стоят лёгкие и почки, а также буферные системы крови и тканей. Лёгкие и почки играют активную роль при удалении из организма продуктов обмена веществ, буферные же системы крови играют пассивную роль, нейтрализуя кислые продукты обмена веществ.
Правильная функция систем тесно связана со всей деятельностью почек и лёгких. При недостаточной вентиляции лёгких происходит задержка в организме углекислого газа (СО2 обладает подкисляющими свойствами) и образуется т.н. газовый ацидоз (повышенная кислотность в крови и тканях тела). Он, в свою очередь, стимулирует дыхательный центр к усиленной вентиляции лёгких и мобилизует компенсационные механизмы и выведение подкисляющих (водородных) ионов через почки.
Если лёгкие функционируют нормально, то постоянно вырабатываемый углекислый газ не влияет отрицательно на организм.
При сахарном диабете, вследствие неправильного сгорания жиров и нарушенного обмена веществ, образуется большое количество производных жирных кислот, что впоследствии может вызвать значительное уменьшение резервной щёлочности в крови и ацидоз.
В здоровом организме, несмотря на образование в результате обмена веществ значительного количества кислот и щелочей и проникновение их в организм вместе с пищей, концентрация ионов водорода (рН) биологических жидкостей всегда постоянна.
Углекислый газ выводится лёгкими в виде СО2 при тесном взаимодействии почек. Каким же образом представляется нейтрализация серной, фосфорной, молочной и других кислот (к примеру, после потребления продуктов животного происхождения)? Только незначительная их часть может быть нейтрализована соком поджелудочной железы и кишечным соком. Исходя из этого, в случае заболевания поджелудочной железы, дело может дойти до изменения рН в сторону закисления (снижение рН). Большей частью эти кислоты нейтрализуются буферами плазмы крови. Однако если бы нейтрализованные таким образом кислоты удалялись из организма в виде соединений с буферами плазмы, то быстро бы наступило истощение буферных резервов. Поэтому почки, в свою очередь, активно вступают в процесс нейтрализации кислот или щелочей, поддерживая тем самым биологическое равновесие. Они обладают способностью задерживать большое количество щелочей, а в случае угрожающей здоровью чрезмерной щелочности почки могут удалить излишек щелочей, удерживая таким образом в организме кислые продукты. Здоровые почки – это один из гарантов биологического равновесия организма.
В регуляции кислотно-щелочного равновесия принимают участие также желудок, печень и кишечник.
Что касается печени в поддержании кислотно-щелочного равновесия в организме, то в случае повышенной кислотности она вырабатывает большое количество аммиака (сильная щёлочность), а в случае повышенной щёлочности – большое количество мочевины (кислота).
Определенную роль играет также и кишечник в силу образования щелочного пищеварительного сока; в особенности большое количество щелочей содержит поджелудочный сок.
Роль углекислоты в жизнедеятельности организма
Углекислый газ, углекислота и её соединения играют очень важную роль в жизнедеятельности организма. Углекислота участвует в распределении ионов натрия в тканях, регулируя тем самым, возбудимость нервных клеток. Она влияет на проницаемость клеточных мембран, активность многих ферментов, интенсивность продукции гормонов и степень их физиологической эффективности, процессы связывания белками ионов кальция и железа. Существует прямая зависимость между концентрацией углекислоты в крови и интенсивностью функционирования пищеварительных желез, а также желез слизистой желудка, образующих соляную кислоту. От содержания углекислоты в крови зависит поступление в ткани кислорода.
Углекислота играет важную роль в постоянстве кислотно-щелочного равновесия, в биосинтезе белка и карбоксилировании аминокислот.
Вышеизложенное свидетельствует, что её нельзя считать простым «шлаком», который необходимо как можно быстрее вывести из организма.
Присутствие углекислоты – это обязательное условие существования человека, оно сложилось, когда возникла жизнь на Земле. Согласно современным воззрениям, это произошло несколько миллиардов лет назад. Атмосфера нашей планеты была тогда перенасыщена углекислым газом (свыше 90%), и он стал естественным строительным материалом живых клеток.
Реакция биосинтеза растений приводит к поглощению углекислого газа, утилизации углерода и выбросу кислорода в атмосферу. Постепенно это привело к изменению состава воздуха, но внутренние условия работы клеток по-прежнему определялись высоким содержанием углекислоты. Первые животные, появившиеся на Земле и питавшиеся растениями, находились всё же в атмосфере с высоким содержанием углекислого газа. Поэтому их клетки, а позже и, созданные на базе древней генетической памяти, клетки современных животных и человека нуждаются в углекислой среде внутри себя (6-8% углекислоты и 1-2% кислорода) и в крови (7-7,5% углекислого газа). Растения утилизировали почти весь углекислый газ воздуха, и основная часть его в виде углеродных соединений вместе с гибелью растений попала в землю, превратившись в полезные ископаемые (уголь, нефть, торф). В настоящее время в атмосфере содержится около 0,03% углекислого газа и примерно 21% кислорода. Но для нормальной жизнедеятельности в крови должно быть 7-7,5% углекислого газа, а в альвеолярном воздухе – 6,5% (Зубков А.Н., Очаповский А.П., 1991).
Извне углекислый газ получить нельзя, так как в атмосфере его содержится мало. Животные и человек получают его при полном расщеплении пищи, так как белки, жиры, углеводы построены на углеродной основе, при сжигании с помощью кислорода в тканях образуется бесценный углекислый газ.
Дыхание и углекислота
"Огромную опасность для здоровья и самой жизни миллионов людей представляет ненормально низкое содержание у них в организме жизненно важного вещества – углекислого газа. При дефиците углекислого газа спастические явления (спазмы) имеют место во всем организме, порождая весьма пагубные их последствия: гипертоническую болезнь, ишемическую болезнь сердца, запоры, ожирение, сахарный диабет второго типа, бронхиальную астму, язву желудка, остеохондроз и т.д. Спазмолитики и сосудорасширяющие препараты лишь на время снимают спазм, не устраняя его первопричину.
Агаджанян Н.А.
Считается, что дыхание обычных людей – это в разной степени хроническая гипервентиляция лёгких. Всё искусство дыхания заключается в том, чтобы почти не выдыхать углекислый газ, терять его как можно меньше. Считается, что избыточное выведение углекислого газа из организма при гипервентиляции обусловливает возникновение около 150 заболеваний, именуемых нередко болезнями цивилизации. Среди них такие, как гипертоническая болезнь, ишемическая болезнь сердца, бронхиальная астма и др. (Зубков А.Н., Очаповский А.П., 1991). При хронической гипервентиляции лёгких из-за частого и глубокого дыхания человек теряет больше углекислого газа, чем допустимо. Если защитные механизмы плохо срабатывают, происходит перевозбуждение нервной системы, сдвиг кислотно-щелочного равновесия внутренней среды организма в щелочную сторону, что нарушает обмен веществ. Это выражается в снижении и нарушении иммунитета (склонность к аллергическим, простудным и воспалительным заболеваниям, отложение солей, ожирение или похудание, нарушения работы желез внутренней секреции и т.д., вплоть до развития опухолей).
Чаще всего при чрезмерной потере углекислого газа в разной степени включаются защитные механизмы, цель которых – остановить его удаление из организма. К таким механизмам относятся:
1) спазм сосудов бронхов и спазм гладкой мускулатуры всех органов;
2) сужение кровеносных сосудов;
3) увеличение секреции слизи в бронхах; носовых ходах, развитие аденоидов, полипов;
4) уплотнение мембран вследствие отложения холестерина, что способствует развитию склероза тканей;
5) повышение функции щитовидной железы.
Все эти моменты вместе с затруднением поступления кислорода в клетки при понижении содержания углекислого газа в крови (эффект Вериго-Бора) ведут к кислородному голоданию, замедлению венозного кровотока (с последующим расширением вен).
Кислородное голодание жизненно важных органов вызывает подъём артериального давления (гипертонию) и возбуждение дыхательного центра, что ведёт к ещё большей гипервентиляции, вымыванию углекислого газа из организма. Спазмы коронарных сосудов приводят к гипоксии миокарда. Спазмы мозговых артерий вызывают головную боль, головокружение, бессонницу и другие расстройства функций головного мозга.
При гипервентиляции сосудистый тонус, мозговой кровоток претерпевают существенные изменения. В большей степени связь между реакцией сосудов мозга и изменение дыхания осуществляется углекислым газом, исключительно важную роль которого в регуляции мозгового кровообращения подчеркивает М.Е.Маршак (1969).
На рис. 98-99. отражены сдвиги кровообращения в различных органах при гипо- и гиперкапнии. Обращает на себя внимание противоположный характер сдвигов кровоснабжения мозга и скелетных мышц: при падении
Ра СО2 происходит крутой подъём кровообращения скелетных мышц, в то же время кровообращение мозга и других органов резко падает.
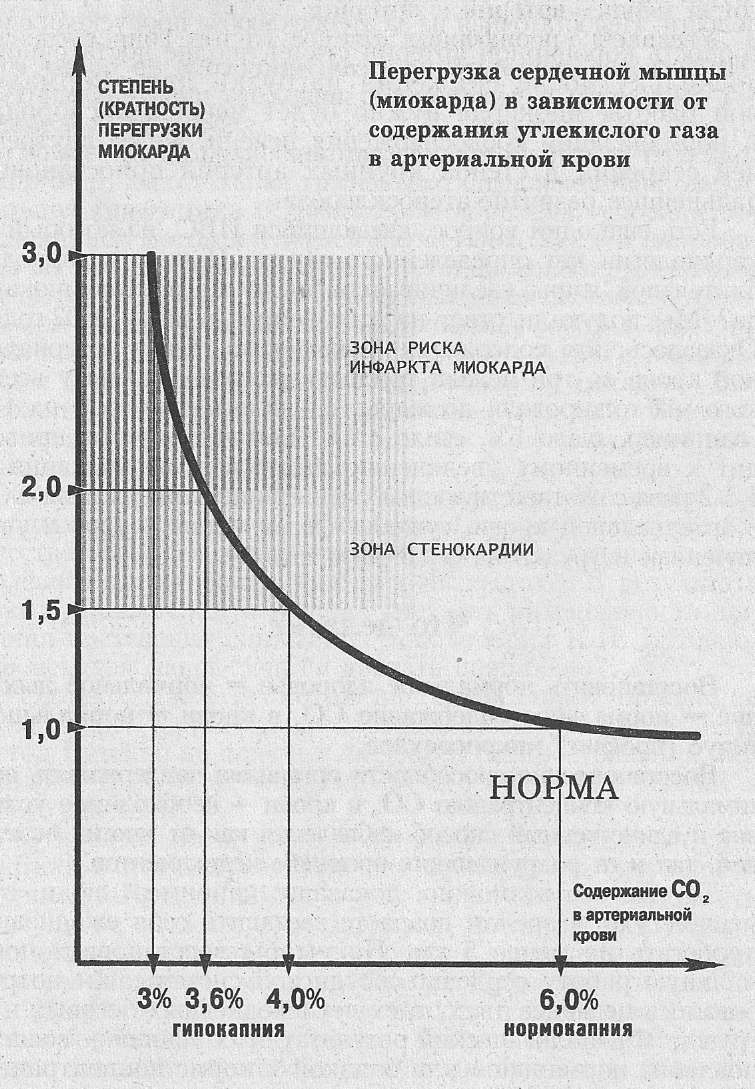
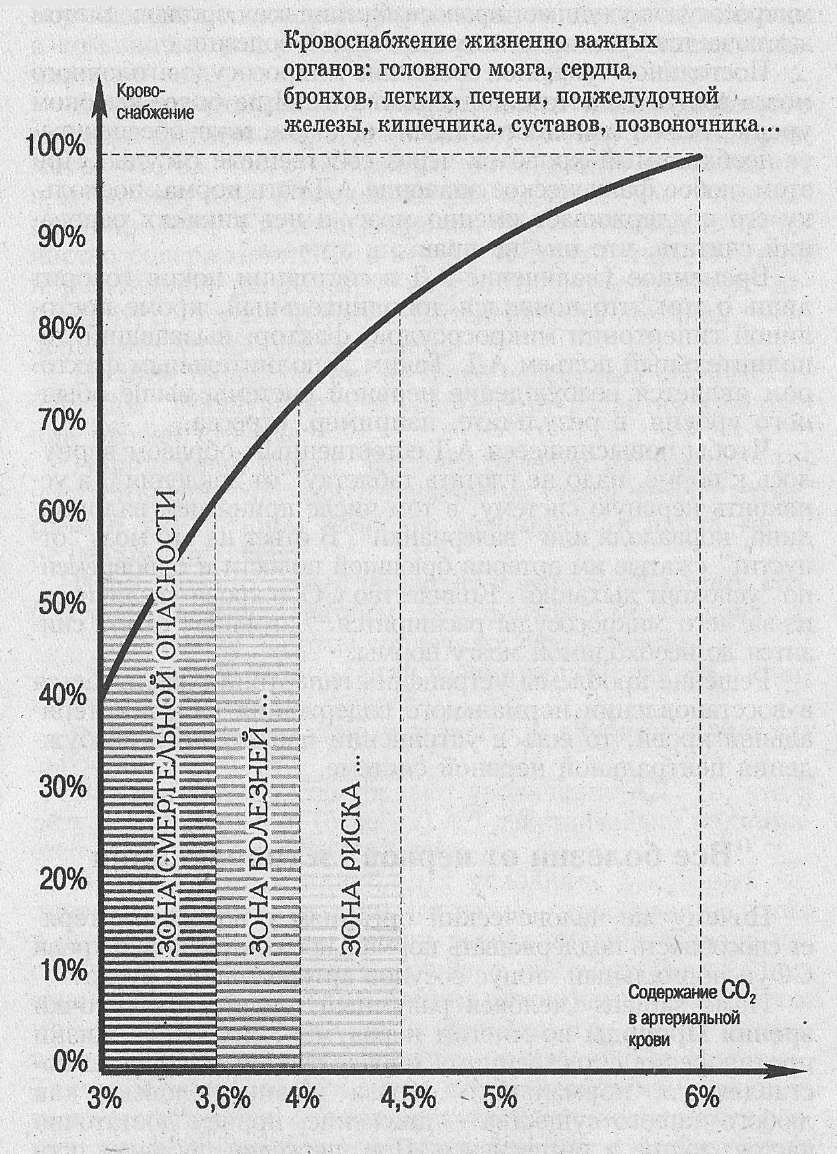
Рис. № 98. Кровоснабжение органов. Рис. № 99. Перегрузка миокарда в
зависимости от содержания СО2.
Количественное измерение объёма церебрального кровотока, изменение уровня метаболизма мозга и изменение в артериальной и венозной системах было проведено разными авторами и было доказано, что гипокапния, связанная с гипервентиляцией, у здоровых молодых испытуемых редуцирует мозговой кровоток на 33-40%. У части испытуемых появились различные отчетливые клинические расстройства церебральной функции, тетанические феномены. Ингаляция смесью, содержащей 5-7% СО2, приводила к увеличению мозгового кровотока на 75%. Ингаляция кислородом (85-100%) вызывала снижение мозгового кровотока на 13%, в то время как более низкие концентрации кислорода (10%), наоборот, увеличивали церебральный кровоток. Специальный анализ позволил авторам выявить связь уровня мозгового кровообращения не только с составом вдыхаемых смесей, но также и с изменением сопротивления мозговых сосудов.
А.М.Вейн, И.В.Молдовану постулируют, что многочисленные эксперименты на животных и здоровых испытуемых выявили тесную связь гипервентиляции с сосудистыми пертурбациями мозга, где такой фактор, как гипокапния, играет, по мнению многих исследователей, главенствующую роль как в механизмах, определяющих состояние электрической активности мозга, так и в механизмах симптомообразования при гипервентиляционном синдроме.
Следует отметить, что полученные в различных экспериментах факты всё больше укрепляли мнение исследователей в достоверности и реальности гипокапнической теории. Но наряду с этим стало очевидно, что наиболее высокой разрешающей способностью обладает всё больше и больше развивающаяся гипоксическая концепция патогенеза церебральных расстройств, связанных с гипервентиляцией.
Впервые гипоксическая теория была предложена Davis и Wallace для объяснения генеза медленноволновой активности на ЭЭГ. Исследователи обнаружили, что в результате стандартной трёхминутной гипервентиляции развивается дыхательный алкалоз. При моделировании различных состояний метаболического алкалоза и ацидоза путём энтерального введения бикарбоната натрия и хлористого аммония не удавалось вызвать существенные изменения на ЭЭГ. Было обнаружено, что если гипервентиляция проводится кислородом, медленные волны на ЭЭГ менее выражены, чем при обычной гипервентиляции. Davis и Wallace сделали вывод, что изменения на ЭЭГ тесно связаны с сосудистыми церебральными нарушениями (вазоспазм), в результате которых ухудшается снабжение коры головного мозга кислородом и глюкозой (декстразой). Дальнейшие исследования в этом направлении связаны с проведением экспериментов на животных (Meyer, Gothah, 1960). При одновременной регистрации ЭЭГ, Ра О2, Ра СО2, рН кровотока прямо с поверхности мозговой коры, а также с глубин мозга кошек и обезьян исследователи пришли к выводу, что гипокапния, которая следет за гипервентиляцией, вызывает констрикцию артериол мозга, снижающую мозговой кровоток, в результате чего возникает церебральная аноксия. Было установлено, что от момента церебральной гипоксии до возникновения медленноволновой активности на ЭЭГ существует латентный период 6-10 секунд. В последующем проведение исследований на здоровых испытуемых с одновременной регистрацией газов и электролитов в артериях и венах при гипервентиляции подтвердили данные, полученные в экспериментальных условиях на животных. Напряжение кислорода в яремной вене находилось в тесной связи с появлением медленных волн на ЭЭГ при гипервентиляции. Был найден критический порог напряжения Ра О2 в венозной крови в яремной вене (21 мм. рт. ст.), ниже которого, как правило, появлялись медленные волны ЭЭГ, что указывает на гипоксию мозговой ткани.
С гипоксическими механизмами при гипервентиляции тесно связан и эффект Бора, который заключается в том, что кривая диссоциации оксигемоглобина смещается влево при изменении рН крови в сторону алкалоза и наличии гипокапнии. Другими словами, при изменении вышеуказанных свойств крови нарастает тропность кислорода к гемоглобину, и ткани мозга получают меньше кислорода. Обсуждая церебральные последствия гипервентиляции, Morgan, 1983 (цит. по А.М.Вейну, И.В.Молдовану) писал, что при гипервентиляции мозг получает меньше крови, кровь содержит меньше кислорода, и имеющийся кислород он получает медленнее из-за эффекта Бора.
Gotoh с соавт. 1965 (цит. по А.М.Вейну, И.В.Молдовану), изучая роль эффекта Бора в церебральных сосудистых механизмах, выявили тесную связь наступающего в результате гипервентиляции алкалоза, аноксемии и церебрального ангиоспазма. Авторы пришли к выводу, что гипоксия мозга связана как со снижением кровотока, так и с наличием эффекта Бора. Было установлено, что снижение парциального напряжения кислорода в яремной вене на 73% связано со снижением кровотока мозга, а на 27% – с эффектом Бора.
Таким образом, гипервентиляция приводит к гипокапнии и гипоксии, а они в свою очередь наряду со спазмами сосудов приводят к постепенному склерозу сосудов, повышению их хрупкости, потере эластичности., нарушению гемодинамики, обмена веществ и в конечном итоге развиваются различные заболевания и преждевременное старение.
При нормализации дыхания содержание углекислого газа в организме достигает должного уровня, и постепенно ликвидируются перечисленные выше патофизиологические состояния.
Если еще больше уменьшить дыхание, как это советуют йоги, то у человека развивается сверхвыносливость, высокий потенциал здоровья, возникают все предпосылки к долголетию.
Факторы, способствующие уменьшению дыхания и увеличению содержания углекислого газа в организме:
Хатха йога и занятия Пранаямой (специальные режимы дыхания);
дозированное голодание (24-36 часов в неделю);
вегетарианство (в частности сыроедение);
закаливание организма;









