
Полная версия
Пособие по неорганической химии
Атомы элементов главных подгрупп содержат на внешних уровнях число электронов, равное номеру группы. Побочные же подгруппы включают элементы, атомы которых имеют на внешнем уровне по два или по одному электрону.
У элементов побочных подгрупп валентными электронами являются не только электроны внешнего уровня, но и предпоследнего. В этом их отличие.
7. У атомов элементов главных подгрупп с возрастанием относительных атомных масс сверху вниз увеличивается расстояние между валентными электронами и ядром, поэтому способность к отдаче электронов все увеличивается, и металлические свойства усиливаются.
8. У актиноидов и лантаноидов заполняются соответственно 4f- и 5f-подуровни. Лантаноиды и актиноиды помещены в одну клетку таблицы, потому что с ростом заряда атомных ядер идет заполнение электронами предпредвнешнего уровня.
Химическая связь
Природа и типы химической связи
Химическая связь возникает при взаимодействии частиц и определяется как взаимодействие, которое связывает отдельные атомы в более сложные системы, такие как молекулы, радикалы, кристаллы и др.
Природа сил химической связи электростатическая. При образовании химической связи общая энергия системы, составленной из многоатомной структуры, меньше энергии составных частей. Поэтому условием образования химической связи является понижение системы энергии. В образовании химической связи между атомами участвуют валентные электроны. В зависимости от способа образования устойчивых структур различают основные типы химической связи: ковалентную, ионную, металлическую и водородную.
Ионная связь
Ионная связь – это электростатическое притяжение между ионами, образованными путем практически полного смещения электронной пары к одному из них. Эта связь образуется, если разность электроотрицательностей атомов велика (больше 1,7 по шкале Полинга).
Электроотрицательность характеризует способность атомов притягивать к себе валентные электроны. Значения электроотрицательностей атомов элементов также подчиняются периодическому закону.
Шкала Полинга – это шкала относительных атомных электроотрицательностей, т.е. значения электро-отрицательностей элементов приведены по отношению к электроотрицательности фтора, которая принята равной 4,0.
Большинство бинарных соединений, содержащих атомы металлов, являются ионными или гетерополярными. Типичный пример ионной связи – образование хлорида натрия NaCl:
Na – e– = Na+
Cl + e– = Cl-
Как видно из электронных формул атомов натрия (11Na 1s22s22p63s1) и хлора (17Cl 1s22s22p63s23p5) – это атомы с незавершенными внешними электронными уровнями. Для завершения внешнего уровня атому натрия легче отдать 1 электрон, чем присоединить 7. Атому хлора легче присоединить 1 электрон, чем отдать 7. В результате образуются два иона Na+ и Cl-, между которыми возникают силы электростатического притяжения, после чего образуется соединение NaCl.
Ионные соединения при обычных условиях – твердые вещества. Они имеют высокую температуру кипения и плавления. В расплавленном состоянии обладают электропроводностью, в воде диссоциируют на ионы.
Ковалентная связь
Химическая связь, осуществляемая электронными парами, называется атомной или ковалентной.
Ковалентная связь возникает преимущественно между атомами различных неметаллов и одинаковыми атомами.
Ковалентно построенные соединения могут быть как простые (H2, O2, Ne, галогены – F2, Cl2, Br2,), так и сложные (HCL, CO2, CH4).
Электроны, которые в виде общей пары связывают атомы друг с другом в молекуле, называются спаренными электронами.
Пример:
Cl2 → Cl ⁚ Cl
Различают следующие разновидности ковалентной связи: неполярную, полярную и донорно-акцепторную.
В случае неполярной ковалентной связи электронная пара одинаково принадлежит обоим соединяющимся атомам (простые вещества H2, O2, N2, F2, Cl2) – электроотрицательность у атомов этих молекул одинакова
H2 → H ⁚ H;
N2 → ⁚N ⁚⁚⁚ N⁚
Составляя электронные формулы веществ, следует помнить, что каждая общая электронная пара – это условное изображение повышенной электронной плотности, возникающей в результате перекрывания соответствующих электронных облаков атомов.
Эти вещества имеют низкую температуру плавления и кипения, при обычных условиях эти вещества газообразные и легколетучие (С12 – газ, температура кипения – 34°C, плавления – 101 °C).
В случае полярной ковалентной связи электронная пара смещена к более электроотрицательному атому.
Пример типичной полярной связи – молекула хлористого водорода:
Н· + ·С1→ Н⁚С1
Молекулы с несимметрическим распределением электронов называются полярными. Это наиболее распространенный тип химической связи, который встречается как в неорганических, так и в органических соединениях (HCl, HBr, NH3, H2S, CH4 и др.).
Донорно-акцепторная связь – это вид ковалентной связи, которая осуществляется за счет пары электронов, принадлежащих одному из соединяющихся атомов. Атом, который отдает свою пару электронов для образования связи, называется донором; атом, который использует эту пару электронов, называется акцептором.
NH3 + H+ = NH4+
В данном соединении азот, имеющий свободную электронную пару, является донором, а ион водорода – акцептором, при этом заряд иона водорода становится общим (он рассредоточен между всеми атомами), а неподеленная пара электронов, принадлежащая азоту, становится общей с водородом.
Следует заметить, что это не особый вид связи, а лишь иной механизм образования ковалентной связи.
Металлическая связь
Связь, которая образуется в результате взаимодействия относительно свободных электронов с ионами металлов, называется металлической связью.
Атомы металлов в наружном электронном слое имеют мало валентных электронов по сравнению с общим числом внешних энергетически близких орбиталей, а валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме. Электроны в металлах свободно перемещаются из одной орбитали в другую, осуществляя связь между всеми атомами металла, и принадлежат всем его атомам.
Химическая связь в металлических кристаллах сильно делокализована, т.е. электроны, осуществляющие связь, обобществлены («электронный газ») и перемещаются по всему куску металла, в целом электронейтрального.
Металлическая связь обусловливает высокую температуру плавления и кипения, тепло- и электропроводность, пластичность, способность отражению света и др.
Водородная связь
Водородная связь – это разновидность межмолекулярного и внутримолекулярного взаимодействия. Она осуществляется между поляризованными атомами водорода и отрицательно поляризованным атомом другой молекулы. Примерами существования межмолекулярной водородной связи являются ассоциированные молекулы воды, фтористого водорода, спиртов, карбоновых кислот.
Внутримолекулярная связь возникает в молекулах органических веществ – белков, углеводов и др.
Межмолекулярная водородная связь приводит к ассоциации молекул одного или разных соединений. В молекуле воды связь Н…О имеет полярный характер, причем на атоме водорода имеется избыточный положительный заряд, а на атоме кислорода – отрицательный. Это способствует взаимодействию атома водорода одной молекулы воды и атома кислорода другой молекулы, что и приводит к возникновению водородной связи между молекулами.
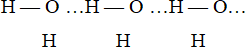
Водородная связь оказывает влияние на свойства многих веществ. Так, благодаря водородной связи, фтороводород в обычных условиях существует в жидком состоянии. Наличием водородных связей объясняется более высокая температура кипения воды по сравнению с водородными соединениями элементов подгруппы кислорода (H2S, H2Se, H2Te).
Энергия водородной связи во много раз меньше энергии обычных ковалентных связей. Водородная связь легко разрушается при нагревании и кипении вещества.
Химические реакции
Классификация химических реакций
Сущность химических реакций состоит в превращении одних веществ в другие.
I. По признаку соотношения числа исходных веществ и продуктов химические реакции можно разделить на реакции разложения, соединения, замещения и обмена.
1. Реакциями разложения называются такие реакции, в которых из одного вещества получаются два или более веществ – например, разложение нитрата калия:
2 KNO3 = 2KNO2 + O2
или карбоната кальция:
СаСО3 = СаО + СО2
2. Реакциями соединения называются такие реакции, в результате которых из двух или более веществ образуется новое вещество:
СаО + СО2 = СаСО3
2Cu + O2 = 2CuO
2 Fe + 3Cl2 = 2FeCl3
Fe + S = FeS
3. Реакциями замещения называются реакции, протекающие между простыми и сложными веществами, при которых атомы простого вещества замещают атомы одного из элементов в сложном веществе:
Fe0 + CuCl2 = Cu0 + Fe+Cl2;
2KJ + C12 = 2KC1 + J2.
4. Реакции обмена – это реакции, в результате которых два сложных вещества обмениваются своими составными частями, образуя два новых вещества. При этом степень окисления элементов сохраняется:
Al2(SO4)3 + 3BaCl2 = 2AlCl3 + 3BaSO4 ↓;
FeSO4 + BaC12 = BaSO4↓ + FeC12;
AlC13 + 3AgNO3 = 3AgC1↓ + Al(NO3)3
II. По признаку изменения степени окисления атомов, входящих в состав реагирующих веществ, реакции делятся на протекающие без изменения степени окисления атомов и с изменением степеней окисления – окислительно-восстановительные.
Реакции, протекающие без изменения степени окисления.
Пример:
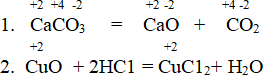
В первой химической реакции степень окисления кальция, углерода и кислорода остались неизменными. Во второй – степень окисления меди не меняется.
Реакции окислительно-восстановительные – это реакции, при которых происходит обмен электронами между реагирующими компонентами (атомами, ионами, молекулами), в результате чего происходит изменение степеней окисления атомов. Процессы окисления и восстановления взаимосвязаны – не бывает окисления без восстановления.
Пример:
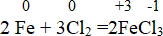
Здесь железо – восстановитель, который окисляется, а хлор – окислитель, который восстанавливается.
III. По признаку поглощения или выделения тепловой энергии в ходе химических превращений реакции делятся на экзотермические и эндотермические. Такие реакции характеризуются тепловым эффектом.
Тепловым эффектом называется количество теплоты, которое выделяется или поглощается в химической реакции. Тепловой эффект химических реакций обозначается буквой латинского алфавита Q и изменяется в кДж.
1. Экзотермические реакции – это реакции, протекающие с выделением теплоты или с положительным тепловым эффектом. К экзотермическим реакциям относятся большинство реакций соединения, горения, обмена и некоторые реакции разложения.
Пример:
С + О2 = СО2 + 402кДж;
СН4 + 2О2 = СО2 + 2Н2О + 892 кДж.
2. Эндотермичекские реакции – это реакции, протекающие с поглощением1 теплоты из окружающей среды. Иначе эти реакции можно назвать реакциями с отрицательным тепловым эффектом.
Пример:
N2 + O2 = 2NO – 180,8 кДж.
Образование оксида азота (II) из азота и кислорода протекает с поглощением тепла и поэтому осуществимо только при высокой температуре.
IV. По признаку изменения направления протекания реакции делятся на обратимые и необратимые.
Обратимые химические реакции одновременно протекают в двух взаимно противоположных направлениях, при этом знак равенства в уравнениях заменяется двумя стрелками, направленными в противоположные стороны.
Пример:
1. Образование аммиака из водорода и кислорода
N2 + 3H2 ⇄ 2NH3 + 92,4 кДж
2. Образование серной кислоты
SO2 + H2O ⇄ H2SO4
Необратимые реакции протекают до полного превращения реагирующих веществ в продукты реакции.
Пример:
BaCl2 + H2SO4 = 2HCl + BaSO4 ↓
AgNO3 +HCl = HNO3 + AgCl ↓
V. По наличию фаз в реакционной зоне реакции подразделяются на гомогенные и гетерогенные.
Фазой называется однородная по составу и свойствам часть системы, отделенная от других фаз границей раздела.
Гомогенные (гомо – одинаковый) – это реакции, где вещества находятся в одинаковом агрегатном состоянии (жидком или газообразном).
Пример:
CH4(газ) + Cl2(газ)
Конец ознакомительного фрагмента.
Текст предоставлен ООО «Литрес».
Прочитайте эту книгу целиком, купив полную легальную версию на Литрес.
Безопасно оплатить книгу можно банковской картой Visa, MasterCard, Maestro, со счета мобильного телефона, с платежного терминала, в салоне МТС или Связной, через PayPal, WebMoney, Яндекс.Деньги, QIWI Кошелек, бонусными картами или другим удобным Вам способом.
1
Подробнее см. в параграфе «Строение электронных оболочек атомов».

