
Полная версия
Chemie für den Badebetrieb
63 EuEuropium 2151,96 7
64 Gd 1Gadolinium 2157,25 7
65 TbTerbium 2158,9254 9
66 DyDysprosium 2162,50 10
67 HoHolmium 2164,9304
68 ErErbium 2167,26
69 TmThulium 2168,9342 13
70 YbYtterbium 2173,04 14
71 Lu 1Lutatium 2174,967 14
**) Actinoide
6 d7 s5 f
90 ThTho- 2
rium 2232,0381
91 PaProtacti- 1
nium 2231,03 2
92 UUran 1
2238,02 3
93 Np
Neptu- 1
nium 2
237,0482
94 PU
Plutonium 1
2
(244) 5
95 Am
Ameri- 1
cium 2
(243) 6
96 Cm
Curium 1
2
(247) 7
97Bk
Berke- 1
lium 2
(247) 8
98 Cf
Califor- 1
nium 2
(251) 9
99 Es
Einstein 1
ium 2
(252) 9
100 Fm
Fer 1
mium 2
(257) 11
101 Md
Mende- 1
levium 2
(258) 12
102 No
Nobelium 1
2
(259) 13
103 Lr
Lawren- 1
cium 2
(269) 14
Die in den einzelnen Gruppen unter dem Buchstaben a senkrecht stehenden Elemente sind die Hauptgruppenelemente
Die in den einzelnen Gruppen unter dem Buchstaben b senkrecht stehenden Elemente sind die Nebengruppenelemente
Die in Klammern angegebenen Massenzahlen gehören zu dem jeweiligen Isotop mit der größten Halbwertszeit


15
Aufbau des PSE
Im Periodensystem unterscheiden wir Pe-rioden (= waagrechte Reihen) und Grup-pen (= senkrechte Spalten). Es gibt im PSE 7 Perioden und 16 Gruppen (8 Hauptgrup-pen und 8 Nebengruppen).
Den Hauptgruppen werden Namen zu-geordnet:
1. Hauptgruppe: Alkalimetalle
2. Hauptgruppe: Erdalkalimetalle
3. Hauptgruppe: Erdmetalle oder Bor-gruppe
4. Hauptgruppe: Kohlenstoffgruppe
5. Hauptgruppe: Stickstoffgruppe
6. Hauptgruppe: Chalkogene oder Erz-bildner
7. Hauptgruppe: Halogene oder Salzbild-ner
8. Hauptgruppe: Edelgase
Die Haupt- und Nebengruppen werden oft mit römischen Ziffern bezeichnet (I bis VIII).
Die Elemente der gleichen Haupt-gruppe haben gleiche oder ähnliche Eigenschaften.
Die Nummer der Hauptgruppe gibt die Anzahl der Elektronen auf der äußers-ten Schale an.
Die Nummer der Periode gibt die An-zahl der Elektronenschalen an.
Beispiele:
a) Fluor (2. Periode, 7. Hauptgruppe) hat 2 Elektronenschalen; auf der 2. Schale (äußerste Schale) sind 7 Elektronen.
b) Kalium (4. Periode, 1. Hauptgruppe) hat 4 Elektronenschalen; auf der 4. Schale (äußerste Schale) ist 1 Elektron.
Ausnahme: Helium (1. Periode, 8. Haupt-gruppe) hat auf seiner einzigen und deshalb äußersten Elektronenschale keine 8, son-dern nur 2 Elektronen.
Die Gründe, warum das Helium trotzdem zur 8.Hauptgruppe zählt, sind:
Die 1. Schale ist bereits mit 2 Elektronen abgesättigt. Die Atome der Elemente der 8. Hauptgruppe haben alle eine abgesät-tigte Außenschale, d.h. die äußerste Scha-le ist mit 8 Elektronen voll besetzt. Helium zeigt „Edelgaseigenschaften“ z.B. äußerste Reaktionsträgheit.
Nebengruppen
Es gibt 8 Nebengruppen.
Die 8. Nebengruppe enthält in jeder Periode 3 Elemente, alle andern Nebengruppen ent-halten in jeder Periode 1 Element.
Alle Nebengruppenelemente sind Metalle. Die Zahl der Außenelektronen ist bei den Nebengruppenelementen gering (meist 2 Elektronen) und nicht (wie bei den Haupt-gruppen) an der Nebengruppennummer zu erkennen.
Besonderheit bei der Elektronenschalen-besetzung: Die äußerste Schale wird erst mit wenigen Elektronen (meist 2) angefüllt, bevor die darunter liegende, innere Schale aufgefüllt wird. Man spricht auch von der inneren Schalenbesetzung. Bei den Ato-men der Hauptgruppenelemente werden dagegen ausschließlich die äußersten Scha-len aufgefüllt.
Beispiel:
Zink (Zn) Die 4. Schale (Außenschale) wird mit 2 Elektronen angefüllt, bevor die darunter liegende, innere Schale um 10 Elektronen auf 18 Elektronen (max. Elek-tronenzahl der 3. Schale) aufgefüllt wird.

Periodensystem

16

Gesetzmäßigkeiten im PSE
Das kleine Periodensystem der Elemente. Es sind nur die Hauptgruppen aufge-führt. Die Elemente links unten der Diagonale sind Metalle, die Elemente rechts oben der Diagonale sind Nichtmetalle. Die Elemente ganz rechts (8. HG) sind Edelgase. Die Elemente in den grauen Feldern sind Halbmetalle. Es sind nur die Hauptgruppen aufgeführt
Atomradien
Innerhalb einer Hauptgruppe nimmt der Atomradius von oben nach unten zu!
Begründung:
Die Anzahl der Schalen nimmt von oben nach unten zu. Die Abstände der Außen-elektronen vom Atomkern werden größer, so dass die Kernanziehungskraft auf die Außenelektronen (von oben nach unten) sinkt. Die Atome der unten stehenden Ele-mente geben sehr bereitwillig ihre Außen-elektronen ab. ⇒ Die Reaktionsfreudigkeit der Elemente steigt von oben nach unten.
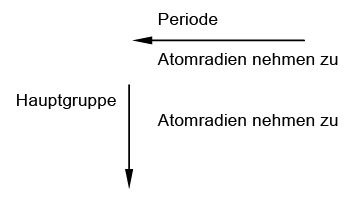
Verlauf der Atomradien im PSE bei den Hauptgruppenelementen

Periodensystem


17
Innerhalb einer Periode nimmt der Atomradius von rechts nach links zu.
Begründung:
Die Schalenanzahl ist zwar gleich, die Pro-
tonenzahl nimmt aber von rechts nach links ab. Daher wird die Anziehungskraft der Atomkerne auf die Elektronenhülle immer schwächer.
Metall-/Nichtmetallcharakter
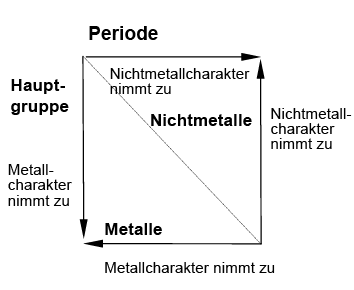
Metalle und Nichtmetalle im PSE der Hauptgruppenelemente
Wenn man durch das PSE eine Diagonale von links oben nach rechts unten zieht, so stellt man fest, dass die Elemente links un-ten von dieser Diagonale Metalleigenschaf-ten haben und zwar umso mehr
- je weiter unten sie stehen,
- je weiter links sie stehen.
Die Elemente, die im PSE eher rechts oben stehen, haben diese Metalleigenschaften nicht. Man nennt sie daher auch Nicht-metalle. Die Elemente auf oder in unmit-telbarer Nähe der Diagonale haben einige metallische und einige nichtmetallische Eigenschaften. Man nennt sie daher auch Halbmetalle (B, Si, Ge, As, Se, Sb, Te, At).
Begründung:
Der Metallcharakter eines Elementes ist
davon abhängig, wie bereitwillig ein Atom seine Außenelektronen abgeben möchte. Ein Atom tendiert umso stärker dazu, Au-ßenelektronen abzugeben
- je weniger Außenelektronen vorhanden sind,
- je größer der Atomradius und damit der Abstand vom Atomkern ist,
- je kleiner die Protonenzahl ist.
In den Perioden nimmt die Anzahl der Au-ßenelektronen von rechts nach links ab, die Protonenzahl nimmt ab und die Atomradi-en werden in dieser Richtung größer. In den Hauptgruppen werden die Atomradien von oben nach unten größer (Die gleichzeitige Zunahme der Protonenzahl ist demgegen-über von untergeordneter Bedeutung).
Der Nichtmetallcharakter eines Elements ist davon abhängig, wie stark ein Atom seine Außenschale durch Aufnahme von Frem-delektronen auffüllen möchte. Ein Atom tendiert umso eher dazu
- je mehr Außenelektronen vorhanden sind,
- je kleiner der Atomradius ist,
- je größer die Protonenzahl ist.
In den Perioden wird die Anzahl der Au-ßenelektronen und die Protonenzahl von links nach rechts größer und die Atomra-dien kleiner. In den Hauptgruppen werden die Atomradien von unten nach oben klei-ner; die gleichzeitige Abnahme der Proto-nenzahl ist demgegenüber von untergeord-neter Bedeutung.

Periodensystem


18

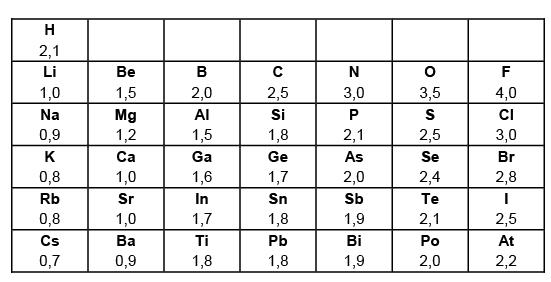
Elektronegativität (EN)
Elektronegativitäten von Hauptgruppenelementen
Die Größe der EN eines Atoms hängt da-von ab, wie stark die Außenelektronen vom positiven Kern angezogen werden. Inner-halb einer Periode nimmt die EN von links nach rechts zu (Begründung: Die Kernla-dungszahl steigt); innerhalb einer Haupt-gruppe nimmt die EN von oben nach unten ab (Begründung: Atomradius steigt) Die Größe der Elektronegativität (abgekürzt EN) bzw. Elektronegativitätsdifferenz (ab-gekürzt ∆ EN) zwischen 2 Atomen spielt eine große Rolle:
a) bei chemischen Bindungen (Hier gibt ∆ EN die Bindungsart an, siehe Kapitel 3),
b) beim Aufstellen chemischer Reaktions-gleichungen.
Wiederholungsfragen
1. Welche Gemeinsamkeit haben die Ato-me der Elemente der gleichen Haupt-gruppe?
2. Welche Gemeinsamkeit haben die Ato-me der Elemente der gleichen Periode?
3. Wie viele Protonen haben die Atome des Elements mit der Ordnungszahl 48?
4. Warum wird das Helium zur 8. Haupt-gruppe gezählt, obwohl es nur 2 Elekt-ronen hat?
5. Wie verändern sich Atomradien
a) innerhalb einer Hauptgruppe
b) innerhalb einer Periode?
6. Warum ist die Reaktionsfreudigkeit des Elements Lithium kleiner als die des Elements Kalium?
7. Wie nennt man die Elemente der
a) 1. Hauptgruppe
b) 7. Hauptgruppe
c) 8. Hauptgruppe?
8. Welche grundsätzlichen Eigenschaften haben die Elemente der 1. Hauptgrup-pe im Vergleich zu den Elementen der 8. Hauptgruppe (Begründung)?
9. Wo befinden sich im PSE vorwiegend
a) Metalle
b) Nichtmetalle?
10. Wie verändert sich die Elektronegativi-tät innerhalb des Periodensystems der Elemente (Begründung)?
Periodensystem
Darunter versteht man das Bestreben eines Atoms, Elektronen anzuziehen.
Linus Pauling, ein ame-rikanischer Chemiker (1954 Nobelpreis für Chemie, 1962 Träger des Friedensnobelprei-ses) gab dem Element mit der höchsten Elekt-ronegativität, dem Fluor willkürlich den Wert 4.
Die folgende Tabel-
le zeigt die Elektronegativitäten einiger Hauptgruppenelemente:


19
Chemische Bindungen
Alle Atome haben das Bestreben, eine voll besetzte, abgesättigte Außenschale (Edel-
gaszustand) zu erreichen. Dazu gehen sie chemische Bindungen mit gleichen oder verschiedenen Atomen ein. Je nachdem, welche Atome vorliegen, sind die Bindungs-arten unterschiedlich. Wir unterscheiden die Bindungsarten:
Atombindung (Elektronenpaarbin-dung, kovalente Bindung)
Ionenbindung
Metallbindung
Die Atombindung (Elektronenpaarbindung, kovalente Bindung)
Sie tritt zwischen Nichtmetallatomen auf. Wenn 2 gleiche Nichtmetall-Atome eine Verbindung eingehen, spricht man von einer kovalenten oder unpolaren Atom-
bindung. Wenn sich 2 verschiedene Nicht-metallatome miteinander verbinden, nennt man die Bindungsart polare (polarisierte) Atombindung
Atombindung zwischen gleichen Atomen
Einfachstes Beispiel dieser Atombindung ist die Bindung zwischen Wasserstoffatomen. Jedes H-Atom hat ein Elektron auf seiner äußersten Schale (K-Schale). Die K-Schale benötigt für die Edelgaskonfiguration jedoch zwei Elektronen. Bei der Atombin-dung lagern sich zwei Wasserstoff-Atome zusammen und bilden ein gemeinsames Elektronenpaar. Dieses gehört der K-Schale beider Atome an. Dadurch haben beide Atome eine voll besetzte Außenschale (Edelgasschale des Heliums) und bilden so ein H2-Molekül.
Ähnlich ist es bei der Bindung zwischen zwei Atomen der 7. Hauptgruppe z. B. zwei Fluor-Atomen. Diese haben je sieben Elektronen auf ihrer äußersten Schale, der L-Schale.

Von den beiden Fluor-Atomen behält jedes sechs Außenelektronen für sich alleine; mit dem 7. bilden sie ein gemeinsames Elekt-ronenpaar, so dass beide auf diese Weise eine voll besetzte, abgesättigte Außenschale erreichen.
Wegen der Bildung von gemeinsamen Elek-tronenpaaren nennt man diese Bindung auch Elektronenpaarbindung.
Durch die Elektronenpaarbindung entstehen Moleküle. Unedle Gase wie Wasserstoff, Stickstoff, Sauerstoff, Fluor und Chlor kommen immer molekular vor als H2, N2, O2, F2, Cl2. Der Index „2“ besagt hier, dass jeweils zwei Atome durch Atombindung verbunden sind.

Chemische Bindungen

20

Schreibweisen für die Atombindung
Für Atombindungen gibt es die folgenden Schreibweisen:
a) Elektronenformel (Punktformel)
Dabei wird jedes Außenschalen-Elektron als ein Punkt dargestellt, die gemeinsamen Elektronenpaare werden zwischen die Buchstabensymbole geschrieben.
b) Elektronenpaarformel (Strichformel)
Für 2 Punkte (Außenelektronen) zeichnet man einen Strich.
c) Strukturformel
Es werden nur die gemeinsamen Elektro-nenpaare als Strich dargestellt. Die Elek-tronenpaare, die nur zu einem der Atome gehören, werden nicht dargestellt.
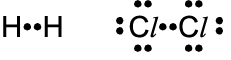
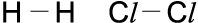
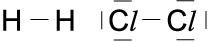
Doppelbindung
d) Summenformel
Es wird nur noch angegeben, welche Atome in dem Molekül vorliegen und in welcher Anzahl. Bei dieser Darstellungsart ist nicht mehr erkennbar, wie die Atome chemisch gebunden sind. Die Anzahl der im Molekül gebundenen Atome gibt man durch eine tief gestellte Zahl (Index) rechts unten neben dem Elementsymbol an. Wenn von einer Atomart nur ein Atom im Molekül vor-kommt, steht hinter dem Symbol keine Zahl.
Beispiel: Nicht H2O1
sondern H2O
Anmerkung: Bei den bisher beschriebenen Atombindungen handelt es sich ausschließ-lich um Einfachbindungen. Dies bedeutet, dass nur ein gemeinsames Elektronenpaar vorliegt.
Sauerstoff hat sechs Außenelektronen. Um den Edelgaszustand zu erreichen, müssen zwei Sauerstoffatome zwei gemeinsame Elektronenpaare bilden. Man nennt diese Bindung Zweifach- oder Doppelbindung. Auch Doppelbindungen kann man in jeder der in Kapitel 3.1.1.1 aufgeführten vier Schreibweisen darstellen.
a) b)
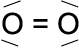
c) d) O2
In der Schreibweise a), b) und c) ist erkenn-bar, dass eine Doppelbindung vorliegt. In der Schreibweise d) ist das nicht erkennbar.
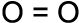

Dreifachbindung
Stickstoff-Atome, die nur fünf Elektronen auf der äußeren Schale haben, müssen sogar drei gemeinsame Elektronenpaare bilden, um die Edelgaskonfiguration zu erreichen. Man nennt das Dreifachbindung.
a) b)
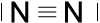
c) d) N2
Auch Dreifachbindungen sind in den Schreibweisen a), b) und c) erkennbar, in Schreibweise d) nicht.
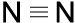

Chemische Bindungen


21
Atombindungen zwischen verschiedenen Atomen
Wenn ein Wasserstoff-Atom mit einem Chlor-Atom reagiert, so geschieht das folgendermaßen: Das Elektron des Wasser-stoff-Atoms bildet mit dem 7. Elektron der M-Schale des Chlor-Atoms ein gemeinsa-mes Elektronenpaar. Das Wasserstoff-Atom hat nun zwei Elektronen (nämlich das gemeinsame Elektronenpaar) auf seiner K-Schale, das Chlor-Atom hat auf seiner M-Schale ebenfalls dieses gemeinsame Elektronenpaar und außerdem die sechs Elektronen, die zu ihm alleine gehören. Somit haben beide Atome die Edelgaskon-figuration ihrer äußeren Schale erreicht.
a) b)
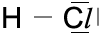
c) d)

Beachte: Auch Elektronen unterschiedli-cher Schalen (hier der K-Schale und der M-Schale) können problemlos ein gemein-sames Elektronenpaar bilden.
Wenn Sauerstoff mit Wasserstoff reagiert, dann bildet je ein Wasserstoff-Atom mit dem 5. und dem 6. Außenelektron des Sau-erstoff-Atoms ein gemeinsames Elektro-nenpaar. Dadurch erreicht jedes der beiden Wasserstoff-Atome seine K-Schalen-Edel-gaskonfiguration (zwei Elektronen auf der K-Schale) und auch das Sauerstoff-Atom erreicht seine L-Schalen-Edelgaskonfigura-tion. Es hat vier Elektronen für sich alleine und je ein gemeinsames Elektronenpaar mit jedem der beiden Wasserstoff-Atome; also insgesamt acht Elektronen auf der L-Schale. Für diese Reaktion benötigt jedes Sauerstoff-Atom zwei Wasserstoff-Atome.
a) b)
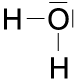


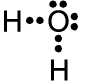
c) d) H2O
Wenn eine Atombindung zwischen zwei verschiedenen Atomen vorliegt, dann wird das gemeinsame Elektronenpaar von den beiden Atomkernen unterschiedlich stark angezogen: von dem elektronegativeren Atom stärker, von dem weniger elektrone-gativen Atom weniger stark. Deshalb befin-det sich das gemeinsame Elektronenpaar nä-her beim elektronegativeren Atom; man sagt auch: Das Bindungselektronenpaar ist zum elektronegativeren Partner hin verschoben. Man kann diese Elektronenverschiebung durch zwei verschiedene Schreibweisen darstellen:
a) Keilschreibweise
Die breite Seite des Keils zeigt, in welche Richtung die Bindungselektronen verscho-ben sind.
b) Dipolschreibweise
Das Atom mit der höheren Elektronegativi-tät bekommt eine leicht negative Ladung. Diese ist geringer als die Ladung eines gan-zen Elektrons. Man bezeichnet sie deshalb Partialladung (Teilladung) und bezeichnet sie mit dem griechischen Buchstaben Delta als δ-. Von dem weniger elektronegativen Atom ist das gemeinsame Elektronenpaar weiter entfernt. Dadurch bekommt dieses Atom eine geringe positive Partialladung (δ+). Das Molekül ist nach außen hin als Ganzes neutral, die Ladung des gesamten Moleküls ist Null. Innerhalb des Moleküls ist die Ladung jedoch ungleich verteilt:
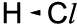
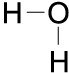
Chemische Bindungen

22


Beim Wassermolekül liegt noch eine wei-tere Besonderheit vor: Die beiden (partiell positiv geladenen) H-Atome stoßen sich gegenseitig ab. Dadurch vergrößert sich der Winkel zwischen ihnen von 90° auf 105°. Eine weitere Molekülspreizung verhindern die beiden freien ungepaarten Elektronen-paare des Sauerstoff-Atoms.
Entstehung des Winkels von 105° im Wassermolekül
Wiederholungsfragen
1. Erklären Sie die Entstehung der kova-lenten Atombindung am Beispiel F2!
2. Was ist der Grund dafür, dass unedle Gase immer molekular vorliegen?
3. Schreiben Sie die chemische Formel des Ammoniaks (NH3) in den vier Formel-schreibweisen!
4. Erklären Sie die Entstehung eines Dipols am Beispiel des Wassermoleküls!
5. Welches Molekül ist stärker polarisiert: H2O oder H2S?
(Siehe Tabelle 2.1 Elektronegativitäten von Hauptgruppenelementen)
Das Molekül hat einen positiven und einen negativen Pol. Man nennt es deshalb ein Di-pol-Molekül, weil räumlich 2 verschiedene Ladungsschwerpunkte vorhanden sind.



