Полная версия
Пять литров красного. Что необходимо знать о крови, ее болезнях и лечении
И уж совсем мало кто вспомнит, что у нас в теле есть два типа костного мозга: желтый – он в основном состоит из жира и не участвует в кроветворном процессе и красный костный мозг – тот самый центральный орган создания крови.
Здесь, в красном костном мозге, находятся стволовые кроветворные клетки. Из этих «клеток-родоначальниц» получаются эритроциты, тромбоциты, гранулоциты и моноциты, которые после длительного развития выходят из костного мозга в кровеносное русло и сразу начинают выполнять предназначенные функции.
«Как клетки могут из кости попасть в кровь?!» – спросите вы. С легкостью! В составе красного костного мозга есть два главных компонента: гемопоэтическая ткань (очень похожая на желе) и сеть сосудов-синусов, имеющих диаметр 50‒75 мкм. С помощью этих сосудов костный мозг, как и любой другой орган, снабжается кислородом и другими питательными веществами. И через эти же сосуды вновь образованные клетки крови попадают в кровеносное русло организма.
У красного костного мозга есть еще одна удивительная особенность: он умеет исчезать! Печень, например, или легкие не могут бесследно исчезнуть, а вот костный мозг – вполне. Состояние, когда красный костный мозг полностью аплазировался (аплазия – тотальное отсутствие органа), называется апластической анемией. В таком случае красный костный мозг замещается желтым (жиром), образуются пустоты – большие жировые вакуоли, кости буквально пустеют. И, конечно же, клетки крови перестают вырабатываться. Как и следовало ожидать, такое состояние угрожает жизни. К счастью, во многих случаях оно успешно лечится.

Рис. 3. Где находится костный мозг?
Причины этого состояния могут быть как врожденными, так и приобретенными. Если вы смотрели сериал «Чернобыль», то видели, как выглядят люди с острой лучевой болезнью. Все они так или иначе столкнулись с гибелью клеток костного мозга. Кстати, именно радиационное облучение используется и при лечении болезней костного мозга, когда надо убить больные клетки и заместить их здоровыми.
При переломах же костей, вопреки ожиданиям, костный мозг никуда не девается: даже если произошел серьезный перелом таза, благодаря своей гелеобразной структуре костный мозг не «убегает», и потерять его даже при серьезной травме невозможно.
Тимус, селезенка, лимфатические узлы: где создаются лимфоциты?
Если с эритроцитами и тромбоцитами мы разобрались (они рождаются и обучаются в костном мозге), то с лимфоцитами все несколько сложнее. В процессе формирования они путешествуют по всему телу: как особо любознательные студенты, они едут учиться за границу – из селезенки в тимус с экскурсионным туром по лимфатическим узлам и даже к кишечнику.
Селезенка находится в левом подреберье и является главным местом созревания лимфоцитов. На самом деле доучивание лимфоцитов не единственная ее профессия: у селезенки очень много функций.
Она выступает в роли фильтра для бактерий – удаляет их из крови. Вырабатывает антитела для борьбы с инфекциями.
Кроме того, она является своего рода депо (да, прямо как трамвайное или автобусное) для здоровых клеток крови. И претворяет в жизнь максиму «старикам тут не место»: уничтожает «престарелые» эритроциты и тромбоциты, которые отслужили свое.
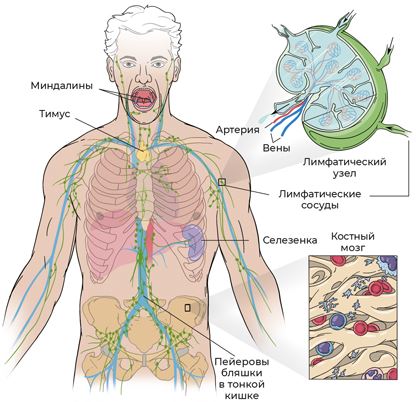
Рис. 4. Где вырабатываются и обучаются лимфоциты?
Если по какой-то причине нарушается работа костного мозга, то селезенка берет процесс кроветворения на себя.
Как ни странно, человек может жить без такого важного и многофункционального органа: возможно, вы слышали, что при серьезных авариях, например, случается разрыв селезенки, но если человеку вовремя оказана помощь и купировано кровотечение, то это не фатально.
Нельзя сказать, что жизнь без селезенки можно назвать здоровой: часть ее функций на себя берет печень и костный мозг, но проблемы с иммунитетом неизбежно будут возникать, и для их устранения потребуется та или иная терапия.
Тимус – орган, находящийся за грудиной, исполняет роль учебного центра для лимфоцитов. Он ничего не вырабатывает сам, зато дает образование лимфоцитам, трансформируя их в лимфоцитов-хирургов – Т-лимфоциты. Их еще называют Т-киллеры или цитотоксические Т-лимфоциты. Их главная функция – уничтожение поврежденных клеток собственного организма. Они с азартом убивают опасные опухолевые клетки, а также клетки, пораженные внутриклеточными паразитами (к этим паразитам относятся вирусы и некоторые виды бактерий). Плюс к этому Т-киллеры являются главным компонентом антивирусного иммунитета.
Однако с момента полового созревания тимус частично перестает работать: происходит атрофия клеток, а вместо них образуется жир. К 45 годам жировая ткань заполняет более 50 % тимуса. Отчасти из-за этого у пожилых людей снижается активность иммунной системы.
Лимфатические узлы. Наша сосудистая система состоит из двух подсистем: кровеносной и лимфатической. По артериям богатая кислородом кровь притекает к органам, а оттекает по венам и лимфатическим сосудам. Несмотря на то что лимфатические сосуды существуют отдельно, а кровеносные – отдельно (у кровеносных есть «насос» – сердце, а у лимфатических такого «агрегата» нет), эти две системы неразрывно связаны: например, потоки лимфы и крови соединяются недалеко от сердца.
На долю лимфатической системы приходится около 1 % массы тела, и основной ее вес – лимфатические узлы. Они распределены по всему организму и функционируют как единое целое. Как правило, узлы сгруппированы по 4‒10 штук вдоль по ходу лимфатических сосудов. Через сосуды внутрь узлов попадают лимфоциты и там проходят несколько ступеней обучения. Например, их здесь «представляют» различным инородным агентам, которые организм считает болезнетворными. Лимфоцит знакомится с вирусом или бактерией, запоминает – и при следующей встрече готовится дать достойный отпор.
Кроме того, здесь вырабатываются специализированные Т-лимфоциты, защищающие организм от сбоев, и антитела для борьбы с инфекциями.
После того как лимфоциты обучены, они отправляются обратно в кровеносное русло. Помимо роли обучающей площадки, лимфатические узлы, как и селезенка, выполняют функцию биологического фильтра: задерживают бактерии. Именно лимфоузлы являются первым местом, куда метастазируют опухоли, поэтому они играют важную роль в диагностике онкологических заболеваний.
Из чего создается кровь?
Итак, мы узнали, какие органы создают и обучают клетки крови. Но как именно происходит гемопоэз – процесс кроветворения?
Это многостадийный и сложный процесс деления и созревания стволовых кроветворных клеток, в результате которого в кровь выходят зрелые лейкоциты, тромбоциты и эритроциты. Кроветворные стволовые клетки находятся в костном мозге и немного в крови, еще в плацентарной и пуповинной крови.
Основоположником современной теории кроветворения стал российский гистолог Александр Александрович Максимов, который в 1907 году аргументированно обосновал гипотезу, что каждая клетка крови развивается из единой «родоначальной» клетки. Он дал ей в своем докладе перед обществом гематологов в Берлине название Stammzelle (сейчас это известно как «мультипотентная стволовая кроветворная клетка») – так благодаря этому великому российскому ученому появилось понятие «стволовая клетка» и целое новое направление в науке. Я горжусь тем, что учился в академии, где он в свое время преподавал и проводил исследования: это был не только высокоэрудированный ученый, владевший четырьмя языками, но и человек с сильным и независимым характером. Не став терпеть порядки, насаждаемые большевистским начальством в академии, он в феврале 1922 года с женой и сестрой совершил дерзкий побег (как утверждают, на буере по льду Финского залива) в Финляндию, откуда затем отправился в США, где снова занялся своим любимым делом – исследованием клеток человеческих тканей.
Вернемся, однако, к рассказу о стволовых кроветворных клетках. Они обладают двумя уникальными свойствами:


Мне очень нравится наглядное сравнение стволовой кроветворной клетки с маткой в пчелином улье: есть главная пчелиная матка, и остальные в семье являются ее потомками. С кроветворением почти так же: существуют главные клетки-матки, а уже из них развиваются все остальные. И как в улье, где один пчелиный рой всегда представлен потомками нескольких семей от разных маток, кроветворение у человека «поликлонально», то есть представлено потомками не одной, а нескольких стволовых клеток.
Как бы нам ни хотелось, но стволовых клеток ограниченное количество, и они не могут делиться бесконечно. Поэтому, как правило, каждая из клеток создает свой клон – своеобразного «исполнителя» ее воли. Он выглядит и действует точно так же, как стволовая клетка, но, в отличие от нее, смертен: в среднем он истощается (то есть устает делиться и погибает) уже через месяц. Таким образом стволовые клетки берегут себя, обеспечивая себе то, что можно в некотором смысле назвать бессмертием.
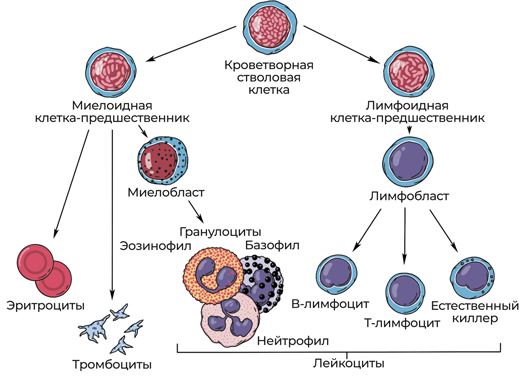
Рис. 5. Процесс кроветворения
Глава 3
«Регулировщики движения»: эритропоэтин, тромбопоэтин и их роль в кроветворении
Формирование того или иного вида клеток крови зависит от потребностей организма и от целого ряда внешних факторов.
Процесс гемопоэза управляется цитокинами – маленькими пептидными молекулами, которые называют факторами. Они стимулируют или подавляют выработку тех или иных клеток. Каждый фактор как регулировщик на перекрестке: запускает один поток машин и тормозит другой.
Число клеток крови в единицу времени регулируется по принципу обратной связи.
Например, количество эритроцитов и содержание гемоглобина в них зависят от потребностей тканей в кислороде. В условиях дефицита кислорода – скажем, при изматывающих физических нагрузках или длительном нахождении высоко в горах – организм сначала реагирует через компенсаторные механизмы: учащается дыхание, повышается частота сердечных сокращений (тахикардия). Так тело пытается добыть больше кислорода (дышать чаще) и заставить его циркулировать быстрее (частое сердцебиение).
Если же возросшая потребность в кислороде сохраняется дольше нескольких часов или даже суток, повышается выработка одного из главных «регулировщиков» – эритропоэтина. Этот гормон стимулирует выработку эритроцитов: их становится больше, они переносят кислород активнее, и дефицит кислорода в тканях устраняется. Именно благодаря такой перенастройке организма у спортсменов при регулярных тренировках повышается выносливость.
Эритропоэтин вырабатывается в основном почками (до 90 %), клетками печени и в некоторой степени клетками венозных сосудов и селезенкой.
Активнее всего этот гормон синтезируется при недостатке кислорода, например в условиях высокогорья. Я недавно побывал на Алтае и заинтересовался горами, в частности посмотрел документальные фильмы про покорение Эвереста.
Практически все альпинисты при восхождении на него берут с собой шерпов – местных жителей. Непал, на территории которого находится Эверест, – самая высокогорная страна. Около 40 % ее территории находится выше 3000 м над уровнем моря. Поэтому многие местные жители рождаются и живут в условиях высокогорья.
Человек, который всю жизнь прожил в низине, при подъеме в горы начинает испытывать гипоксию. В горах воздух более разреженный, для нас там кислорода недостаточно, поэтому, поднимаясь, мы ощущаем головокружение, может болеть голова, возникать «мушки» перед глазами, ощущение усталости. Чтобы не развилась горная болезнь, жители низины должны подниматься в горы постепенно и оставлять себе достаточно времени для акклиматизации – позволять телу привыкнуть к новым условиям.
На Эвересте же акклиматизироваться невозможно: после 8000 м над уровнем моря начинается так называемая зона смерти, где воздух содержит всего 1/3 от той нормы кислорода, к которой мы привыкли на равнине.
У шерпов, которые живут на высоте в среднем 2000‒3000 м над уровнем моря, повышенный уровень эритропоэтина, а значит, больше гемоглобина и эритроцитов. И проблемы со здоровьем у них возникают, когда они не поднимаются, а, наоборот, спускаются в низину. Внизу для них слишком много кислорода: организм не понимает, как теперь жить и что делать, на уровне симптомов это ощущается как головокружение и головная боль. И они, спускаясь вниз, тоже должны проходить процесс акклиматизации.
Кроме высокогорья, причиной повышенного уровня эритропоэтина могут быть как физические нагрузки, так и различные заболевания. Например, эритропоэтин стабильно повышен у людей с врожденными пороками сердца, при хронических болезнях органов дыхания, при большинстве анемий.
И наоборот, снижение синтеза эритропоэтина наблюдается при истинной полицитемии (заболевание, при котором повышается количество эритроцитов), хронической болезни почек и анемии хронических заболеваний.
Определение уровня эритропоэтина имеет большое значение для дифференциальной диагностики.
Помимо эритропоэтина, существует множество других цитокинов, регулирующих не только правильное созревание, но и выживание стволовых клеток, которые без их сопровождения подвергаются апоптозу – клеточному самоубийству.
Среди этих «регулировщиков» есть гранулоцитарный колониестимулирующий фактор (Г-КСФ), который влияет на количество гранулоцитов; тромбопоэтин, контролирующий уровень тромбоцитов, и множество других. Главное – постарайтесь запомнить их общее название: цитокины. Мы вернемся к ним, когда станем говорить о заболеваниях. И если вы будете знать, что цитокин = «регулировщик» производства различных клеток крови, то вся картина происходящего станет вполне понятной.
К 2020 году мы научились искусственно и вне человеческого организма синтезировать лекарственные препараты – стимуляторы кроветворения: рекомбинантный эритропоэтин, гранулоцитарный колониестимулирующий фактор (Г-КСФ), агонисты рецептора тромбопоэтина.
Препараты эритропоэтина используются для лечения заболеваний, сопровождающихся снижением его уровня, прежде всего при хронической болезни почек, а агонисты тромбопоэтина – при сниженном количестве тромбоцитов.
Глава 4
Для чего организму нужны железо и витамины?
Для правильного функционирования организма и образования клеток требуется разнообразное питание: белки, витамины, аминокислоты и микроэлементы. В случае с кровью это важно прежде всего для эритроцитов. Их в крови, как мы уже говорили, больше, чем других клеток, и они выполняют важнейшую функцию – снабжение всех тканей кислородом.
Среди особо важных элементов, без которых начинает развиваться анемия: железо (Fe), кобаламин – витамин В12 и фолиевая кислота – витамин В9.
Железо – микроэлемент, который участвует в транспортировке кислорода по телу, в осуществлении энергетической функции клеток и синтезе нуклеиновых кислот.
Как вы знаете, железо после алюминия самый распространенный металл в земной коре. В то же время его дефицит в организме остается большой проблемой и встречается, по оценкам Всемирной организации здравоохранения (ВОЗ), у более чем 30 % женщин репродуктивного возраста, что связано с менструальным циклом и беременностью.
Целители древности приписывали железу магические и лечебные свойства. Например, считалось, что вода и вино, в которых ржавел меч, придают воину силу. Как ни странно, многие мифы о железе сохранились до сих пор. Например, считается, что при дефиците железа необходимо есть больше яблок. Непонятно, откуда взялся этот миф и почему он такой жизнестойкий? Давно известно: организмом лучше всего усваивается железо, содержащееся в продуктах животного происхождения.
В своей практике я встречал людей, которые втыкали в яблоки железные гвозди: те ржавели, и потом это яблоко съедали вместе со ржавчиной, чтобы «восполнить» дефицит железа в организме.
Еще один мой пациент где-то вычитал, что если в воду опустить кусок железа и дать ей настояться, то она приобретает полезные свойства. Через два месяца регулярного питья такой воды в его анализе крови ничего к лучшему не изменилось, и он стал принимать препараты железа, которые я прописал.
Иногда мифы действительно могут быть сильны, но я предпочитаю опираться на доказательную медицину. А она говорит: железо как микроэлемент усваивается не из гвоздей. Его процесс усвоения очень интересен: в нем непросто, но полезно будет разобраться.
Железо в организме: доход, расход, запас






Как усваивается железо?
При нормальном функционировании организма поддерживается баланс между расходом железа и его поступлением с пищей.
Как же происходит всасывание железа?
Поступившее с пищей железо всасывается преимущественно в двенадцатиперстной кишке и начальных отделах тощей кишки. Железо в организм поступает в двух формах:


Также есть ряд продуктов, которые мешают железу усваиваться: яичный белок, коровье молоко, бобовые, чай, кофе.
Однако далеко не все железо, поступающее в организм с пищей, усваивается. Почему? Во-первых, оно имеет низкую биодоступность. А во-вторых, его поступление зависит от того, сколько уже железа есть в организме, а также от «запросов» костного мозга. Логично, что при истощении запасов железа оно будет всасываться усиленно, так же как при увеличенном количестве делящихся предшественников эритроцитов, которым этот элемент необходим для полноценного созревания. И наоборот, при избытке железа и снижении активности производства эритроцитов всасывание железа будет уменьшаться.
Главная физиологическая роль железа в том, что оно входит в состав гемоглобина. Поступившее в кровь железо связывается с белком-транспортером – трансферрином. Дальше трансферрин передает железо предшественникам эритроцитов, и внутри их митохондрий и затем в цитоплазме клеток железо превращается в гем (комплексное соединение производных порфирина[3] с ионом железа), который связывается с белком глобином, образуя гемоглобин.
Эритроцит приобретает гемоглобин, созревает и отправляется в кровеносное русло, чтобы выполнять свою функцию: с помощью содержащегося в нем гемоглобина переносить кислород по телу.
Оставшееся железо становится компонентом ферритина – сложного белка, который сохраняет запас железа на трудные времена, например на случай, если его будет недостаточно поступать с пищей.
После того как эритроциты выполнят положенные им функции за 120 дней, они поглощаются макрофагами в селезенке, печени и костном мозге, и высвобождающееся при этом железо практически полностью реутилизируется, отправляясь в костный мозг для синтеза гемоглобина в новых молодых эритроцитах. Вот такое экономное и практически безотходное производство работает в нашем организме: из «отслуживших свое» эритроцитов организм ежесуточно получает для синтеза гемоглобина и эритропоэза 21‒24 мг железа, тогда как из пищеварительного тракта всего 1‒2 мг. Таким образом, в физиологических условиях в организме существует замкнутый цикл железа, позволяющий свести к минимуму его потери.
Зачем нам витамины?
Витамины – незаменимые составляющие обменных процессов, и недостаток всего одного витамина может сказаться на производстве клеток крови.
Витамин В12 – следующий по значимости микроэлемент для системы кроветворения после железа. При дефиците витамина В12 нарушается привычный метаболизм и синтез ДНК, в связи с чем кроветворные клетки перестают активно делиться и созревать. В результате в костном мозге нарушается кроветворение и клетки остаются на ранних стадиях развития.
В отличие от других витаминов группы В витамин В12 не синтезируется растениями. Он продуцируется многими бактериями и некоторыми видами плесневых грибов, но, так как мы их не едим, источником поступления витамина В12 в наш организм являются только продукты животного происхождения: печень, почки, мышцы, яйца, сыр, молоко.
С пищей человек получает в среднем от 5 до 15 мкг витамина В12 ежедневно. Общее содержание этого витамина в организме человека – 3‒4 мг, из них около половины находится в печени. Запасы в печени способны обеспечить физиологические потребности организма в течение 3‒5 лет после прекращения поступления витамина. Ежедневная потеря витамина в норме компенсируется поступлением с пищей.
Фолиевая кислота – последний важный элемент для кроветворения. Она синтезируется высшими растениями и микроорганизмами. Наибольшее количество фолиевой кислоты содержится в зеленых овощах, дрожжах, в печени и почках животных.
Основные источники кислоты в нашем с вами меню – овощи, фрукты, зерновые и молочные продукты. Фолиевая кислота обладает высокой биодоступностью: усваивается около 40–70 %, однако она сильно разрушается при приготовлении пищи. Рекомендуемая ежедневная норма потребления для взрослых – 300–600 мкг.
Фолиевая кислота всасывается в тощей кишке. Главное депо фолиевой кислоты – печень. В клетках печени она находится в неактивном состоянии и переходит в активную форму по мере метаболических потребностей клеток.
В отличие от витамина В12 запасы фолиевой кислоты в организме невелики, и при исключении ее из пищи резерв истощается уже через 3–4 недели.
Производные фолиевой кислоты, так же как и витамина В12, принимают непосредственное участие в делении клеток при кроветворении, так что при дефиците фолиевой кислоты развивается мегалобластная анемия, о которой мы поговорим в отдельной главе.
Кроме того, при ее дефиците в организме накапливается токсичная аминокислота гомоцистеин, что приводит к риску развития тромбозов, самые опасные из которых – инсульт или инфаркт миокарда.
Глава 5
Почему вся кровь не вытекает при ранении? Что такое гемостаз?
У человеческого организма, как и у любого грамотно спроектированного космического корабля, есть несколько степеней защиты от повреждений. Давайте поговорим про жизнеугрожающее повреждение – кровотечение. Ему противостоит аварийная система, которая на языке медицины называется гемостаз.
Это важный механизм защиты, обеспечивающий целостность системы циркуляции крови. Ключевыми функциями системы гемостаза являются сохранение жидкого состояния крови и в то же время предупреждение и остановка кровотечения.




