
Полная версия
Законы эпидемий. Как развиваются и почему прекращаются эпидемии болезней, финансовые кризисы, вспышки насилия и модные тренды
Со временем к Россу присоединились другие. Одним из участников экспедиции 1901 года в Сьерра-Леоне был молодой врач из Глазго Андерсон Маккендрик. Он получил высшие баллы на экзаменах Индийской медицинской службы и после поездки в Сьерра-Леоне должен был отправиться в Индию[37]. На обратном пути в Британию Маккендрик и Росс долго беседовали о математических аспектах эпидемий. В последующие годы они продолжали обмениваться идеями. В конце концов Маккендрик в достаточной степени овладел математикой, чтобы попытаться развить анализ Росса. «Прочел вашу работу, – писал он Россу в августе 1911 года. – Я пытаюсь прийти к тем же выводам с помощью дифференциальных уравнений, но это очень трудная задача, и мне приходится расширять свои познания в математике в новых направлениях. Не уверен, что смогу получить то, чего хочу, но “следует пробовать даже то, что может казаться невозможным”»[38].
Маккендрик подвергся резкой критике со стороны статистиков, в том числе Карла Пирсона, который опирался исключительно на описательный анализ и отвергал механистические методы Росса. «Сторонники Пирсона, как всегда, все смешали в кучу, – писал Маккендрик Россу, прочитав некорректный анализ малярийных эпидемий. – Я не испытываю симпатии ни к ним, ни к их методам»[39]. Традиционный описательный подход был и остается важной частью медицинской науки, но он мало помогает понять, как происходит процесс передачи инфекции. Маккендрик был убежден, что будущее анализа эпидемий за более динамичным способом мышления. Росс придерживался той же точки зрения. «Рано или поздно появится новая наука, – однажды сказал он Маккендрику. – Но сначала мы с вами должны отпереть дверь, чтобы затем в нее вошли все, кто этого захочет»[40].
Летним вечером 1924 года во время эксперимента, который проводил Уильям Кермак, произошел взрыв, и едкая щелочь попала ему в глаза. Химик по образованию, Кермак изучал методы анализа спинномозговой жидкости. В тот вечер в лаборатории Королевского колледжа Эдинбурга он работал один. Ему пришлось два месяца провести в больнице, и после этого несчастного случая 26-летний Кермак полностью ослеп[41].
Во время пребывания в больнице Кермак просил друзей и сиделок читать ему книги по математике. Понимая, что зрение к нему не вернется, он тренировался получать информацию другим путем. У него была превосходная память, и математические задачи он решал в уме. «Просто невероятно, как много он мог сделать, не имея возможности записать что-либо на бумаге», – восхищался его коллега Уильям Маккри.
Выписавшись из больницы, Кермак продолжил заниматься наукой, но переключился на другие области. Он оставил химические опыты и начал разрабатывать новые проекты. В частности, он работал над математическим обеспечением исследований вместе с Андерсоном Маккендриком, который возглавил лабораторию в Эдинбурге. Проработав в Индийской медицинской службе два десятка лет, в 1920 году Маккендрик уволился и вместе с семьей переехал в Шотландию.
Кермак и Маккендрик развивали идеи Росса, пытаясь применить их к эпидемиям в целом. Они сосредоточились на одном из главных вопросов в изучении болезней: что приводит к окончанию эпидемии? В то время существовало два популярных объяснения. Либо передача инфекции прекращалась потому, что не оставалось восприимчивых к ней людей, либо по мере распространения эпидемии патоген становился менее заразным. Как выяснилось, в большинстве случаев оба объяснения неверны[42].
Как и Росс, Кермак и Маккендрик начали с разработки математической модели передачи болезни. Для простоты они предположили, что население перемешивается случайным образом. Подобно тому как это происходит при встряхивании камешков в сосуде, каждый человек в популяции обладает равными шансами встретиться с любым другим. В их модели эпидемия начиналась с определенного количества больных людей, а все остальные были восприимчивы к инфекции. После выздоровления человек приобретал иммунитет. Таким образом, всех людей в популяции можно разделить на три группы на основе их состояния:

Эту модель часто называют «моделью SIR» – по первым буквам названий групп (англ. susceptible, infectious, recovered). Предположим, в популяции численностью 10 тысяч человек один человек заболевает гриппом. Если мы смоделируем эпидемию гриппа с помощью модели SIR, то получим следующую кривую:
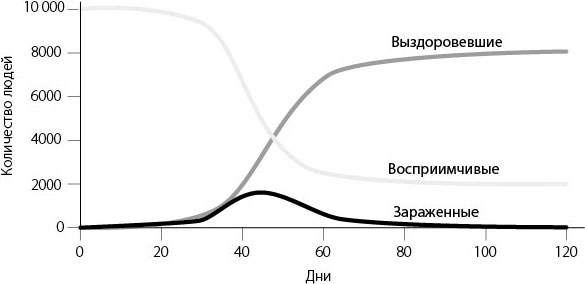
Модель SIR для эпидемии гриппа
Смоделированная здесь эпидемия развивается медленно, поскольку начинается с одного зараженного человека, но через 50 дней все равно достигает пика. Через 80 дней она практически заканчивается. Обратите внимание, что в конце эпидемии по-прежнему остается какое-то количество восприимчивых людей. Если бы заразились все 10 тысяч человек, то все они в конце концов попали бы в группу «Выздоровевшие». Модель Кермака и Маккендрика указывает на то, что этого не случится: вспышка заболевания может закончиться прежде, чем переболеют все до единого. «В общем случае эпидемия заканчивается раньше, чем заканчивается восприимчивое население», – писали они.
Почему заражаются не все? Все дело в переломе, который происходит в середине вспышки. На ранних этапах эпидемии восприимчивых людей много. В результате каждый день число новых зараженных превышает число выздоровевших, и эпидемия набирает обороты. Но со временем количество восприимчивых людей сокращается. Когда их становится достаточно мало, тенденция обращается вспять: ежедневно число выздоровевших превышает число зараженных, и эпидемия идет на спад. Еще остаются восприимчивые к инфекции люди, которые могут заразиться, но их немного, и у любого заболевшего больше шансов выздороветь, чем заразить кого-то еще.
Для иллюстрации этого эффекта Кермак и Маккендрик показали, как модель SIR воспроизводит динамику эпидемии чумы в Бомбее (ныне Мумбаи). В модели заразность патогена не меняется со временем; развитие и спад эпидемии зависят от меняющегося числа восприимчивых и зараженных.
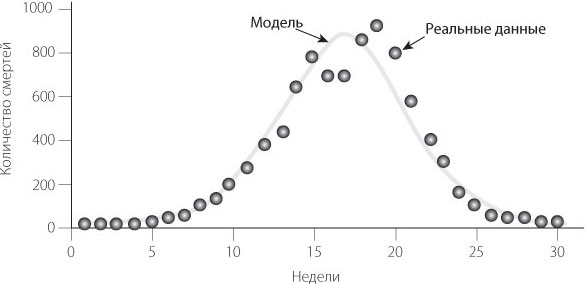
Эпидемия чумы в Бомбее в 1906 году: модель и реальные данные
Перелом наступает на пике эпидемии. В этот момент людей с иммунитетом становится так много, а восприимчивых так мало, что эпидемия больше не может разрастаться. Поэтому тенденция меняется на противоположную, и начинается спад.
Когда в популяции набирается достаточное количество людей с иммунитетом, чтобы передача инфекции прекратилась, мы говорим о появлении стадного (коллективного) иммунитета. Этот термин предложил в начале ХХ века статистик Мейджор Гринвуд[43]. Ранее психологи уже использовали термин «стадный инстинкт», описывая поведение групп, члены которых действуют коллективно, а не как отдельные личности[44]. Аналогичным образом, наличие стадного иммунитета означает, что население в целом способно блокировать передачу инфекции несмотря на то, что отдельные люди остаются восприимчивыми к ней.
Концепция коллективного иммунитета обрела популярность несколько десятилетий спустя, когда стало ясно, что это мощное средство борьбы с болезнями. Во время эпидемии люди перестают быть восприимчивыми к инфекции естественным образом – по мере заражения. Но в случае со многими болезнями органы здравоохранения могут целенаправленно, путем вакцинации, выводить людей из группы восприимчивых. В свое время Росс предположил, что малярию можно победить, не уничтожая всех комаров; точно так же коллективный иммунитет позволяет остановить распространение инфекции без необходимости вакцинировать все население. Есть категории людей, которых нельзя вакцинировать: это, например, новорожденные младенцы и люди с ослабленной иммунной системой, – но благодаря коллективному иммунитету привитые люди защищают не только себя, но и эти уязвимые группы[45]. А если болезнь можно контролировать с помощью вакцинации, значит, теоретически от нее можно избавиться навсегда. Вот почему концепция коллективного иммунитета занимает центральное место в теории эпидемий. «У этой концепции особая аура», – так однажды выразился эпидемиолог Пол Файн[46].
Кермак и Маккендрик не только искали причины окончания эпидемий; их также интересовала относительная редкость вспышек. Анализируя свою модель, они обнаружили, что процесс передачи инфекции крайне чувствителен к небольшим изменениям в характеристиках патогена или популяции людей. Это объясняет, почему масштабные эпидемии появляются словно из ниоткуда. Согласно модели SIR, для вспышки заболевания нужны три условия: достаточно заразный патоген, большое количество контактов между разными людьми и достаточное число восприимчивых людей в популяции. Вблизи критического порога коллективного иммунитета небольшое изменение одного из этих факторов может определить разницу между несколькими случаями заболевания и масштабной эпидемией.
Первая зарегистрированная вспышка лихорадки Зика началась на острове Яп в Микронезии в начале 2007 года. До этого было известно только о 14 случаях заражения людей вирусом Зика – в Уганде, Нигерии и Сенегале. Но вспышка болезни на острове Яп была другой. Она была совершенно неожиданной и носила взрывной характер: заразилась бо́льшая часть населения. Очевидно, для малоизученного вируса из тропического леса начиналась новая эпоха. «Руководители органов здравоохранения должны знать о риске дальнейшего распространения вируса Зика», – заключили эпидемиолог Марк Даффи и его коллеги в докладе об эпидемии[47].
На острове Яп вирус Зика скорее вызывал любопытство, чем воспринимался как серьезная угроза. У многих людей наблюдались лихорадка и сыпь, но госпитализировать никого не пришлось. Ситуация изменилась, когда в конце 2013 года вирус пришел на более крупные острова Французской Полинезии. Во время вспышки в главную городскую больницу Папеэте на северном побережье Таити попали 42 человека с синдромом Гийена – Барре. Случаи СГБ стали регистрироваться несколько позднее, чем началась вспышка лихорадки Зика, что соответствовало нашим ожиданиям: синдром проявляется через пару недель после заражения. Гипотеза о возможной связи с вирусом подтвердилась, когда местная исследовательница Ван-Маи Као-Лормо и ее коллеги выяснили, что почти все пациенты с СГБ недавно были инфицированы вирусом Зика[48].
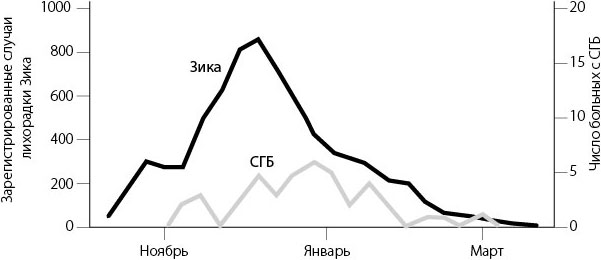
Заболеваемость лихорадкой Зика и синдромом Гийена – Барре во Французской Полинезии в 2013–2014 годах
По данным Министерства здравоохранения Французской Полинезии[49]
Как и на острове Яп, эпидемия во Французской Полинезии была масштабной – заразилось большинство населения. И вновь вспышка оказалась очень короткой: большинство новых случаев заражения отмечалось в первые несколько недель. Поскольку в 2014–2015 годах наша группа разрабатывала математические модели для анализа лихорадки денге на островах Тихого океана, мы решили заодно заняться и вирусом Зика. Если малярию переносят одноцветные комары Anopheles, которые могут летать на дальние расстояния, то переносчики лихорадки денге и вируса Зика, комары Aedes, обладают двумя особенностями: полосками на теле и ленью (aedes переводится с латыни как «дом»). Поэтому инфекцию за них распространяют люди, перемещаясь из одного места в другое[50].
Попытавшись получить модели, воспроизводящие динамику эпидемии лихорадки Зика во Французской Полинезии, мы поняли, что для такого взрывного роста требуется высокая скорость распространения, как у лихорадки денге[51]. Непродолжительность вспышки показалась нам еще более странной, когда мы учли задержки в процессе заражения. В каждом цикле передачи инфекции вирус должен был перейти от человека к комару, а от него – к другому человеку.
Анализируя скорость передачи вируса во Французской Полинезии, мы также оценили, сколько людей уже было заражено в октябре 2013 года, когда стало известно о первых случаях. Наша модель строилась на предположении, что к тому моменту было заражено несколько сотен человек; а это значило, что вирус попал в страну на несколько недель или даже месяцев раньше. Этот вывод был связан с другой загадкой: как вирус Зика добрался до Латинской Америки? После выявления первых случаев в Бразилии в мае 2015 года возникло множество предположений о том, когда именно вирус попал на континент и кто его принес. Наша первоначальная гипотеза указывала на чемпионат мира по футболу, проходивший в Бразилии в июне – июле 2014 года и собравший более трех миллионов футбольных болельщиков со всего света. Другим вариантом был чемпионат по спринтерским гонкам на каноэ в Рио-де-Жанейро в августе 2014 года. В отличие от футбольного чемпионата в этом менее масштабном спортивном мероприятии участвовала команда из Французской Полинезии. Какое же объяснение было более правдоподобным?
По мнению эволюционного биолога Нуно Фариа и его коллег, обе гипотезы были недостаточно убедительны[52]. Изучив генетическое разнообразие вирусов Зика, циркулировавших в Латинской Америке до 2016 года, исследователи пришли к выводу, что первые заражения произошли гораздо раньше, чем считалось. Вероятно, вирус попал на континент в середине или в конце 2013 года. Слишком рано для гонок на каноэ или чемпионата мира по футболу – зато в июне 2013 года проходил Кубок конфедераций, региональный футбольный турнир среди национальных сборных. Более того, в нем участвовала сборная Французской Полинезии.
У этой теории был всего один недостаток: Кубок конфедераций состоялся за пять месяцев до первых сообщений о лихорадке Зика во Французской Полинезии. Но если на островах эпидемия началась раньше октября 2013 года – на что указывал наш анализ, – то вполне возможно, что вирус попал в Латинскую Америку именно тем летом. (Разумеется, не стоит фанатично пытаться связать вирус Зика со спортивными состязаниями: не исключено, что болезнь привез случайный человек, прилетевший в Бразилию в 2013 году.)
Анализируя прошедшие эпидемии, мы можем использовать математические модели, чтобы попытаться предсказать будущее. Это было бы особенно полезно для органов здравоохранения, которым приходится принимать непростые решения во время вспышек заболеваний. Одна из таких проблем возникла в декабре 2015 года, когда вирус Зика добрался до острова Мартиника в Карибском море. Возникли серьезные опасения, что остров не справится с СГБ: если у пациентов начнут отказывать легкие, им потребуется искусственная вентиляция. В то время на Мартинике было всего восемь аппаратов ИВЛ – на 380 тысяч человек. Хватит ли их?
Чтобы это выяснить, исследователи из Института Пастера в Париже разработали модель передачи вируса Зика на острове[53]. В первую очередь их интересовала общая форма кривой. Пациенты с СГБ, которым требуется искусственная вентиляция легких, обычно проводят под аппаратом ИВЛ несколько недель, а потому непродолжительная вспышка с высоким пиком могла перегрузить систему здравоохранения, тогда как при более долгой эпидемии с плоской кривой этого бы не произошло. В самом начале вспышки на Мартинике случаев заражения было немного, поэтому исследователи в качестве исходных данных взяли статистику Французской Полинезии. Из 42 пациентов с СГБ, зарегистрированных в 2013–2014 годах, искусственная вентиляция легких потребовалась двенадцати. Согласно модели ученых из Института Пастера, это указывало на возможную проблему. Если эпидемия на Мартинике будет развиваться по тому же сценарию, что и во Французской Полинезии, острову может потребоваться девять аппаратов ИВЛ – на один больше, чем есть.
К счастью, эпидемия на Мартинике развивалась иначе. Когда пришли новые данные, стало ясно, что вирус распространяется медленнее, чем во Французской Полинезии. Исследователи подсчитали, что на пике эпидемии пациентам с СГБ потребуется всего три аппарата ИВЛ. По их оценке, даже при худшем сценарии хватило бы семи штук. Вывод оказался верным: на пике эпидемии искусственная вентиляция легких потребовалась пяти пациентам с СГБ. Всего больных с СГБ было тридцать, и двое из них умерли. Без необходимого медицинского оборудования смертность оказалась бы гораздо выше[54].
Эти исследования эпидемий, вызванных вирусом Зика, – пример того, как методы Росса повлияли на наше понимание инфекционных болезней. В настоящее время механистические модели, позволяющие предсказывать форму кривой и оценивать эффективность контрольных мер, стали основой для изучения эпидемий. Исследователи прибегают к моделям, чтобы помочь органам здравоохранения реагировать на эпидемии самых разных болезней, от малярии и вируса Зика до ВИЧ и Эболы, во всех уголках мира, от затерянных в океане островов до зон боевых действий.
Вне всяких сомнений, Росс был бы рад, увидев, какое признание получили его идеи. За открытие того, как малярия передается через комаров, его наградили Нобелевской премией, однако он не считал это своим самым большим достижением. «Своей главной работой я считаю выявление общих законов эпидемий», – писал Росс[55]. И он имел в виду не только эпидемии болезней.
Конец ознакомительного фрагмента.
Текст предоставлен ООО «ЛитРес».
Прочитайте эту книгу целиком, купив полную легальную версию на ЛитРес.
Безопасно оплатить книгу можно банковской картой Visa, MasterCard, Maestro, со счета мобильного телефона, с платежного терминала, в салоне МТС или Связной, через PayPal, WebMoney, Яндекс.Деньги, QIWI Кошелек, бонусными картами или другим удобным Вам способом.
Примечания
1
История пандемии 1918 года: Barry J.M., ‘The site of origin of the 1918 influenza pandemic and its public health implications’ Journal of Translational Medicine, 2004; Johnson N.P.A.S. and Mueller J., ‘Updating the Accounts: Global Mortality of the 1918–1920 “Spanish” Influenza Pandemic’ Bulletin of the History of Medicine, 2002; World War One casualty and death tables. PBS, Oct 2016. https://www.uwosh.edu/faculty_staff/henson/188/WWI_Casualties%20and%20Deaths%20%20PBS.html. Стоит отметить, что недавно появились новые теории происхождения пандемии гриппа 1918 года, согласно которым она началась раньше, чем принято считать. Например, Branswell H., ‘A shot-inthe-dark email leads to a century-old family treasure – and hope of cracking a deadly flu’s secret’, STAT News, 2018.
2
Примеры цитирования в средствах массовой информации: Gerstel J., ‘Uncertainty over H1N1 warranted, experts say’ Toronto Star, 9 October 2009; Osterholm M.T., ‘Making sense of the H1N1 pandemic: What’s going on?’ Center for Infectious Disease Research and Policy, 2009.
3
Eames K.T.D. et al., ‘Measured Dynamic Social Contact Patterns Explain the Spread of H1N1v Influenza’, PLOS Computational Biology, 2012; Health Protection Agency, ‘Epidemiological report of pandemic (H1N1) 2009 in the UK’, 2010.
4
Другие группы исследователей пришли к такому же выводу, например: WHO Ebola Response Team, ‘Ebola Virus Disease in West Africa – The First 9 Months of the Epidemic and Forward Projections’, The New England Journal of Medicine (NEJM), 2014.
5
‘Ransomware cyber-attack: Who has been hardest hit?’, BBC News Online, 15 May 2017; ‘What you need to know about the WannaCry Ransomware’, Symantec Blogs, 23 October 2017. Число попыток взлома за семь часов увеличилось с 2000 до 80 000; отсюда время удвоения = 7/log2(80000/2000) = 1,32 часа.
6
Media Metrics #6: The Video Revolution. The Progress & Freedom Foundation Blog, 2 March 2008. http://blog.pff.org/archives/2008/03/print/005037.html. Количество владельцев увеличилось с 2,2 % домохозяйств в 1981 году до 18 % в 1985 году; отсюда время удвоения = 365 × 4/log2(0,18/0,02) = 481 день.
7
Etymologia: influenza. Emerging Infectious Diseases 12(1): 179, 2006.
8
Александр Дюма, «Граф Монте-Кристо», глава 117.
9
Kucharski A.J. et al., ‘Using paired serology and surveillance data to quantify dengue transmission and control during a large outbreak in Fiji’, eLIFE, 2018.
10
Pastula D.M. et al., ‘Investigation of a Guillain-Barré syndrome cluster in the Republic of Fiji’, Journal of the Neurological Sciences, 2017; Musso D. et al., ‘Rapid spread of emerging Zika virus in the Pacific area’, Clinical Microbiology and Infection, 2014; Sejvar J.J. et al., ‘Population incidence of Guillain-Barré syndrome: a systematic review and meta-analysis’, Neuroepidemiology, 2011.
11
Willison H.J. et al., ‘Guillain-Barré syndrome’, The Lancet, 2016.
12
Kron J., ‘In a Remote Ugandan Lab, Encounters With the Zika Virus and Mosquitoes Decades Ago’, New York Times, 5 April 2016.
13
Amorim M. and Melo A.N., ‘Revisiting head circumference of Brazilian newborns in public and private maternity hospitals’, Arquivos de Neuro-Psiquiatria, 2017.
14
World Health Organization, ‘WHO statement on the first meeting of the International Health Regulations (2005) (IHR 2005) Emergency Committee on Zika virus and observed increase in neurological disorders and neonatal malformations’, 2016.
15
Rasmussen S.A. et al., ‘Zika Virus and Birth Defects – Reviewing the Evidence for Causality’, NEJM, 2016.
16
Rodrigues L.C., ‘Microcephaly and Zika virus infection’, The Lancet, 2016.
17
Если не указано иное, вся информация из Ross R., The Prevention of Malaria (New York, 1910); Ross R., Memoirs, With a Full Account of the Great Malaria Problem and its Solution (London, 1923).
18
Barnes J., The Beginnings Of The Cinema In England, 1894–1901: Volume 1: 1894–1896 (University of Exeter Press, 2015).
19
Joy D.A. et al., ‘Early origin and recent expansion of Plasmodium falciparum’, Science, 2003.
20
Mason-Bahr P., ‘The Jubilee of Sir Patrick Manson: A Tribute to his Work on the Malaria Problem’, Postgraduate Medical Journal, 1938.
21
To K.W.K. and Yuen K.-Y., ‘In memory of Patrick Manson, founding father of tropical medicine and the discovery of vectorborne infections’ Emerging Microbes and Infections, 2012.
22
Burton R., First Footsteps in East Africa (London, 1856).
23
Hsu E., ‘Reflections on the “discovery” of the antimalarial qinghao’, British Journal of Clinical Pharmacololgy, 2006.
24
Sallares R., Malaria and Rome: A History of Malaria in Ancient Italy (Oxford University Press, 2002).
25
Росс утверждал, что участники эксперимента знали, на что идут, и что риск был оправдан: «Думаю, что этот эксперимент оправдан тем огромным значением, которое имел бы положительный результат, а также тем обстоятельством, что в моем распоряжении всегда был хинин» (Ross, 1923). Тем не менее мы не знаем, насколько полно участники эксперимента были информированы о риске; хинин менее эффективен, чем препараты, используемые в современных исследованиях малярии. (Achan J. et al., ‘Quinine, an old anti-malarial drug in a modern world: role in the treatment of malaria’ Malaria Journal, 2011.) Более подробно этичность экспериментов на людях мы рассмотрим в главе 7.
26
Bhattacharya S. et al., ‘Ronald Ross: Known scientist, unknown man’, Science and Culture, 2010.
27
Chernin E., ‘Sir Ronald Ross vs. Sir Patrick Manson: A Matter of Libel’, Journal of the History of Medicine and Allied Sciences, 1988.
28
Manson-Bahr P., History Of The School Of Tropical Medicine In London, 1899–1949 (London, 1956).
29
Reiter P., ‘From Shakespeare to Defoe: Malaria in England in the Little Ice Age’, Emerging Infectious Diseases, 2000.
30
High R., ‘The Panama Canal – the American Canal Construction’, International Construction, October 2008.
31
Griffing S.M. et al., ‘A historical perspective on malaria control in Brazil’, Memórias do Instituto Oswaldo Cruz, 2015.
32
Jorland G. et al., Body Counts: Medical Quantification in Historical and Sociological Perspectives (McGill-Queen’s University Press, 2005).


