
Полная версия
Жизнь замечательных веществ
История полимерной химии также сообщает о ряде счастливых случайностей, первой из которых является история о Чарльзе Гудиере (Charles Goodyear), случайно смешавшем на горячей печи каучук и серу, получив продукт вулканизации (реакции серы с двойными связями в нитях каучука), который в наше время известен как резина или эбонит; также случайно был открыт и тефлон, но об этом мы поговорим немного позже.
Некоторые композитные материалы тоже были открыты благодаря счастливой случайности – одним из таких материалов был триплекс, который первоначально применялся для изготовления защитных очков. По легенде Эдуард Бенедиктус (Edouard Benedictus), пытаясь достать склянку реактива с верхней полки, смахнул с неё пузырек, содержащий раствор нитроцеллюлозы. Пузырек упал и треснул, но, как заметил Бенедиктус, сохранил свою форму – осколки стекла склеила нитроцеллюлоза. Бенедиктуса осенило, и через сутки, в течение которых исследователь не прерывался ни на отдых, ни на сон, были получены первые образцы небьющегося триплексного стекла, в которых два листа стекла были склеены полимером, не дающим осколкам разлетаться.
Где-где, а в химии лекарственных препаратов таки существует непаханое поле случайных открытий, сводящихся, например, к тому, что лекарство начинали использовать совсем не для того, для чего оно изначально предназначалось. Классикой жанра, естественно, является открытие виагры.
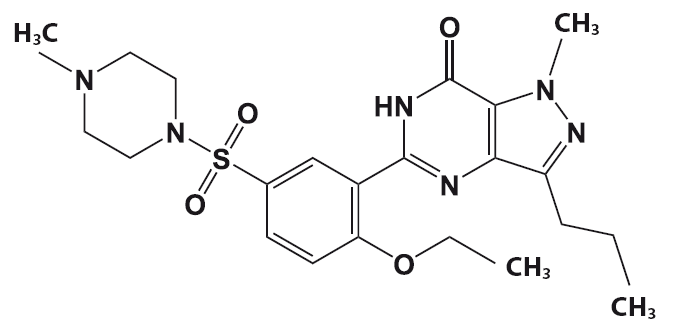
Силденафил – обладающий фармакологической активностью компонент «виагры».
История «виагры» началась в 1992 году в ходе фармакологических исследований фирмы «Пфайзер». Исследователи проводили клинические испытания нового лекарственного вещества – цитрата силденафила, который разрабатывался как средство для лечения ряда сердечных недугов.

Ученые рассчитывали на то, что цитрат силденафила будет способствовать увеличению притока крови к сердечной мышце и снижению артериального давления. Однако было отмечено, что цитрат силденафила не оказывает существенного влияния ни на кровообращение в сердечной мышце (миокарде), ни на артериальное давление. Параллельно обнаружилось, что многие пациенты мужского пола, которые участвовали в исследовании, отказываются возвращать таблетки силденафила, несмотря на окончание тестирования. Причина отказа у всех этих пациентов была одна – все они отметили у себя резкое улучшение качества эрекций. Таким образом, несмотря на минимальное влияние нового лекарства на кровообращение в миокарде, силденафил вызвал ощутимый приток крови к мужским половым органам. Исследователи фармакологической компании «Пфайзер» отнеслись к этому неожиданному свойству цитрата силденафила с должным вниманием и сумели распознать в нем мощное средство для борьбы с нарушениями эрекций. Новый препарат получил название «Виагра» – название родилось как бы в результате слияния слов «Vigor» (власть, энергия, сила) и Ниагара – самый мощный водопад в Северной Америке.
1. Вещества, которые принято считать «неживыми»
В начале XIX века Йёнс Якоб Берцелиус разделил существующую в те времена химию на «органическую», которую он и его последователи рассматривали как «химию живых организмов», и «неорганическую» – «химию неживого».
Хоте уже через 20 лет после такого размежевания Фридрих Вёлер (случайно, правда) показал, что границы между «химией живого» и «химией неживого» нет, а в 1850-х годах Эдуард Франкланд добавил третий раздел химии – «металлоорганическую», для большинства людей, представление которых о химии ограничивается курсом средней общеобразовательной школы, в памяти сохраняется это противостояние живого и неживого, ведь как иначе можно объяснить то, что на полном серьёзе появляется термин «органические продукты питания», ведь из того, что мы едим или пьём, «неорганическими» являются только поваренная соль и вода. Вместе с тем, как учит диалектика, противоположности не только борются друг с другом, но и находятся в единстве. Точно так же многие неорганические вещества важны для нормальной работы живых систем, а некоторые образуются в результате их жизнедеятельности, и, конечно же, каждое по-своему замечательно.
1.1. Соляная кислота

Подавляющая часть людей, отсидев на уроках химии в школе, сохраняет в памяти названия четырех кислот – азотной, серной, соляной и уксусной. При этом большинство если и догадываются, что уксусную кислоту мы можем найти на кухонной полке в виде раствора уксуса для консервирования или готовки, серную – в аккумуляторе автомобиля, то насчёт азотной и соляной кислот уж точно уверены, что с ними они попрощались, выйдя за ворота школы. Однако я гарантирую вам, что соляная кислота сопровождает вас с самого рождения и является неотъемлемой частью вашей жизни – она играет существенную роль в процессах, протекающих в организме.
Эта сильная кислота, водный раствор хлороводорода в воде, была известна очень давно. Ранние названия этого замечательного вещества были связаны с её запахом, который, как казалось алхимикам, связан с морской свежестью (из чего я делаю вывод, что либо они нюхали какое-то не то море, либо не обжигали хлороводородом слизистые носоглотки), а также с тем, что эту кислоту получали из морской (каменной, поваренной) соли. В алхимических трактатах хлороводород упоминается как «дух соли» или «соляной спирт» (spiritus salis), потом появился термин «муриевая кислота» (muria – рассол, соленая вода). Термином «muria» называлось особо едко-соленое ощущение. В одном из трактатов XVII века можно встретить разъяснение: «Muria – это едко-соленое».
Кстати, становление номенклатуры в России проходило через причудливые этапы, одним из которых была попытка пойти своим собственным путем и русифицировать все названия. Так, в одной из российских рукописей, относящихся к 1870 году, можно прочитать: «Водород хлорович взаимодействует с глиноземием с образованием глиноземия хлоровича». В 1870–1875 гг. в Петербургской академии наук обсуждалась возможность использования для названий химических веществ таких сочетаний слов, которые напоминали бы русские фамилии и отчества. Например, для воды Н2О предлагалось название «водород кислородович», для хлорида калия КСl – «калий хлорович» или «потассий хлорович», для хлороводорода НСl – «водород хлорович», для гипохлорита калия КСlO – «калий хлорович кислов», для хлората калия КСlO3 – «калий хлорович трёхкислов» и т. п. В приведенной цитате говорилось о взаимодействии алюминия («глиноземия») с раствором хлороводорода в воде – соляной кислотой HCI: 2Al + 6НСl = 2АlСl3 + ЗН2.
Точная дата первого получения соляной кислоты неизвестна. Алхимики могли получать смеси, содержащие соляную кислоту, практически с самого начала алхимических изысканий. Существует предположение, что первым соляную кислоту получил в начале IX века Джабир ибн Хайян – знаменитый арабский алхимик, врач, фармацевт, математик и астроном, которому также приписывается открытие мышьяка, сурьмы и висмута.
Естественно, соляная кислота в Cредневековье применялась при изготовлении царской водки (смеси соляной и азотной кислот). Известно, что чистый газообразный хлороводород был впервые получен Джозефом Пристли в 1772 году, а в 1818 году Хэмпфри Дэви успешно доказал, что полученный газ состоит из хлора и водорода.
Первоначально хлороводород, образующийся попутно при переработке каменной соли и получении соды, был отходом промышленного производства, просто стравливавшимся в воздух. Однако в середине XIX века такой подход и загрязнение окружающей среды стали рассматриваться как неприемлемое решение. К счастью, к тому же самому времени газообразный хлороводород стал применяться как ценный источник для производства соляной кислоты. Несмотря на то что подходы с тех времен значительно изменились, соляная кислота до сих пор получается как продукт утилизации отходов производства. Правда, сейчас большую часть соляной кислоты получают, утилизируя хлороводород, выделяющийся при хлорировании органических соединений.

При этом хлороводород очень часто применяют для получения хлорорганических соединений. Например, в результате присоединения хлороводорода к тройной связи ацетилена образуется хлорвинил, из которого с помощью полимеризации получают полихлорвинил (ПВХ) – материал, применяющийся для электроизоляции проводов и кабелей, производства листов, труб (преимущественно хлорированный поливинилхлорид), плёнок, плёнок для натяжных потолков, искусственных кож, поливинилхлоридного волокна, пенополивинилхлорида, линолеума, обувных пластикатов, мебельной кромки и т. д.

Поскольку хлороводород образуется в качестве побочного продукта производств органических соединений и используется в промышленном производстве органических соединений, чаще всего хлороводород эффективно получают и употребляют в рамках одного и того же производства, что выгоднее выделения отдельного производства хлороводорода и логистики по его доставке потребителю. Ещё одним способом масштабного промышленного применения раствора хлороводорода – соляной кислоты – является травление металлических поверхностей.
Хотя соляная кислота играет определенную роль в пищевой промышленности (корректировка кислотного уровня воды, применяющейся при приготовлении пищи), гораздо более существенную роль она играет в потреблении пищи. В нашем желудке содержится порядочное количество соляной кислоты, а рН желудочного сока может достигать единицы (это соответствует раствору с примерным содержанием кислоты 0,35 %).
Сильнокислая среда желудочного сока отчасти служит для защиты желудка от инфекций, но главная её роль – участие в пищеварении. Кислота способствует денатурации белков (примером такой денатурации, вызванной, правда, не химическим, а температурным воздействием, являются процессы, протекающие с куриным яйцом при варке или жарке), попадающих к нам в организм с пищей, они меняют форму, расплетаются и становятся более уязвимыми к действию пищеварительных ферментов, расщепляющих их на отдельные аминокислоты.
Наш желудок защищен от содержащейся в нем кислоты за счет слоя слизи, а специальный мускул – пилорическая створка (желудочный клапан) надежно удерживает соляную кислоту в желудке. Однако по каким-то причинам может произойти нарушение работы этого клапана, и желудочный сок попадает в пищевод, а соляная кислота этого желудочного сока вызывает чувство жжения, в ряде случае нарушение работы пилорической створки может привести к несварению желудка. В общем случае мы называем результат такой дисфункции просто – «повышенная кислотность».
Для лечения повышенной кислотности существует целый ряд препаратов со сложными названиями, однако в подавляющем большинстве это неорганические вещества, способные нейтрализовать кислоту. Ранее для понижения кислотности использовались карбонаты кальция, магния или натрия (до сих пор народным средством от изжоги является раствор соды), однако применение таких препаратов не совсем комфортно, а иногда может быть и опасно. Делов том, что при нейтрализации соляной кислоты карбонатом происходит образование слабой угольной кислоты, которая разлагается с выделением углекислого газа, в данном случае покидающего наше тело через не совсем приспособленный для этого пищевод. В результате этого понижение кислотности желудка карбонатными препаратами чревато в лучшем случае обильной отрыжкой, а если переборщить с содой, намудрив с народными рецептами, то можно доиграться и до перфорации пищевода. Выделения углекислого газа можно избежать, применяя антациды на основе смеси гидроксидов магния и алюминия (торговые марки: «Алмагель», «Алтацид», «Алюмаг», «Гастрацид», «Маалокс», «Маалукол» и «Палмагель»).
Используется ли соляная кислота для очистки заржавевшего металла, синтеза полихлорвинила или расщепления белков, она, как рабочая лошадка, просто делает свое дело. Конечно, мы можем обвинять соляную кислоту за дискомфорт в нашем желудке, вызванный перееданием, но не стоит во всем обвинять это замечательное вещество – переели вы, а не соляная кислота: она всего лишь играет свою роль в ежедневном переваривании пищи.
1.2. Мел или карбонат кальция
Хотя в школы сейчас и приходят всякие новшества вроде белых досок с маркерами или даже интерактивных досок, темная доска – черная, коричневая или зеленая – и мел до сих пор остаются главной атрибутикой учебного процесса.
Даже если кто-то, окончив школу, прекращает свой контакт с органами образования раз и навсегда, его руки не продолжают прикасаться к ближайшему родственнику мела: каждый раз, когда мы берем в руки яйцо, чтобы очистить его от скорлупы, мы касаемся известняка – формы карбоната кальция, придающей жесткость яичной скорлупе и раковинам моллюсков.

Многоликий карбонат калия существует (и известен) в виде различных форм. Формула этого соединения – CaCO3, оно представляет собой соль, в которой катион кальция связан ионной связью с карбонат-анионом. Это вещество достаточно распространено в природе, в качестве самостоятельного вещества оно образует два минерала – кальцит и арагонит, а также является основным компонентом таких минералов, как известняк, мел и мрамор. В состав последней троицы помимо карбоната кальция входит его «кузен» – карбонат магния MgCO3, а также оксиды металлов; именно оксиды переходных металлов придают мрамору характерную окраску – оксид трёхвалентного железа дает оттенки красного, а оксид трёхвалентного хрома – оттенки зелёного.
Что же касается школьных мелков, времена, когда они состояли практически из чистого мела, канули в Лету. Гарантированно, что в моем школьном детстве мы писали практически чистым мелом, в котором иногда попадались кусочки раковин, и мы любили испытывать нервы учителей, специально проводя таким кусочком раковины по доске. Современный формованный школьный мелок на 40 % состоит из собственно мела (карбоната кальция) и на 60 % из гипса (это родственник карбоната кальция – двухводный кристаллогидрат сульфата кальция – CaSO4×H2O), ну а добавление к нему пигментов органического или неорганического происхождения позволяет разнообразить белый цвет школьного мелка, придав ему окраску.
Большая часть известных в настоящее время скальных пород, содержащих карбонат кальция, имеет осадочное происхождение – они образовались из раковин и скелетов мертвых обитателей моря, уплотнявшихся в результате давления следующих слоёв осадочных пород. Мел и известняк представляют собой похожие друг на друга материалы, различие состоит лишь в том, что мел является менее компактным и по этой причине более мягким. Для формирования мрамора, кальцита и арагонита требуется большее время: исходным веществом является известняк или мел, которые под воздействием высоких давлений и температур (условий, обычных для геологического формирования минералов) перестраиваются в форму с более компактной и плотной кристаллической решеткой.
Био-, а точнее – зоогенные отложения карбоната кальция дали название целому геологическому периоду – меловому периоду (или Мелу). Этот период – последний период мезозойской эры, он продолжался 80 миллионов лет (145 миллионов лет – 65 миллионов лет назад) и наиболее известен «меловой катастрофой», в результате которой произошло массовое вымирание видов – вымерли многие голосеменные растения, водные рептилии, птерозавры, все динозавры (но уцелели птицы). Исчезли аммониты, многие брахиоподы, практически все белемниты. В уцелевших группах вымерло 30–50 % видов.
Одной из интересных форм минералов карбоната кальция является прозрачный кальцит, или исландский шпат. В 1669 году датский естествоиспытатель Расмус Бартолин описал странное свойство исландского шпата, известное в настоящее время как «двойное лучепреломление». Оно заключается в том, что если луч света падает перпендикулярно к поверхности кристалла, то на этой поверхности он расщепляется на два луча. Первый луч продолжает распространяться прямо и называется обыкновенным, второй же отклоняется в сторону, нарушая обычный закон преломления света, и называется необыкновенным, и, соответственно, глядя через кристалл кальцита, мы видим «удвоенное» изображение.
Двойное лучепреломление в кристаллах исландского шпата применялось и применяется на практике, например для дальномеров в бомбовых прицелах, однако естественно, что применение человечеством карбоната кальция началось очень давно.
Карбонат кальция в форме известняка и мрамора использовался с древних времен в качестве строительного материала. Несмотря на определенную мягкость известняка, человечество не отказывалось от его практического применения: так, великая пирамида Гизы, четыре тысячелетия остававшаяся самым высоким зданием в мире, построена примерно из двух с половиной миллионов блоков известняка.
Так, одним из первых примеров «ландшафтного дизайна» могут быть считающиеся доисторическими белые лошади британского графства Вилшир, которых получали, удаляя дерн и плодородный слой почвы, обнажая лежащий ниже слой мела.
Опять же с древности карбонат кальция породил ещё один строительный материал, правда, для этого потребовалось первое химическое производство. Со времен Древнего Египта зодчие знали, что прокаливание карбоната позволяет получить негашеную (или прокаленную) известь, основным компонентом которой является оксид кальция СаО. Негашеная известь используется в связующих строительных растворах и при изготовлении цемента – сама по себе или после обработки водой (гашеная известь или гидроксид кальция Ca(OH)2). Известны случаи применения негашеной извести при обороне замков – негашеная известь активно взаимодействует с водой, а поскольку кожа здорового человека всегда влажна (особенно если этот здоровый человек ползет по осадной лестнице на чужую крепостную стену), осажденные высыпали на осаждающих негашеную известь, вызывая у них ожоги кожи и органов зрения.
Также с древних времен карбонат кальция применяется для понижения кислотности почвы (это в том числе и тот самый рецепт садовода-любителя, коих в стране советов было миллионы: бросать в почву, на которой начал «колоситься» мох, скорлупу от яиц – мох растет на кислых почвах, а карбонат кальция, являясь солью слабой кислоты, реагирует со свободной кислотой почвы, связывая её).

С начала XX века карбонат кальция находит применение во многих промышленных производствах помимо строительной отрасли, например – целлюлозно-бумажной для производства высококачественной мелованной бумаги. Карбонат кальция используется в качестве наполнителя, придающего дополнительную прочность полимерным материалам, его использовали в хлебопекарном производстве (для увеличения потребления кальция). В наши дни карбонат кальция применяется в пищевой промышленности как белый пищевой краситель (E170). Карбонат кальция применялся и применяется в зубных порошках и зубных пастах, правда, для этой цели применяют не «органический» мел, образовавшийся из останков вымерших видов животных, а синтетический – для гигиены полости рта карбонат кальция получают, пропуская углекислый газ через гашеную известь: Ca(OH)2 + CO2 = CaCO3 + H2O. Причиной такого подхода является то, что в природном (или как это принято говорить сейчас – натуральном) карбонате кальция содержатся окаменелости организмов, не переживших меловую катастрофу, и те самые кусочки раковин, которые, испытывая нервы наших учителей, скрипели на доске, оставляя на ней царапины, точно также могут повреждать эмаль зубов.
К сожалению, то, что карбонат кальция реагирует с кислотами, в настоящее время стало целой проблемой для сохранения архитектурного и художественного наследия: здания и скульптуры и различных форм карбоната кальция, в особенности из менее плотного известняка (хотя и мрамора эта проблема касается, пусть он и разрушается с меньшей скоростью), повреждаются из-за эрозии, причиной которой являются кислотные дожди.
Ни одно вещество не внесло такой вклад в культуру человечества (и продолжает вносить его до наших дней), как карбонат кальция. Мы можем проследить его путь в человеческой цивилизации от первых наскальных рисунков на стенах пещеры мелом, пирамид и до школьной доски и зданий из стекла и бетона. И, зная, как человеческая цивилизация обязана карбонату кальция, мы не ошибемся, если скажем, что человеческая цивилизация выросла на костях – костях огромного количества вымерших в конце мелового периода организмов.
1.3. Карбонат лития
Ещё со школы я и мои ровесники усвоили, что литий и его соли окрашивают пламя в карминово-красный цвет, хотя в школе я с трудом представлял, что это за цвет – «карминово-красный», и уже совсем не представлял, что при желании препарат одного из активных щелочных металлов можно купить в обычной аптеке, чтобы посмотреть на этот цвет своими глазами. Литий тогда казался химической экзотикой, смотрящей на нас с олимпиадных задачников, и мы, участники олимпиад, не представляли, что он ближе, чем кажется, и мы имеем шансы пересечься с его соединениями, среди которых наиболее часто можно встретить карбонат лития Li2CO3.
Но начнем с цвета. Пожалуй, наиболее частым примером из реальной жизни, связанным с применением характерной окраски пламени солями лития, является случай, произошедший в молодости с американским физиком Робертом Вудом. Осенью 1891 года Вуд приехал в Университет Джона Гопкинса, намереваясь получить там степень доктора философии по химии. В университетском пансионе, где он жил, уже давно ходило страшное подозрение, что утреннее жаркое приготовляется из остатков вчерашнего обеда, собранных с тарелок. Так, если во вторник на обед подавался бифштекс, то в среду на завтрак подавалось жаркое. Но как доказать такое обвинение? Вуд немного подумал, почесал в затылке и сказал: «Я думаю, что мне удастся это доказать при помощи бунзеновской горелки и спектроскопа».
Вуд знал, что хлорид лития – совершенно безопасное вещество, похожее на обыкновенную поваренную соль, а также что спектроскоп дает возможность открыть мельчайшие следы лития в любом материале, если его сжечь в бесцветном пламени – ионы лития дают хорошо известную красную спектральную линию или же карминово-красное окрашивание.
Когда студентам на обед был подан бифштекс, Вуд на своей тарелке оставил несколько больших обрезков мяса, посыпанных хлоридом лития. На следующее утро кусочки завтрака были спрятаны в карман, отнесены в лабораторию и сожжены перед щелью спектроскопа, а появившаяся красная линия лития полностью подтвердила страшную догадку студентов и аспирантов.
Вернемся же к карбонату лития. В отличие от карбонатов других щелочных металлов (соды – карбоната натрия и поташа – карбоната калия) карбонат лития плохо растворим в воде и поэтому теоретически может накапливаться в природе в виде минерала. Минерал, основным компонентом которого является карбонат лития – забуелит, был обнаружен в 1987 году у озера Забуйе в Тибете, однако это скорее исключение: карбонат лития практически не встречается в природе.
К счастью, низкая растворимость карбоната лития облегчает его получение из растворимых солей лития, обычно того самого хлорида лития, который, в свою очередь, можно выделить из месторождений поваренной соли (ну любят хлориды щелочных металлов залегать в природе совместно – свойства у них общие). Особенно богаты хлоридом лития некоторые минеральные источники Южной Америки – Чили и Аргентины. Карбонат лития был впервые получен шведским химиком Йоханом Августом Арфведсоном (Johan August Arfwedson) в 1817 году вместе с другими соединениями лития.









