
Полная версия
Инсульт. Нарушение мозгового кровообращения
Почечный механизм проявляет активность в узком диапазоне – от 100 до 65 мм рт. ст. В основном включается при острой гипотензии.
ЮГА выделяет ренин, который в норме на 80 % находится в неактивном состоянии (проренин). Ренин является протеолитическим ферментом – аспартилпротеазой. Допускается, что активизация проренина осуществляется почечным калликреином. Поврежденные почки, в отличие от здоровых, секретируют преимущественно активный ренин, но повреждение не влияет на выделение проренина.
Ренин взаимодействует с плазменным белком П2-глобулином (тетрадекапептидом), называемым субстратом ренина или ангиотензиногеном. В результате образуется ангиотензин I (декапептид).
Ангиотензин I под влиянием ангиотензинконвертирующего фермента (АКФ) превращается в ангиотензин II. АКФ является дипептидилкарбоксипептидазой, отщепляющей с С-концевого участка молекулы ангиотензина I 2 аминокислотных остатка. Дигидропептидилкарбоксипептидаза выполняет 2 функции:
1) функцию АКФ;
2) функцию кининазы II – инактивацию брадикинина в результате отщепления с С-конца двух аминокислотных остатков.
Кроме того, АКФ участвует в метаболизме атриопептина, субстанции Р, энкефалинов, t– цепи инсулина, t-липотропина, рилизинг фактора лютенизирующего гормона.
АПФ (дипептидилкарбоксипептидаза) идентична кининазе II, вызывающей разрушение брадикинина.
В соматической форме АКФ имеются 2 активных центра, гомологичных домена: в N– участке, C-участке молекулы фермента. Каталитическая активность и химическая структура N и C доменов неодинаковы. C-домен катализирует расщепление ангиотензина I и брадикинина, тогда как N-домен расщепляет преимущественно рилизинг-гормон лютеинизирующего гормона.
Ингибиторы АКФ различаются по силе и избирательности связывания с активными центрами в молекуле соматической формы АКФ: каптоприл имеет сродство с N-доменом, лизиноприл – с C-доменом, трандолаприл – с обоими.
В микрососудах АПФ располагается на мембранах клеток. Этот фермент находится в адвентиции крупных сосудов в связи с vasa vasorum. Циркулирующие молекулы АПФ попадают в кровь, отделяясь от тканевых гликопротеидов. Важнейшая роль легких в превращении А! в АП обусловлена богатой их васкуляризацией и тем, что вне легких АП не подвергается инактивации.
Физиологические эффекты А-II, опосредованные АТ1 и АТ2 рецепторами – ангиотензиновыми рецепторами первого и второго типов
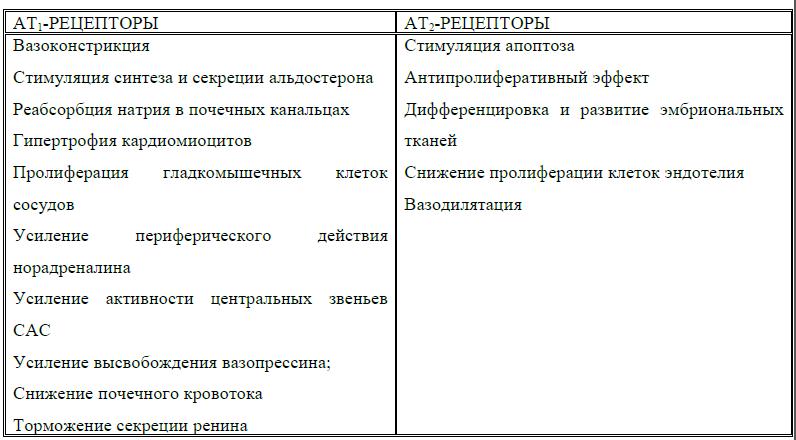
Все известные физиологические сердечно-сосудистые и нейроэндокринные эффекты. А II опосредованы АТ1-рецепторами. Все они способствуют повышению АД, развитиюгипертрофии левого желудочка, утолщению стенок артериол, что способствует уменьшению их просвета. Эффекты АН, которые опосредуются АТ2 рецепторами, – вазодилятация и торможение пролиферации клеток, в том числе кардиомиоцитов, гладкомышечных клеток. Таким образом, через АТ2-рецепторы АТП частично ослабляет свои эффекты.
АТ1-рецепторы на мембранах гепатоцитов и клетках ЮГА почек опосредуют механизмы обратной отрицательной связи в ренин-ангиотензиновой системе. Поэтому в условиях блокады АТ1-рецепторов в результате нарушения этих механизмов обратной отрицательной связи увеличивается синтез ангиотензиногена печенью и секреция ренина клетками ЮГА. То есть при блокаде АТ1-рецепторов происходит реактивная активация ренин-ангиотензиновой системы, которая проявляется повышением уровня ангиотензиногена, ренина, АТ-I и АТ-II. Повышение образования АТ-II в условиях блокады АТ1-рецепторов приводит к тому, что преобладают эффекты стимуляции АТ:-рецепторов.
Третий механизм антигипертензивного действия блокаторов АТ1-рецепторов объясняется повышением образования ангиотензина (I-7), обладающего вазодилятирующими свойствами, – он образуется из А-I под действием нейтральной эндопептидазы или из А-II под действием пролиловой эндопептидазы. АТ (I-7) обладает, пaомимо вазодилятирующего, натрийуретическим свойствами, которые опосредуются простагландинами, простацилинами, кининами, эндотелиальным релаксирующим фактором. Эти эффекты обусловлены воздействием на АТх.
Влияние АТ-II на функцию и структуру клетки

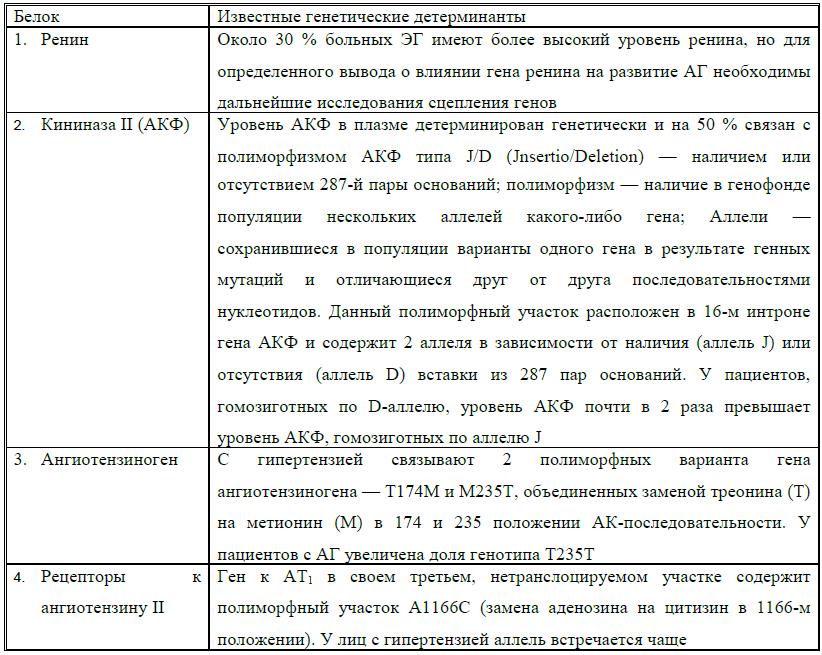
Белки РААС и их генетические детерминанты
Интегральная система регуляции АД включает:
1) цепь почки – кора надпочечников (альдостерон) – консервация ионов натрия – жидкая среда организма;
2) депрессорные механизмы, сосредоточенные в мозговом слое почек и стенках резистивных сосудов.
Помимо циркулирующей в крови (эндокринной системы), имеются местные системы ренин – AII, оказывающие аутокринные («на себя») и паракринные («на соседние клетки») влияния, изменяющие локальные тканевые функции.
Между почечной (эндокринной) и местными (аутокринной и паракринной) системами нет четкой связи. Локальные системы способны оказывать длительное воздействие на резистивные сосуды, регулируя их проходимость. Тканевые системы в большей степени участвуют в осуществлении противогипертензивного эффекта. Ингибиторы АПФ тормозят образование АП на месте и вызывают обратное развитие гипертрофии гладкомышечных клеток и поперечно-полосатой мускулатуры миокарда.
Воздействие А11 на баланс натрия и жидкой среды организма – важнейшая функция интегрирующей, длительно действующей системы регуляции. Усиление реабсорбции натрия обеспечивается двумя механизмами:
1) непосредственным воздействием А II на почечные канальцы;
2) опосредованным усилением секреции альдостерона клетками клубочкового слоя коры надпочечников.
Системы регуляции АД

Данные системы не антагонистичны в функциональном плане.
Выявлены значительные гетерогенность и разнонаправленность действия различных типов α– и β-АР. В пределах системы простагландинов имеются как вазоконстрикторные (простагландины ПГ-F2α, ТХ-А2), так и вазодилятаторные субстанции.
Эндотелиальные системы состоят из прессорных компонентов (эндотелинов) и депрессорных. При ЭГ взаимодействие прессорной и депрессорной систем рассогласовано. Вначале, при лабильной гипертензии, повышается активность как прессорных, так и депрессорных систем с преобладанием первых, далее активность и тех и других систем снижается – прессорных до нормы, а депрессорных ниже нормы (этим центрогенная теория объясняет феномен стабилизации гипертензии).
Механизм «давление – натрийгидроурез» в норме является депрессорным, в условиях патологии способствует стабилизации АГ.
Имеется связь между потреблением поваренной соли и артериальной гипертензией. Но между количеством потребляемой поваренной соли и высотой АД имеется лишь слабая корреляция.
У крыс линии SHR резко усилен солевой аппетит, что может быть подавлено блокадой ренин-ангиотензиновой системы. Можно предположить и вторичное увеличение потребления соли в условиях гипертензии и высокой активности А-II.
При высоком артериальном давлении увеличивается натрийурез и гидроурез (при повышении АД от 100 до 150 мм рт. ст. натрий-, гидроурез увеличивается в 3 раза). Этот механизм есть следствие изменения канальцевой реабсорбции в тубулярных сегментах почечной медуллы и сохраняется на изолированной почке. Решающую роль играет интерстициальное гидростатическое давление.
Механизм «давление – натрийгидроурез» при ЭГ
Нормальное функционирование этого механизма возможно лишь в том случае, если причины, вызывающие изменение АД, одновременно не повреждают базисных внутрипочечных механизмов. При нарушении этого условия для удаления с мочой равновеликого (у здоровых людей) количества натрия и воды требуется более высокое АД, следовательно, происходит становление гипертензии (переключение почек на более высокий уровень регуляции).
В результате переключения почек происходит задержка натрия и воды. Вначале имеется недостаточное расширение артериол при высоком МОС, но оно относительно. Позже (в эксперименте с форсированным введением жидкости – на второй неделе) АГ зависит от абсолютного повышения ОПС. Этот эффект опосредован эндогенным гликозидом – оаубаином, выделяемым в условиях гипергидратации нейронами гипоталамуса и ингибирующего Na+/К+ АТФазу у мембран гладко-мышечных клеток резистивных сосудов – накопление в миоплазме ионов кальция и более интенсивное сокращение мышечных клеток с сужением просвета артериол и прекапилляров.
Теории патогенеза ЭГ
Можно выделить 3 наиболее распространенные теории:
1) центрогенную;
2) мембранную;
3) «мозаичную».
Центрогенно-нервная теория патогенеза ЭГ
С точки зрения Г. Ф. Ланга, ЭГ есть следствие психического перенапряжения человека, воздействия на его психическую сферу эмоций отрицательного характера, психотравматизации.
В эксперименте повышение норадреналина было обнаружено лишь у части молодых людей с лабильной и пограничной артериальной гипертензией. У больных в возрасте 40–60 лет концентрация норадреналина не отклоняется от нормы. Таким образом, нет оснований полагать наличие прямой связи между тонусом симпатической системы и артериальным давлением.
Первопричины, пускающие в ход цепную реакцию патогенеза, со временем у большинства больных сходят на нет («мавр сделал свое дело»). АД по-прежнему поддерживается на высоком уровне, но за счет других самовоспроизводящихся механизмов.
Конец ознакомительного фрагмента.
Текст предоставлен ООО «ЛитРес».
Прочитайте эту книгу целиком, купив полную легальную версию на ЛитРес.
Безопасно оплатить книгу можно банковской картой Visa, MasterCard, Maestro, со счета мобильного телефона, с платежного терминала, в салоне МТС или Связной, через PayPal, WebMoney, Яндекс.Деньги, QIWI Кошелек, бонусными картами или другим удобным Вам способом.









