
Полная версия
Теоретические основы и практическое применение методов иммуногистохимии
Теоретические основы и практическое применение методов иммуногистохимии
Коржевский Дмитрий Эдуардович – доктор медицинских наук, заведующий лабораторией функциональной морфологии центральной и периферической нервной системы отдела общей и частной морфологии ФГБУ «НИИЭМ» СЗО РАМН;
Кирик Ольга Викторовна – кандидат биологических наук, старший научный сотрудник лаборатории функциональной морфологии центральной и периферической нервной системы отдела общей и частной морфологии ФГБУ «НИИЭМ» СЗО РАМН;
Петрова Елена Сергеевна – кандидат биологических наук, старший научный сотрудник лаборатории функциональной морфологии центральной и периферической нервной системы отдела общей и частной морфологии ФГБУ «НИИЭМ» СЗО РАМН;
Карпенко Марина Николаевна – кандидат биологических наук, научный сотрудник лаборатории нейробиологии интегративных функций мозга физиологического отдела им. И. П. Павлова ФГБУ «НИИЭМ» СЗО РАМН;
Григорьев Игорь Павлович – кандидат биологических наук, старший научный сотрудник лаборатории функциональной морфологии центральной и периферической нервной системы отдела общей и частной морфологии ФГБУ «НИИЭМ» СЗО РАМН;
Сухорукова Елена Геннадьевна – старший научный сотрудник лаборатории функциональной морфологии центральной и периферической нервной системы отдела общей и частной морфологии ФГБУ «НИИЭМ» СЗО РАМН;
Колос Елена Андреевна – младший научный сотрудник лаборатории функциональной морфологии центральной и периферической нервной системы отдела общей и частной морфологии ФГБУ «НИИЭМ» СЗО РАМН;
Гиляров Александр Владимирович – кандидат медицинских наук
УСЛОВНЫЕ СОКРАЩЕНИЯ
БТIII – бета-тубулин III
ГАМК – γ-аминомасляная кислота
ГЭБ – гематоэнцефалический барьер
ДААК – декарбоксилаза L-ароматических аминокислот
ИГХ – иммуногистохимия
мРНК – матричная рибонуклеиновая кислота
МТ – микротрубочка
НСК – нейральные стволовые клетки
ПФ – промежуточный филамент
ЦНС – центральная нервная система
ABC-метод – avidin and biotinylated horseradish peroxidase macro-molecular сomplex
AEC – 3-амино-9-этилкарбазол
AIF-1 – allograft inflammatory factor-1
AP – щелочная фосфатаза
APAAP – «щелочная фосфатаза – антищелочная фосфатаза»
AS-MX – нафтол АС-Микс фосфат
BSA – бычий сывороточный альбумин
CAM – молекула клеточной адгезии
CDK – циклин-зависимая киназа
CN – 4-хлор-1-нафтол
CNP – 2′,3′-циклический нуклеотид 3′-фосфодиэстеразы
DAB – 3,3′-диаминобензидина
DCX – даблкортин
EDTA – этилендиаминтетрауксусная кислота
ENO1 – ненейрональная енолаза (α)
ENO2 – нейронспецифическая енолаза (γ)
ENO3 – мышечная енолаза (β)
FITC – флуоресцеина изотиоцианат
GAD – глутаматдекарбоксилаза
GFAP – глиальный фибриллярный кислый белок
HRP – пероксидаза хрена
LAB – авидин-биотиновая методика
LSAB – стрептавидин-биотиновая методика
L-ДОФА – L-3,4-диоксифенилаланин
MAG – миелин-ассоциированный гликопротеин
МАР2 – микротубулин-ассоциированный протеин 2
MBP – основной белок миелина
MOBP – основной белок олигодендроцитов, связанный с миелином
MOG – миелиновый гликопротеин олигодендроцитов
MRF-1 – microglia response factor
NCAM – нейрональная молекула клеточной адгезии
NF-H – высокомолекулярные белки нейрофиламентов
NF-L – низкомолекулярные белки нейрофиламентов
NF-M – среднемолекулярные белки нейрофиламентов
NSE – нейронспецифическая енолаза
OSP – олигодендроцит-специфический белок
PAP – пероксидаза-антипероксидазный метод
PBS – фосфатно-солевой буфер
PCNA – ядерный антиген пролиферирующих клеток
PGP – протеиновые генные продукты
PI – пропидий иодид
PKA – сАМР-зависимая протеинкиназа
PLP – протеолипидный белок
PRD – домен, богатый пролином
PSA – полисиаловая кислота
TBS – трис-солевой буфер
TRITC – тетраметилродамин изотиоцианат
ПРЕДИСЛОВИЕ
В последние годы методы иммуногистохимии заняли одно из главных мест среди методов морфологической диагностики. Неудивительно, что научная и методическая литература, посвященная их применению, привлекает пристальное внимание научных работников и специалистов практического здравоохранения. С сожалением приходится констатировать, что в настоящее время подобная литература отсутствует на прилавках отечественных книжных магазинов. Из наиболее важных руководств, изданных на русском языке после 1990 г., в которых определенное место отведено вопросам применения методов иммуногистохимии, следует отметить «Микроскопическую технику» (под ред. Д. С. Саркисова и Ю. Л. Перова. – М.: Медицина, 1996), «Молекулярную клиническую диагностику» (под ред. С. Херрингтона и Дж. Макги. – М.: Мир, 1999) и фундаментальный обзор иммуноцитохимических методов М. В. Угрюмова (Итоги науки и техники. Серия «Морфология человека и животных». – Т. 15. – М.: ВИНИТИ, 1991). Перечисленные книги давно стали библиографической редкостью. Кроме того, следует признать, что они не включают информацию о некоторых современных методических приемах, получивших широкое распространение в последние годы (например, о способах теплового демаскирования антигенов). Все вышеперечисленное и побудило авторов к написанию данного краткого руководства.
Отличительной особенностью данного руководства является сочетание необходимых сведений о теоретических основах методов иммуногистохимии с примерами их практического использования на основе оригинальных и усовершенствованных авторами протоколов обработки препаратов, помещенных в приложении. Поскольку в круг интересов авторов входит изучение органов нервной системы, книга дополнена теоретическими сведениями и практическими рекомендациями по использованию важнейших нейрональных и глиальных маркеров дифференциации, что, несомненно, будет полезным как для нейроморфологов, так и для нейрофизиологов.
Настоящее руководство отражает современный уровень развития иммуногистохимии как науки и аккумулирует многолетний опыт сотрудников лаборатории функциональной морфологии центральной и периферической нервной системы отдела общей и частной морфологии НИИ экспериментальной медицины СЗО РАМН, связанный с использованием методов иммуногистохимии.
Д. Э. КоржевскийПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
Первое издание этой книги вышло не так давно, но уже появилась необходимость выпустить исправленное и дополненное второе издание. Наибольшие изменения претерпели пятая и шестая главы, где описываются методы демаскирования антигенов и изложены практические приемы, используемые при постановке иммуногистохимических реакций. В шестой главе появился и новый раздел «Организация работы иммуногистохимической лаборатории». Внесено существенное добавление в главу 10 – раздел, посвященный важному нейрональному маркеру – белку PGP 9.5. Протокол обработки препаратов для постановки реакции на белок PGP 9.5 добавлен в приложение 5. Обновлен состав авторского коллектива, принимавшего участие в работе над текстами, вошедшими в состав руководства.
Авторы надеются, что внесенные изменения и дополнения увеличили информативность второго издания руководства, которое адресовано работникам практического здравоохранения и научным сотрудникам, использующим методы иммуногистохимического исследования в своей повседневной деятельности.
Д. Э. КоржевскийГлава 1.
ИММУНОГИСТОХИМИЯ – СОВРЕМЕННЫЙ МЕТОД МОРФОЛОГИЧЕСКОЙ ДИАГНОСТИКИ
Термин «иммуногистохимия» образован из трех составляющих, указывающих на три медико-биологические дисциплины, – иммунологию, гистологию и химию, которые послужили основой для этого нового научного направления. Иммуногистохимия (ИГХ), или иммуноцитохимия (ИЦХ), – это область биологической и медицинской науки, теоретическое обоснование, разработка и практическое применение современных методов гистологического исследования и микроскопической диагностики, базирующихся на использовании реакции «антиген – антитело» для селективного выявления белков (и других молекул, обладающих антигенными свойствами) в гистологических срезах и цитологических препаратах.
Понятия «иммуногистохимия» и «иммуноцитохимия», по существу, должны считаться синонимами. Однако на практике нередко под иммуногистохимическими подразумевают методы, используемые для определения искомых антигенов в тканевых срезах, тогда как реакции с антигенами, выявляемыми в цитологических препаратах, называют иммуноцитохимическими. Следует заметить, что принципиальных различий в теоретических основах и практическом применении этих методов нет. В дальнейшем в настоящей книге будет использоваться термин «иммуногистохимия» и только в тех случаях, когда это будет необходимо в соответствии с контекстом, – «иммуноцитохимия».
Современные методы иммуногистохимии и иммуноцитохимии разработаны на основе достижений иммунологии и молекулярной биологии и совершенствуются в соответствии с потребностями патогистологической диагностики, сохраняя свое значение важного инструмента научных исследований. Первые методы окраски гистологического препарата основывались на избирательном связывании красителей с компонентами клетки. Особую область гистологической техники составили методы импрегнации биологических объектов солями металлов. До середины ХХ века при разработке новых методов окраски часто использовался эмпирический подход. Быстрое развитие биохимии позволило создать ряд селективных методов выявления различных внутриклеточных субстанций и компонентов межклеточного вещества. В связи с достаточно понятными механизмами взаимодействия участвующих при их постановке реакций химических веществ эти методики получили название «гистохимические реакции». Однако гистохимические методы, как правило, не позволяют точно определять конкретные вещества, не всегда обладают высокой чувствительностью и нередко требуют специальных методов обработки материала, усложняющих гистологическое исследование. Таким образом, несовершенство существующих методик окраски закономерно привело к созданию нового направления науки, которое получило название «иммуногистохимия». Первые иммуногистохимические методы не отличались высокой чувствительностью, но благодаря высокой специфичности сразу стали использоваться в диагностических целях.
В настоящее время основными задачами иммуногистохимии можно считать разработку и теоретическое обоснование новых методов молекулярного анализа внутриклеточных структур, изучение продуктов экспрессии генов, изучение пролиферации и гибели клеток, гистотипирование опухолей (часть молекулярной и клеточной диагностики) и методическое обеспечение иммуноморфологии – области гистологии, в которой используются иммуногистохимические методы для изучения тканевой организации, развития тканей и клеточной дифференциации.
Основателем нового направления в науке и диагностике и автором первых методов иммуноцитохимии по праву считают американского врача-патолога и иммунолога Альберта Хьюитта Кунса (1912 – 1978). Под его руководством в 1941 г. были впервые получены меченные флюорохромом антитела, которые были успешно применены в диагностических целях на замороженных срезах (Coons A. H. [et al.], 1941; 1942; 1950). Визуализация результатов реакции производилась во флуоресцентном микроскопе. Однако сначала метод не получил широкого распространения из-за трудности получения антител, сложности их визуализации и низкой воспроизводимости результатов. В последующем методы визуализации комплекса «антиген – антитело» совершенствовались, увеличивались их чувствительность и воспроизводимость. Параллельно с этим разрабатывались новые методы очистки первичных антител, которые повышали специфичность иммуногистохимических реакций. С появлением новой технологии получения моноклональных антител (Köhler G. [et al.], 1975) иммуногистохимические методы получили широкое распространение в патогистологической диагностике в онкологии, поскольку наряду с высокой специфичностью и хорошей воспроизводимостью они обладают большей доступностью для стандартизации, без которой не может существовать ни один диагностический тест.
В нашей стране в настоящее время иммуногистохимические методы достаточно широко используются при патогистологической диагностике онкологических заболеваний (Петров С. В. [и др.], 2004). Морфологические диагностические подходы, основанные на использовании методов иммуногистохимии постепенно внедряются и в судебно-медицинской экспертизе (Коржевская В. Ф. [и др.], 2011).
Литература
Коржевская В. Ф., Сухорукова Е. Г., Кирик О. В. [и др.]. Особенности судебно-гистологического исследования головного мозга при смерти от тупой травмы головы. – СПб.: Изд-во СПбМАПО, 2011. – 35 с.
Петров С. В., Райхлин Н. Т. Руководство по иммуногистохимической диагностике опухолей человека. – Казань, 2004. – 456 с.
Coons A. H., Creech H. J., Jones R. N. Immunological properties of an antibody containing a fluorescent group // Proc. Soc. Exp. Biol. Med. – 1941. – Vol. 47. – P. 200–202.
Coons A. H., Creech H. J., Jones R. N. [et al.]. The demonstration of pneumococcal antigen in tissues by use of fluorescent antibody // J. Immunol. – 1942. – Vol. 45. – P. 159–170.
Coons A. H., Kaplan M. H. Localisation of antigen in tissue cells // J. Exp. Biol. Med. – 1950. – Vol. 91, № 1. – P. 1–13.
Köhler G., Milstein С. Continuous cultures of fused cells producing antibody of pre-defined specificity // Nature. – 1975. – Vol. 256, № 5517. – P. 495–497.
Глава 2.
ПЕРВИЧНЫЕ АНТИТЕЛА
2.1. Антитела – компоненты сыворотки крови
Антитела – это растворимые гликопротеины глобулиновой фракции сыворотки крови и других биологических жидкостей, образующиеся в ответ на введение или проникновение антигена (чужеродных веществ, в том числе бактерий, вирусов, токсинов) в организм теплокровных животных (Ройт А. [и др.], 2000). На сегодняшний день антитела являются наиболее важными реагентами для использования в фундаментальных и прикладных исследованиях, что обусловлено их способностью к высокоспецифическому связыванию с антигеном, вызвавшим их образование.
Применяя определенные методические приемы, можно добиться образования антител к практически неограниченному набору антигенов. Однако стоит отметить, что стоимость коммерческих антител и затраты на их получение в условиях лаборатории могут различаться в десятки раз в зависимости от требуемой чистоты, специфичности и области применения, поэтому еще на этапе планирования исследования стоит уделить особое внимание правильному подбору антител. В этом может помочь и данное руководство.
2.2. Строение антител
Классические антитела представляют собой крупные мультимерные белки. Основная четырехцепочечная структурная единица иммуноглобулинов образована полипептидными цепями двух разных типов. Меньшие по размеру цепи (легкие L-цепи) имеют молекулярную массу около 25 кДа и состоят из вариабельного VL- и константного СL-доменов. Более крупные (тяжелые H-цепи) имеют молекулярную массу 50 – 80 кДа, состоят из вариабельного VH-, трех константных СН1-, СН2-, СН3-доменов и шарнирного участка (hinge region). Полипептидные цепи удерживаются вместе ковалентными (дисульфидными) и нековалентными связями (Ройт А. [и др.], 2000). Схематически «типичная» структура антитела представлена на рис. 1.
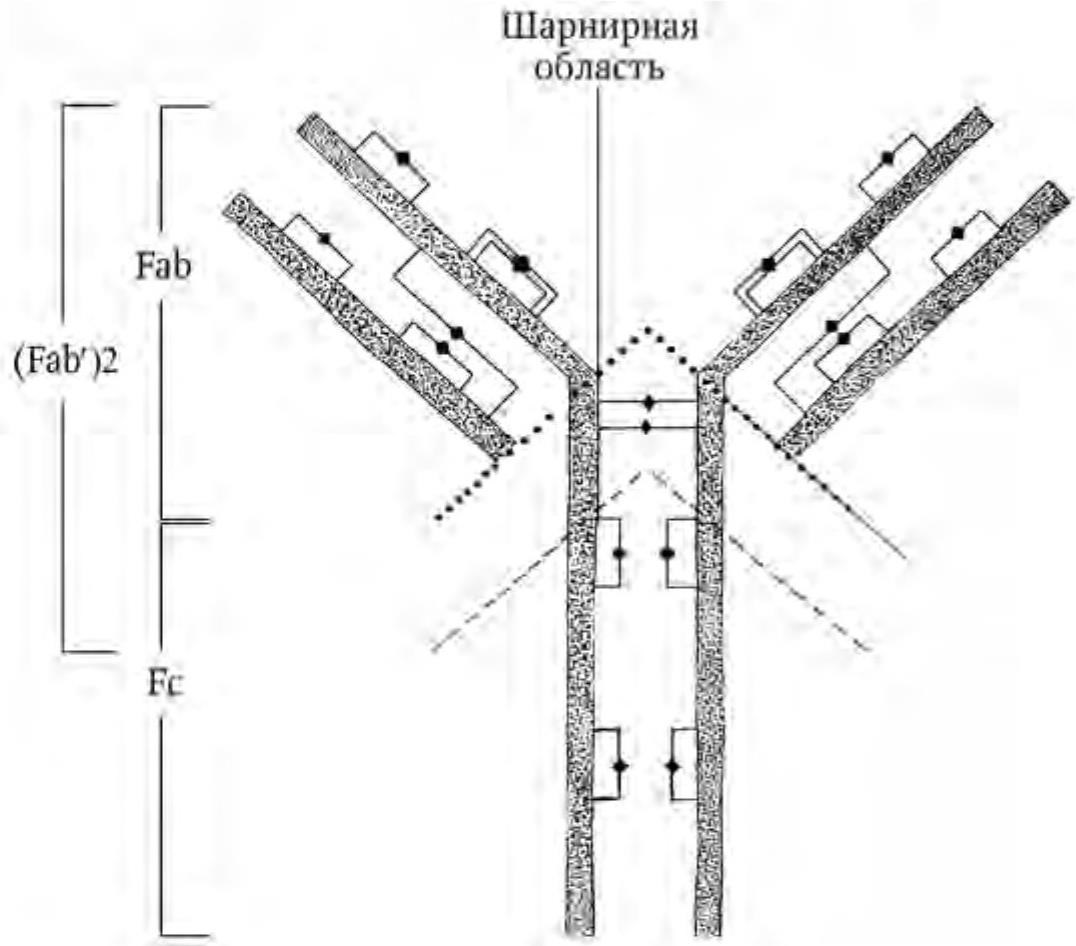
Рис. 1. Структура кроличьего иммуноглобулина IgG. Тяжелые и легкие цепи образуют вариабельный и константный домены, которые соединены дисульфидными мостиками (♦). При помощи папаина (цистеиновой эндопротеазы) протеолиз разделяет молекулу, в результате чего образуются два антигенсвязывающих фрагмента (Fab) и один кристаллизующийся фрагмент (Fc). Под действием пепсина (аспартатной кислой эндопептидазы) происходит отщепление двухвалентного антигенсвязывающего фрагмента (Fab′)2 (по: Boenisch T., 2001; с изменениями)
В зависимости от размера, заряда, аминокислотной последовательности и содержания углеводов в составе тяжелой цепи различают пять изотипов (классов) антител: IgM, IgG, IgA, IgE и IgD. Класс IgG подразделяется на четыре подкласса (IgG1, IgG2, IgG3, IgG4), которые различаются по антигенной структуре и спектру биологических функций (Burton D. R. [et al.], 1996). IgG – это наиболее широко представленный класс иммуноглобулинов, на его долю приходится 70 – 75 % их общего количества. Класс IgA разделяют на два подкласса (IgA1, IgA2). Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех теплокровных. Кроме того, IgM является пентамером, т. е. пять молекул соединяются между собой, а IgA – димером.
При помощи папаина антитела можно расщепить на два одинаковых антигенсвязывающих Fab-фрагмента (fragment antigen binding) и Fc-фрагмент (fragment cristalizable), способный к кристаллизации. Область Fab образована гипервариабельными участками Ни L-цепей и определяет антигенную специфичность; Fc-фрагмент осуществляет эффекторные функции (связывание иммуноглобулина с клетками, компонентами комплемента) (Atassi M. Z., 1984). К Fc-фрагменту антител можно присоединять различные вещества, что используется при постановке иммунохимических реакций.
В 1993 г. группой бельгийских ученых было сделано важное открытие: кроме классических антител в крови некоторых животных (верблюдов, лам и др.) обнаруживаются особые, неканонические антитела с упрощенной структурой. Они состоят из димера укороченной (без CH1-домена) тяжелой цепи; легкая цепь отсутствует, т. е. антигенузнающий участок формируется лишь вариабельными доменами тяжелых цепей. Такие антитела принято называть однодоменными антителами, или мини-антителами. Благодаря малым размерам (молекулярная масса однодоменных антител составляет примерно 12 – 15 кДа) и компактности антигенсвязывающего участка, можно получить мини-антитела, способные узнавать участки антигенов, недоступные для классических антител, в этом состоят весомые преимущества мини-антител (Тиллиб С. В., 2011).
2.3. Особенности связывания антитела с антигеном
В основе любой иммунологической реакции лежит взаимодействие антигена с антителом, которое приводит к формированию комплекса «антиген – антитело». Антигенами обычно являются высокомолекулярные белки и полисахариды, реже – полипептиды, липиды и нуклеиновые кислоты. Иммунный ответ могут вызывать и небольшие молекулы, или гаптены, в том случае если они соединяются с высокомолекулярными носителями (белками, полисахаридами). В качестве гаптенов могут выступать лекарственные вещества, моно- и полисахариды, небольшие полипептиды, фосфолипиды, триглицериды, моноамины.
Небольшой участок антигена, с которым будет связываться антитело, называется эпитопом. Обычно в эпитоп входит от одной до шести молекул моносахаридов или аминокислот, расположенных на поверхности антигена. Антитела распознают не отдельные химические группы в структуре антигена, а пространственную форму эпитопов. Они способны улавливать различия в распределении зарядов на поверхности антигена, оптическую и стереоизомерию, минимальные различия в первичной структуре. Вследствие этого б|ольшая часть антител способна связываться только с нативными антигенами или с фрагментами антигена, сохраняющими третичную структуру. Следовательно, для успешного взаимодействия антигена и антитела эпитоп должен находиться на поверхности молекулы. Следует учитывать, что при денатурации молекул (например, под действием фиксирующих жидкостей, экстремальных значений pH буферных растворов и др.) эпитоп может повышать или понижать свою иммуногенность.
Большие молекулы (например, белки) имеют несколько эпитопов, поэтому они стимулируют образование антител нескольких видов к разным эпитопам одного и того же антигена. Такие антитела называют поликлональными. Они более толерантны к незначительным конформационным изменениям антигена (полиморфизму, различной степени гликозилирования, фосфорилирования, частичной денатурации), что дает больше возможностей экспериментатору при планировании исследований.
Антитела, реагирующие с одним единственным эпитопом, называют моноклональными. В отличие от поликлональных антител, они чувствительны даже к небольшим конформационным изменениям антигена. Например, можно получить моноклональные антитела, узнающие молекулу белка, фосфорилированную по определенному сайту. Благодаря высокой специфичности моноклональные антитела являются отличными первичными антителами, то есть антителами для выявления искомого антигена, так как они дают слабое неспецифическое связывание, а значит, и меньшее фоновое окрашивание. По сравнению с поликлональными антителами они обладают большей гомогенностью, что обеспечивает высокую воспроизводимость результатов. Однако связывание с единственным эпитопом обусловливает низкую чувствительность, проявляющуюся в слабом иммуноокрашивании на срезах. К тому же высока вероятность того, что фиксатор сделает этот единственный эпитоп недоступным для антител, в результате чего иммуноокрашивания вообще не произойдет. Кроме того, методы получения моноклональных антител более сложные и трудоемкие, чем методы получения поликлональных иммунных сывороток, что приводит к значительному увеличению их стоимости.
До недавнего времени большинство моноклональных антител являлись иммуноглобулинами мыши. Поэтому в исследовательской практике работы с лабораторными животными (мышами и крысами) применять их было неудобно из-за перекрестного взаимодействия вторичных реагентов с собственными иммуноглобулинами животного. За последние несколько лет появилось много новых моноклональных антител, являющихся кроличьими иммуноглобулинами (например, клоны SP от Spring Bioscience). Считается, что кроличьи моноклональные антитела позволяют добиться лучшей визуализации антигена по сравнению с мышиными. По крайней мере, у кроличьих моноклональных антител имеется очевидное преимущество: их удобно выявлять стандартными вторичными реагентами при проведении исследований с использованием мышей и крыс в качестве лабораторных животных.
2.4. Получение и очистка антител
Поликлональные антитела получают путем иммунизации лабораторных животных. Обычно для этих целей используют кроликов, морских свинок или коз. Важно соблюдать принцип чужеродности иммуногена. Установлено, что чем сильнее антиген отличается по своей структуре от гомологичного антигена иммунизируемого животного, тем выше его иммуногенность. Например, инсулины человека и кролика имеют близкую первичную структуру, и поэтому для кролика инсулин человека малоиммуногенен. Между инсулином человека и морской свинки имеются достаточные отличия, что позволяет использовать этих животных как продуцентов соответствующих антисывороток (Фримел Г. М., 1987; Herschowitz H. I. D., 1985).
В общем случае способность антигена стимулировать продукцию антител зависит от ряда факторов. Так, с повышением молекулярной массы полимерных молекул повышается их иммуногенность. Для белков пороговый размер молекулы, определяющий появление иммуногенности, – 7 – 10 аминокислот. Это количество аминокислот, позволяющее сформировать α-спираль. Кроме этого, иммуногенность растет с повышением количества повторяющихся антигенных детерминант в составе антигена и зависит от жесткости структуры антигена, т. е. способности сохранять определенную структуру. Иммуногенность одного и того же антигена зависит от генотипа и может различаться у индивидуумов, имеющих разные отдельные варианты генов главного комплекса системы гистосовместимости, поэтому обычно одновременно иммунизируют нескольких животных (Фримел Г. М., 1987).
Слабоиммуногенные антигены необходимо вводить со стимуляторами иммуногенеза (адъювантами). Наиболее часто используют адъювант Фрейнда, в состав которого входят смесь минеральных масел, эмульгатор и убитые микобактерии. Использование в иммунизации адъюванта снижает возможность появления толерантности, позволяет расширить диапазон концентраций вводимого иммуногена от 50 до 200 мкг на одну инъекцию. Однако после введения адъюванта у животных часто образуются гранулемы, которые влияют на самочувствие, поэтому в течение иммунизации необходимо тщательно наблюдать за состоянием здоровья животного.
В ходе первичного иммунного ответа обычно образуются иммуноглобулины класса IgM, продукция которых сменяется синтезом иммуноглобулинов других изотипов. Получаемые описанным выше способом антитела в большей части относятся к IgG-фракции иммунной сыворотки. Однако ответ на некоторые антигены ограничивается синтезом IgM-антител (Haunghton G. [et al.], 1993).









