
Полная версия
Основы общей и экологической токсикологии
Для шофера нарушение сумеречного зрения может иметь катастрофические последствия. В этом случае источник свинца – этилированный бензин, который содержит в качестве добавки тетраэтилсвинец Pb(C2H5)4.
Тетраэтилсвинец рассматривается как биоцид. Например, зайцы, не находя сорняков на интенсивно обрабатываемых сельскохозяйственных угодьях, поедают траву с обочин автомагистралей. Однако такая трава сильно загрязнена свинцом, и зайцы становятся его накопителями. И даже если они от этого не погибают, то все же становятся не очень проворными и гибнут под колесами автомашин, пытаясь перебежать дорогу. Расчеты показали, что употребления в пищу трех таких зайцев в неделю достаточно для того, чтобы человек мог заболеть в результате свинцового отравления.
Известен и еще один вид свинцового отравления, от которого погибает больше половины лебедей-шипунов в Англии. Все дело в том, что лебеди, шаря по дну в прибрежной зоне в поисках гравия для мышечного желудка, проглатывают упавшие в воду свинцовые шарики или грузила в виде кусочков свинца, оброненных рыболовами. Гравий в мышечном желудке нужен им для растирания водных растений, и обычно это бывают кусочки кварца или полевого шпата, запасы которых им требуется все время пополнять. Проглоченный же по ошибке мягкий кусочек свинца размалывается твердыми камешками, и частицы его растворяются пищеварительными соками, после чего свинец приникает в кровеносное русло и отравляет лебедей. По различным оценкам, в результате отравления свинцом в Англии ежегодно погибает от 2700 до 3500 лебедей. Бывает, что и у людей, съевших убитую свинцовой дробью дичь, появляются симптомы свинцового отравления (Эйхлер В., 1993).
Ртуть – рассеянный элемент, концентрируется в сульфидных рудах. Небольшие количества ртути встречаются в самородном виде. Среднее содержание ртути (n ⋅ 10– 6 %): в земной коре – 8; в гранитном слое коры континентов – 3,3; в почве – 1; в отложениях – 4;
в сумме солей Мирового океана – 0,43; в золе растений – 25; в живой фитомассе – 0,5. Суммарное количество ртути в океане 206 млн т. Общее количество элемента в атмосфере 300 – 350 т, причем концентрация ртути над сушей на порядок выше, чем над океаном. Время жизни ртути в атмосфере примерно 10 суток. Из водной среды растворимые формы ртути выводятся в донные отложения, концентрируясь в небиогенных глинистых илах с периодом полного удаления n ⋅ 104 лет. Ртуть прочно фиксируется почвой, образуя комплексы с гуминовыми кислотами (период полувыведения ртути из почвы 250 лет).
Из 1 м3 дождевой воды на Землю выпадает 200 мкг ртути, что за год составляет более 100 000 т. Это в 15 – 20 раз больше того количества, которое добывает человечество.
Основные области применения ртути – электротехническая и электрохимическая промышленности. Ртуть используется в качестве жидких электродов в ртутных выпрямителях тока. Другие применения ртути – лабораторные приборы, лекарственные препараты, фунгициды. Кроме того, ртуть используется при извлечении из руд благородных металлов, в частности золота; в качестве легирующей добавки; теплоносителя; катализатора в химической промышленности; при производстве амальгам; необрастающих красок; средств для предотвращения гниения древесины.
Ртуть – один из немногих металлов, который остается жидким при комнатной температуре. Хотя температура кипения ртути 357 °C, она очень летуча, а поэтому и опасна. В одном кубометре насыщенного воздуха при 25 °C содержится 20 мг ртути.
При вдыхании пары ртути хорошо адсорбируются и аккумулируются в мозге, почках, яичках. Острое отравление вызывает разрушение легких. В тканях организма элементная ртуть превращается в ион, который соединяется с молекулами, содержащими сульфгидрильные группы (SH-группы), в том числе и с макромолекулами белков. Хроническое отравление ртутью проявляется в постоянном нарушении нервной системы, вызывает усталость, а при более высоких уровнях отравления вызывает характерный ртутный тремор, когда мелкая дрожь каждые несколько минут прерывается весьма заметным трясением. Персонаж «Алисы в стране чудес» Льюиса Кэрролла сумасшедший Хаттер – яркий пример жертвы профессионального заболевания от отравления нитратом ртути Hg(NO3)2,используемой при обработке меха.
Органические соединения ртути, такие как хлорид метилртути (CH3HgCl), высокотоксичны вследствие их летучести. В загрязненной воде, содержащей ртуть, микроорганизмы легко переводят неорганические соединения ртути в монометилртуть (CH3Hg+). В организме рыб бо„ льшая часть ртути находится именно в этой форме, которая может сохраняться годами. В организме человека период полувыведения ртути составляет от нескольких месяцев до нескольких лет. Токсический эффект может быть скрытым. Симптомы отравления могут проявиться лишь через несколько лет. Трагедия у бухты Минамата показала, что органические соединения ртути по характеру их токсичности следует рассматривать особо, и что в этом случае доминируют поражения головного мозга: на это указывает не только столь типичное для болезни Минамата ограничение полей зрения, вплоть до угрозы полной слепоты, но и нарушенная координация движений, из-за которой больные напоминают «дышащих деревянных кукол».
Соединения ртути, в том числе метилртуть, в значительных объемах попадают в водные объекты. Ртуть аккумулируется планктонными организмами, являющимися пищей для ракообразных, а последние поедаются рыбами. Щуки, выловленные в Балтийском море у побережья Швеции, содержали до 5,7 мг/кг метилртути, и когда этой рыбой кормили кошек, то они погибали от ртутного отравления через 2 – 3 месяца.
Наиболее известные примеры массового отравления ртутью были вызваны именно CH3Hg+. В 1953 г. в Японии у 121 жителя побережья в бухте Минамата было зафиксировано заболевание, сопровождавшееся ломотой в суставах, нарушением слуха и зрения (Бондарев Л. Г., 1976; Давыдова С. Г., 1991).
Это заболевание, вошедшее в литературу под названием «болезнь Минамата», закончилось смертью для почти трети больных. В 1959 г. удалось установить, что эта болезнь вызвана употреблением в пищу рыбы, отравленной ртутью в форме хлорида (CH3HgCl), сбрасываемого химическими предприятиями прямо в воды залива. Концентрация ртути была настолько велика, что рыба погибала; поедавшие эту рыбу птицы падали прямо в море, а отведавшие отравленной пищи кошки передвигались, «кружась и подпрыгивая, коллапсируя». К 1954 г. популяция кошек в этих местах заметно снизилась. Однако до 1959 г. никаких замеров ртутного загрязнения вод залива в этом районе не проводилось (мониторинг отсутствовал).
Удалось доказать, что загрязнение залива ртутью началось еще в 1947 г. Интенсивное расследование позволило установить, что на ацетиленовом производстве ртутные отходы сбрасывались в реку, впадающую в бухту Минамата. При этом ртуть, о чем первоначально и не подозревали, микробиологическим путем превращалась в метилртуть, которая через планктон, моллюсков и рыб в конце концов попадала в пищу. В этом цикле ртуть постепенно концентрировалась и в конце пищевой цепи, дойдя до человека, достигала токсической концентрации. Подобного рода биоаккумуляция возможна только тогда, когда загрязняющее вещество поступает в организм быстрее, чем выводится из него. Но вплоть до 1968 г. сбрасывание стоков в залив не было приостановлено.
Особо подчеркнем, что подобные вещества представляют опасность для организмов вследствие их устойчивости и липофильности (взаимодействия с жирами), обусловливающими большой период полувыведения (время, в течение которого выделяется или разрушается половина усвоенного организмом вещества). Для большинства тканей организма человека период полувыведения ртути 70 – 80 дней.
Исследования показали, что бактерии в донном иле озер и рек, в слизи, покрывающей тела рыб, а также в слизи рыбьего желудка способны превращать неорганические соединения ртути в метилртуть. Часть ртути, попавшей в залив Минамата, уже была в форме метилртути, но гораздо б„ольшая доля последней была образована бактериями.
Для человека болезнь Минамата начинается с онемения конечностей и лица, нарушения чувствительности кожи и двигательной активности рук, к примеру при письме. Затем нарушается координация движений, наблюдаются слабость, дрожь и неуверенность походки, а также нарушения речи, слуха, зрения. И на заключительной стадии – общий паралич, деформация конечностей, особенно пальцев, затрудненное глотание, конвульсии и смерть. Трагично то, что дети, рожденные у мало пострадавших матерей, становились идиотами или погибали от церебрального паралича.
Печальный японский опыт был грозным предостережением. Встревоженная Швеция, в которой погибло от отравления ртутью множество птиц, проверила свою ихтиофауну. Результаты оказались неутешительными. Если в водах Северного и Балтийского морей содержание ртути в рыбах составляло 0,1 мг/кг или меньше, то в рыбах внутренних водоемов содержание ртути доходило до 9,6 мг/кг. Чаще всего повышенные концентрации ртути наблюдались у щук и окуней. Ртуть попадала в озера с отходами целлюлозно-бумажного производства.
Другой пример, связанный с отравлением ртутью. Ирак закупил у Мексики протравленное метилртутью зерно в качестве посевного материала. Однако местное население использовало это зерно для выпечки хлеба. В результате было госпитализировано 6530 из них 495 человек погибли (1971 – 1972 гг.). Симптомы были те же, что и при болезни Минамата.
Прием всего лишь одного грамма ртутной соли приводит к летальному исходу.
Кадмий относится к редким, рассеянным элементам. Он содержится в виде изоморфной примеси во многих минералах и всегда в минералах цинка. Содержание в земной коре, почве и природных водах колеблется от n ⋅ 10– 5 до n ⋅ 10– 6 %, в растениях — n ⋅ 10– 4 %от массы сухого вещества.
Кадмий применяется в ядерной энергетике для изготовления регулирующих, компенсационных и аварийных стержней атомных реакторов, в гальваностегии (антикоррозионные и декоративные покрытия). Он входит в состав некоторых сплавов: для припоев, при изготовлении подшипников, для типографских клише, электродов сварочных машин для легкоплавких, драгоценных (с серебром и золотом) и других сплавов; используется в производстве полупроводников; никель-кадмиевых аккумуляторов. Соединения кадмия входят в состав ряда пигментов, катализаторов, пиротехнических составов, стабилизаторов, лазерных материалов.
Антропогенные источники поступления кадмия в окружающую среду разделяют на две группы: локальные выбросы, связанные с промышленными комплексами, производящими или использующими кадмий; и диффузно рассеянные по Земле источники разных степеней мощности (тепловые энергетические установки, моторы, минеральные удобрения, табачный дым). Для справки отметим, что в одной сигарете содержится примерно 2 нг кадмия. Это означает, что у курильщика, выкуривающего одну пачку сигарет в день, в 2 раза по сравнению с некурящим увеличен уровень кадмия в печени и почках. Антропогенная эмиссия кадмия в биосферу в несколько раз превышает природную. Так, в воздушную среду ежегодно поступает около 9000 т кадмия, причем 7700 т (то есть более 85 %) – врезультате деятельности человека. Только в Балтийское море ежегодно поступает 200 т кадмия, в том числе 45 % – извоздуха. Особенно резко выражено загрязнение кадмием водоемов и почвы в районах размещения горнометаллургических комбинатов и предприятий по добыче и переработке цинковой руды. Загрязнение воздуха и поверхности почвы вызывает кадмий, содержащийся в выхлопных газах автомашин и тракторов. Оседание кадмиевых аэрозолей на почвы дополняется внесением кадмия в почву сельскохозяйственных угодий с минеральными удобрениями – суперфосфатом, фосфатом калия и селитрой. Велико содержание кадмия в навозе, обусловленное следующей цепью переходов:
воздух → почва → растения → травоядные → навозЗагрязнение почвы кадмием сохраняется длительное время после прекращения его поступления. Так, в Англии, на территории, примыкающей к старинным плавильным печам, не функционирующим со средних веков, концентрация кадмия оказалась в сотни раз выше фоновых концентраций.
Ежедневно с пищей, водой и воздухом в организм поступает до 0,2 мг кадмия. При этом бо„ льшая часть поступает с пищей, меньшая с водой и воздухом. К характерным болезням горожан, связанных с поступлением кадмия, относятся: гипертония, ишемическая болезнь сердца, почечная недостаточность. Курильщики, занятые на производстве с использованием кадмия, рискуют заболеть эмфиземой легких, а некурящие – бронхитами, фарингитами и другими заболеваниями органов дыхания. Наиболее серьезным последствием интоксикации кадмием является развитие почечной недостаточности.
Особо подчеркнем, что кадмий опасен в любой форме (30 – 40 мг могут оказаться смертельными). Поэтому даже питье лимонада из сосудов, материал которых содержит кадмий, чревато опасностью. Из организма кадмий выводится очень медленно (примерно 0,1 % в сутки), вследствие чего может происходить хроническое отравление. Самые ранние симптомы хронического отравления кадмием – белок в моче, дисфункция половых органов, нарушение нервной системы, острые костные боли в спине и ногах.
Известна история, как цинковый рудник в Японии загрязнил речку Дзинцу. Около 150 человек умерло от атрофии костного скелета. Эта трагедия вошла в историю отравлений тяжелыми металлами под названием «болезнь итаи-итаи» (японский эквивалент выражения «ох-ох»). Название болезни происходит от боли в спине и ногах, сопровождающейся декальцификацией скелета (обычно у старых женщин), которое приводит к ломкости костей (известен случай с 72 переломами у одного человека). Болезнь протекает с деформацией скелета, снижением роста, тяжелыми болями в пояснице, в мышцах ног, утиной походкой, легкостью возникновения переломов при самых незначительных напряжениях, например переломы ребер при кашле. Это заболевание приводит к смерти. В Японии оно могло возникнуть из-за употребления воды, загрязненной кадмием, непосредственно при питье или зерна (особенно риса), которое при выращивании поливали водой в течение многих лет.
В США случаи заболевания итаи-итаи имели место в связи с потреблением сахарного горошка, который содержал б„ольшую концентрацию кадмия.
Количество кадмия, попадающего в организм человека, зависит не только от употребления им кадмийсодержащих пищевых продуктов, но и в значительной степени от качества его диеты. В частности, даже весьма незначительная недостаточность железа может заметно увеличить аккумуляцию кадмия. Именно поэтому женщины, которые в результате менструаций регулярно теряют вместе с кровью железо, более подвержены отравлению кадмием, чем мужчины. Токсические эффекты кадмия в водных объектах широко варьируются в зависимости от вида организма, концентрации, температуры среды, жесткости воды и наличия других металлов. Установлено, что токсическому действию кадмия наиболее подвержены водные организмы в эмбриональной стадии развития. Исследования на гольянах и других видах рыб показали тератогенное действие соединений кадмия, выражающееся в разнообразных уродствах.
Мышьяк – полуметалл. Его содержание в земной коре (кроме геохимических зон) составляет1·10– 4– 1·10– 3 %. В окружающей среде мышьяк находится в виде разнообразных химически устойчивых форм. Его два главных состояния окисления: As(III) и As(V). В природе распространен пятивалентный мышьяк в виде разнообразных неорганических соединений, хотя и трехвалентный мышьяк легко обнаруживается в воде, особенно в анаэробных условиях.
В естественных условиях соединения мышьяка поступают в окружающую среду при извержении вулканов и ветровой эрозии почвы. Антропогенные источники поступления мышьяка в окружающую среду – добыча и переработка мышьяксодержащих руд, пирометаллургия, сжигание природных видов топлива (каменного угля, сланцев, нефти, торфа), а также производство и использование суперфосфатов, содержащих мышьяк ядохимикатов, препаратов и антисептиков. Металлический мышьяк применяется только в сплавах (с медью, свинцом); входит в состав некоторых антифрикционных и типографских сплавов. Хлорид мышьяка (III) используется в производстве фармацевтических препаратов и для уничтожения личинок комаров.
Загрязнение водной среды мышьяком возможно при длительном контакте природных вод с отвалами на основе неутилизируемых твердых мышьяксодержащих отходов. Отходы, складируемые на открытых площадках без спецзахоронения или замуровываемые в глиняные траншеи и котлованы, представляют собой мощные источники загрязнения почвы, воды и атмосферного воздуха. Применение мышьяксодержащих пестицидов в сельском хозяйстве приводит к загрязнению почв.
Мышьяк уже долгое время является предметом токсикологических исследований. Эти исследования проводились из-за частых случаев его использования в качестве средства для убийства и самоубийства, из-за его употребления в качестве пестицида в садах и виноградниках, как отравляющего вещества кожно-нарывного действия в качестве химического оружия. Токсические эффекты соединений мышьяка хорошо и достаточно давно известны. Напомним историю смерти Наполеона, погибшего на острове Святой Елены от хронического отравления мышьяком. Об этом свидетельствовали результаты анализов останков императора. Другой пример – «рак виноградарей», еще в позапрошлом веке использовавших препараты мышьяка для опрыскивания виноградников.
Механизмы токсического действия мышьяка множественны. Это и нарушение тканевого дыхания, и дегенеративные и некротические процессы в тканях, и тератогенные эффекты (у женщин, подвергавшихся во время беременности экспозиции к мышьяку, часто рождаются дети с низким весом, имеют место различные уродства, а также высока частота выкидышей). Спустя значительное время после контакта с мышьяком, может проявиться его канцерогенное действие. Причем, кроме производственных условий, главные пути поступления мышьяка в организм человека – мышьяксодержащие лекарства, пестициды и питьевая вода. В случае сильного отравления основным признаком является сильное нарушение желудочно-кишечного тракта, сопровождаемое спазмами и диареей, и эти эффекты проявляются почти немедленно.
Описаны случаи массового рака кожи среди жителей провинции Кордоба (Аргентина) и острова Тайвань, где население в течение 60 лет использовало питьевую воду с высоким содержанием мышьяка. Мышьяк включен в группу безусловных канцерогенов для человека, поскольку вызывает рак легких и кожи.
Тяжелые металлы относятся к числу важнейших факторов, обусловливающих загрязнение водных объектов. Поступление в воду тяжелых металлов связано с деятельностью многих отраслей промышленности (табл. 1.2).
Таблица 1.2
Отрасли промышленности, загрязняющие природную среду тяжелыми металлами
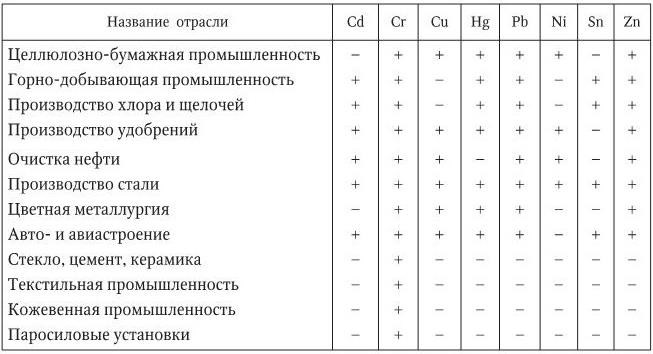
Особо отметим, что степень воздействия металлов на окружающую среду определяется формами их нахождения. После поступления в биосферу они подвергаются различным превращениям с изменением валентности и растворимости. Так, металлургические предприятия, тепло- и электростанции выбрасывают металлы преимущественно в нерастворимой форме, однако в ходе атмосферного переноса происходит постепенное их выщелачивание из минеральной матрицы аэрозольных частиц и переход в ионную, водорастворимую форму.
1.2. Полициклические ароматические углеводороды
Известно большое количество полициклических ароматических углеводородов (ПАУ) (нафталин, антрацен, пирен, хризен, фенантрен, бенз(а)антрацен и др.). В табл. 1.3 приведены некоторые характеристики наиболее изученных ПАУ.
Таблица 1.3
Характеристики полициклических ароматических углеводородов
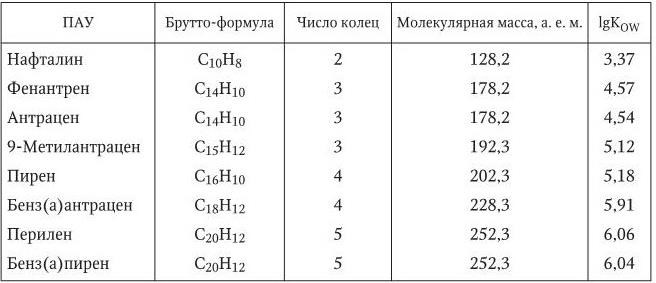
Примечание. Kow – коэффициент распределения в системе н-октанол – вода.
Соединения этой группы встречаются практически во всех сферах окружающей человека среды. Установлено, что ПАУ возникают как продукт абиотического происхождения в результате вулканической деятельности. Так, при исследовании образцов вулканического пепла были обнаружены различные (но отличающиеся, как правило, не более чем на один порядок) уровни содержания ПАУ. Например, в пепле вулкана Тятя (остров Кунашир) концентрация бенз(а)пирена (БП) составляла до 0,4 мкг/кг, а вулкана Плоский Толбачик (полуостров Камчатка) – до 5,5 – 6,1 мкг/кг. Было подсчитано, что при современном уровне вулканической активности ежегодно в биосферу Земли поступает до 24 т БП с пеплом вулканов и, по-видимому, от нескольких десятков до сотен тонн с лавой.
Другой природный источник ПАУ – процессы нефте-, угле- и сланцеобразования. Экспериментально доказана и возможность синтеза ПАУ различными микроорганизмами и растениями; этим путем в биосферу поступает ежегодно до 1000 т БП. Если современный фоновый уровень ПАУ практически совпадает с природным, существующим на протяжении тысячелетий (что подтверждено определением БП в пробах почв из зон вечной мерзлоты), то антропогенное загрязнение среды этими соединениями многократно его превышает.
ПАУ образуются главным образом в процессе горения самых различных горючих материалов (уголь, древесина, сланцы, нефтепродукты) при температуре около 80 °C и свыше 500 °C. ПАУ попадают в атмосферу со смолистыми веществами (дымовые газы, копоть, сажа и т. д.), поступают в водоемы со стоками различных видов, атмосферными осадками, выбросами водного транспорта и т. д.
Основными антропогенными источниками ПАУ являются:
– стационарные, т. е. промышленные выбросы от коксохимических, металлургических, нефтеперерабатывающих и иных производств, а также отопительных систем и предприятий теплоэнергетики;
– передвижные, т. е. водный, наземный, в основном автомобильный, транспорт, авиация. Установлено, что только за 1 мин работы газотурбинный двигатель современного самолета выбрасывает в атмосферу 2 – 4 мг БП. Даже приблизительные расчеты показывают, что в атмосферу от этого источника поступает ежегодно более 5000 т БП.
Индикаторное значение для всех ПАУ имеет бенз(а)пирен (Худолей В. В., 1993; 1999). Это обусловлено следующими наблюдениями: 1) БП всегда находят там, где присутствуют другие ПАУ;
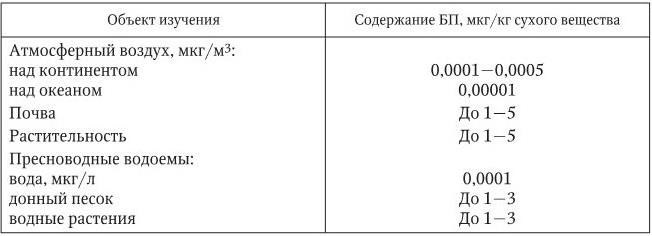
2) по сравнению с другими ПАУ именно БП обладает наибольшей стабильностью в окружающей среде; 3) БП отличается наиболее выраженной биологической, в частности канцерогенной, активностью; 4) существующие физико-химические методы индикации БП в различных средах являются наиболее чувствительными среди методов определения ПАУ. БП идентифицирован в табачном дыме (20 – 40 мкг/сигарету), дыме марихуаны (29 нг/сигарету), городском воздухе (0,05 – 74 нг/м3), выхлопах дизельных двигателей (2 – 170 мкг/кг экстракта), отработанных машинных маслах (5,2 – 35,1 мг/кг), загрязнениях водоемов (0,2 – 13 000 нг/л), чае (3,9 – 21,3 мкг/кг), кулинарных продуктах. В табл. 1.4 приведены данные о современном фоновом уровне бенз(а)пирена в биосфере.
Таблица 1.4
Современный фоновый уровень бенз(а)пирена в биосфере
1.3. Хлорорганические пестициды
C ростом населения Земли стало ясно, что обеспечение его продуктами питания немыслимо без перехода к интенсивному сельскохозяйственному производству, предполагающему широкое использование не только удобрений, но и средств защиты растений от различных болезней и вредителей, а также сорняков. В этом плане большие надежды возлагались на искусственные химические препараты, получившие название пестицидов. Пестициды (pestis – зараза, caedo – убивать) – общепринятое собирательное название химических средств защиты растений. Они используются для борьбы с сорняками, вредителями, грибковыми заболеваниями и другими болезнями сельскохозяйственных растений, кустарников и деревьев. Их применение наиболее интенсивными темпами началось в 1940-х гг.
Особо эффективными средствами борьбы с насекомыми-вредителями оказались хлорорганические соединения алифатического и ароматического рядов. Некоторые из них были известны уже довольно давно, однако пестицидные свойства их были выявлены лишь в 1930 – 1940-х гг. Среди этих соединений особое значение имеют гексахлорциклогексан (линдан, α-ГХЦГ), ДДТ (4,4′-дихлордифенилтрихлорметилметан) и его метаболиты ДДЕ (4,4′-дихлордифенилхлорметилметан) и ДДД (4,4′-дихлордифенилдихлорметилметан), гексахлорбензол и некоторые другие.
ДДТ впервые был синтезирован в 1873 г. в Швейцарии, но официально запатентован Паулем Мюллером только в 1939 г. К этому времени удалось выявить высокую инсектицидную активность ДДТ. В продажу ядохимикат поступил в 1942 г. Во Второй мировой войне препарат был успешно использован союзниками для уничтожения комаров и вшей, что позволило предупредить эпидемии сыпного тифа и малярии. В 1948 г. швейцарский ученый П. Мюллер получил Нобелевскую премию «за открытие высокой эффективности ДДТ как контактного яда». В последующие годы использование препарата в сельском хозяйстве позволило резко повысить урожайность многих культур (Головко А. И. [и др.], 1999).



