
Полная версия
Медицинская паразитология с энтомологией
Продолжительность контакта паразитов с хозяином различна – от нескольких минут до нескольких дней, месяцев и лет. Многие виды иксодовых клещей в течение своей жизни питаются кровью хозяина в фазах личинки, нимфы и самки, каждый раз оставаясь на хозяине по несколько дней. Некоторые виды паразитов обитают вблизи хозяина (в гнезде, логове), причем в ряде случаев за счет хозяина питаются только взрослые особи, например блохи. На протяжении всех фаз развития за счет хозяина кормятся аргасовые клещи, клопы и др.
При этом необходимо отличать паразитов от ложнопаразитов, или псевдопаразитов.
Ложнопаразитами называют такие свободноживущие формы, которые, попадая случайно в организм человека или животного, могут какое-то время жить в нем и питаться за его счет (например, личинки сырной мухи). Они могут быть истинными и мнимыми. В отличие от истинных, мнимые ложнопаразиты обнаруживаются в фекалиях хозяина, куда попадают извне.
Если паразит развивается в организме неспецифического хозяина, куда попадает случайно, то его называют ксенопаразитом. Например, при случайном попадании в организм человека личинок крысиного цепня в кишечнике возможно развитие ленточной (половозрелой) формы паразита.
Ряд паразитов, называемых гетер оксенными, могут паразитировать у представителей нескольких видов животных, иначе говоря, имеют широкий круг хозяев. Так, например, самки комаров пьют кровь не только у человека и различных млекопитающих, но и у птиц.
Паразиты, живущие за счет представителей одного вида хозяев (головная вошь у человека), именуются моноксенными или специфичными. Моноксенные паразиты не могут паразитировать на других, даже близких, видах животных или растений.
Заражение хозяина паразитами, принадлежащими к протестам, гельминтам, клещам и насекомым, может происходить различными путями: алиментарным, т. е. путем заглатывания яиц или личинок гельминтов с немытыми овощами и фруктами, а также с мясом крупного рогатого скота, свиней или других промежуточных хозяев паразитов; при питье воды из водоемов, где могут находиться личинки паразитов (кровяные сосальщики, или шистосомы, возбудители дракункулеза); через кожные покровы (чесоточный зудень, личинки анкилостомид); через плаценту (токсоплазма, трипаносома); через кровь при укусе кровососущих членистоногих переносчиков (комар рода Anopheles).
Источником (резервуаром) паразитарных болезней (инвазий) является окончательный хозяин паразита (например, комар Anopheles), в котором происходит цикл полового развития малярийного плазмодия, или промежуточный хозяин (мошки, комары). Для своего хозяина паразиты всегда являются чужеродными организмами, действующими на него своими секретами, экскретами, другими токсическими веществами и аллергенами, вызывающими общее ослабление организма хозяина и повышение восприимчивости к другим заболеваниям.
Общая характеристика паразитарных болезней
Болезни, вызываемые патогенными протестами (около 20 видов), называют протозоозами; гельминтами (около 200 видов) – гельминтозами, среди которых выделяют трематодозы, нематодозы, цестодозы; мухами – миазы; клещами – акариозы. Иногда акариозы и энтомозы объединяют в так называемые арахноэнтомозы.
Многие паразитарные болезни связаны с территориями, природные факторы которых отвечают экологическим требованиям возбудителей этих болезней.
Природные факторы могут быть как биотическими (достаточная распространенность животных – хозяев возбудителей), так и абиотическими (температура, влажность, характер почвы). Правда, распространенность паразитарных болезней в пределах этих территорий зависит также от социально-экономических факторов (условия труда и быта людей, их культура, уровень развития здравоохранения). Распространение некоторых паразитарных болезней полностью определяется условиями быта людей и соблюдением ими правил гигиены. Это паразитарные болезни, передающиеся преимущественно контактно-бытовым путем (энтеробиоз, гименолепидоз).
Особое место в систематике паразитарных болезней занимают дерматозы, под которыми понимают группу поражений кожи, вызванных животными-паразитами. Среди них выделяют две подгруппы: эктопаразитов, паразитирующих на поверхности кожи (вши, блохи), и внутрикожных паразитов, внедряющихся в толщу кожи или под кожу и проходящих там свой цикл развития (чесоточный клещ, личинки некоторых червей и мух).
Паразитарные дерматозы, таким образом, бывают поверхностными (эпизоозы), с локализацией патологического процесса в эпидермисе – дерматофилиазы, и глубокими (дерматозозы) – с поражением дермы и, нередко, подкожной клетчатки, что наблюдается при дракункулезе, лейшманиозе, миазах, филяриатозах, цистицеркозе, чесотке, вшивости.
В зависимости от возбудителя и степени поражения кожи клинические проявления паразитарных дерматозов весьма разнообразны (эритема, отек, бугорки, пузыри, узлы, изъязвления) и сопровождаются неприятными субъективными ощущениями (зуд, жжение, боль). В результате сенсибилизации организма продуктами жизнедеятельности паразитов возможны аллергические высыпания, эозинофилия, явления интоксикации (слабость, головная боль, тошнота, рвота, адинамия, судороги).
Лечение, прогноз и профилактика зависят от вида паразитарного дерматоза.
Профилактические и противоэпидемические мероприятия
К профилактическим мероприятиям относятся:
♦ охрана окружающей среды (почвы, водоисточников) от загрязнения испражнениями людей и животных;
♦ благоустройство населенных мест (строительство канализации, водопровода и др.);
♦ санитарный надзор за территорией и водоснабжением населенных мест, за производством, транспортировкой и торговлей пищевыми продуктами;
♦ ветеринарно-санитарный надзор на бойнях, мясокомбинатах, рынках, в животноводческих хозяйствах;
♦ выявление и санация носителей возбудителей паразитарных болезней;
♦ при необходимости – защита людей от нападения членистоногих; санитарная пропаганда знаний по личной профилактике паразитарных болезней.
К противоэпидемическим мероприятиям относятся:
♦ активное выявление больных и носителей возбудителей инвазий;
♦ учет и лечение бальных;
♦ при необходимости госпитализация, диспансерное наблюдение после лечения;
♦ обезвреживание или уничтожение (по показаниям) животных – источников инвазии (грызунов, собак);
♦ широкий круг санитарно-профилактических мер в населенных пунктах.
Методы диагностики паразитарных болезней
В лабораторной диагностике используют макроскопические, микроскопические и иммунологические методы исследования.
С помощью макроскопических методов удается обнаружить паразитов на наружных покровах или в фекалиях больного.
Микроскопическими исследованиями выявляют паразитов в мазках крови, тканевой жидкости, кусочках мышц, полученных с помощью биопсии, а также в экскретах (мокроте, фекалиях).
Среди иммунологических методов в диагностике протозойних болезней и гельминтозов чаще всего используют серологические и аллергические реакции.
Микроскопы и способы микроскопии
В паразитологических исследованиях применяются методы оптической и электронной микроскопии с помощью световых и электронных микроскопов.
Световой микроскоп. Оптический прибор, позволяющий получить обратное изображение изучаемого объекта и рассмотреть мелкие детали его строения, размеры которых лежат за пределами разрешающей способности глаза.
Разрешающая способность микроскопа дает раздельное изображение двух близких друг другу линий. Невооруженный человеческий глаз имеет разрешающую способность около 1/10 мм или 100 мкм. Лучший световой микроскоп примерно в 500 раз улучшает возможность человеческого глаза, т. е. его разрешающая способность составляет около 0,2 мкм или 200 нм.
В лабораториях обычно используют световые микроскопы, на которых микропрепараты рассматриваются с использованием естественного или искусственного света. Наиболее распространены световые биологические микроскопы: БИОЛАМ, МИКМЕД, МБР (микроскоп биологический рабочий).
В микроскопе выделяют две системы: оптическую и механическую.
К оптической системе относят объективы, окуляры и осветительное устройство (конденсор с диафрагмой и светофильтром, зеркало или электроосветитель).
Объектив – одна из важнейших частей микроскопа, поскольку он определяет полезное увеличение объекта. Объектив состоит из металлического цилиндра с вмонтированными в него линзами, число которых может быть различным. Увеличение объектива обозначено на нем цифрами. В учебных целях используют сухие объективы х8, х40 и иммерсионный объектив х90. Качество объектива определяет его разрешающая способность.
Окуляр устроен намного проще объектива. Он состоит из 2–3 линз, вмонтированных в металлический цилиндр. Между линзами расположена постоянная диафрагма, определяющая границы поля зрения. Нижняя линза фокусирует изображение объекта, построенное объективом в плоскости диафрагмы, а верхняя служит непосредственно для наблюдения.
Увеличение окуляров обозначено на них цифрами: х7, х10, х15. Окуляры не выявляют новых деталей строения, объекта. Таким образом, окуляр, подобно лупе, дает прямое, мнимое, увеличенное изображение наблюдаемого объекта, построенное объективом.
Для определения общего увеличения микроскопа следует умножить увеличение объектива на увеличение окуляра.
Осветительное устройство состоит из зеркала или электроосветителя, конденсора с ирисовой диафрагмой и светофильтром, расположенных под предметным столиком. Они предназначены для освещения объекта пучком света.
Зеркало служит для направления света через конденсор и отверстие предметного столика на объект. Оно имеет две поверхности: плоскую и вогнутую. В лабораториях с рассеянным светом используют вогнутое зеркало.
Электроосветитель устанавливается под конденсором в гнездо подставки.
Конденсор состоит из 2–3 линз, вставленных в металлический цилиндр. При его подъеме или опускании с помощью специального винта соответственно конденсируется или рассеивается свет, падающий от зеркала на объект.
Ирисовая диафрагма расположена между зеркалом и конденсором. Она служит для изменения диаметра светового потока, направляемого зеркалом через конденсор на объект, в соответствии с диаметром фронтальной линзы объектива, и состоит из тонких металлических пластинок. С помощью рычажка их можно то соединять, полностью закрыв нижнюю линзу конденсора, то разводить, увеличивая поток света.
Кольцо с матовым стеклом, или светофильтром, уменьшает освещенность объекта. Оно расположено под диафрагмой и передвигается в горизонтальной плоскости.
Механическая система микроскопа состоит из подставки, коробки с микрометренным механизмом и микрометренным винтом, тубуса, тубусодержателя, револьвера, винта грубой наводки, предметного столика, кронштейна конденсора, винта перемещения конденсора.
Подставка – это основание микроскопа.
Коробка с микрометренным механизмом, построенным на принципе взаимодействующих шестерен, прикреплена к подставке неподвижно.
Микровинт служит для незначительного перемещения тубу-содержателя, а, следовательно, и объектива, на расстояния, измеряемые микрометрами. Полный оборот микрометренного винта передвигает тубусодержатель на 100 мкм, а поворот на одно деление опускает или поднимает тубусодержатель на 2 мкм. Во избежание порчи микрометренного механизма разрешается вращать микровинт в одну сторону не более чем на половину оборота.
Тубус, или трубка – цилиндр, в который сверху вставляют окуляры. Тубус подвижно соединен с головкой тубусодержателя, его фиксируют стопорным винтом в определенном положении. Ослабив стопорный винт, тубус можно снять.
Тубусодержатель несет тубус и револьвер.
Револьвер предназначен для быстрой смены объективов, которые ввинчиваются в его гнезда. Центрированное положение объектива обеспечивает защелка, расположенная внутри револьвера.
Винт грубой наводки используют для значительного перемещения тубусодержателя, а следовательно, и объектива, с целью фокусировки объекта при малом увеличении.
Предметный столик предназначен для расположения на нем препарата. В середине столика имеется круглое отверстие, в которое входит фронтальная линза конденсора. На столике есть две пружинистые клеммы-зажимы, закрепляющие препарат.
Кронштейн конденсора подвижно присоединен к коробке микрометренного механизма. Его можно поднять или опустить с помощью винта, который вращает зубчатое колесо, входящее в пазы рейки с гребенчатой нарезкой.
При микроскопии иммерсионным объективом (от позднелат. immersio – погружение) с увеличением х90 обязательным условием является его погружение в кедровое, персиковое или (при их отсутствии) в вазелиновое масло, так как показатели преломления света у них близки предметному стеклу, на котором делают препараты (мазки). В этом случае падающий на препарат пучок света не рассеивается и, не меняя своего направления, попадает в иммерсионный объектив. Разрешающая способность иммерсионного микроскопа находится в пределах 0,2 мкм при максимальном увеличении объекта, которое может достигать 1350.
При использовании иммерсионного объектива вначале центрируют оптическую часть микроскопа. Если тубус микроскопа раздвижной, то его устанавливают на длину 160 мм, затем поднимают конденсор до уровня предметного столика, открывают диафрагму, устанавливают объектив х8 и с помощью плского зеркала освещают поле зрения. На предметное стекло с окрашенным препаратом наносят каплю масла, в которую под контролем зрения осторожно погружают объектив, затем, постепенно поднимая тубус и глядя в окуляр, вначале макро-, а потом микровинтом добиваются четкого изображения объекта. Закончив работу, поднимают тубус, снимают препарат, с фронтальной линзы объектива салфеткой удаляют масло и, отведя тубус в сторону, опускают к предметному столику.
Люминесцентная микроскопия. Метод основан на способности некоторых клеток и красителей светиться при попадании на них ультрафиолетовых и других коротковолновых лучей света. Люминесцентные микроскопы представляют собой обычные световые микроскопы, снабженные ярким источником света и набором светофильтров, которые выделяют коротковолновую часть спектра, возбуждающую люминесценцию. Между зеркалом микроскопа и источником света устанавливается сине-фиолетовый светофильтр (УФС-3, ФС-1 и пр.). На окуляр надевают желтый светофильтр (ЖС-3 или ЖС-18).
Различают собственную (первичную) и наведенную (вторичную) флюоресценцию. Так как большая часть протистов не обладает собственной флюоресценцией, то они обрабатываются красителями, способными флюоресцировать (вторичная люминесценция).
Люминесцентная микроскопия отличается целым рядом преимуществ: дает цветное изображение и значительную контрастность; позволяет обнаружить живые и погибшие микроорганизмы; прозрачные и непрозрачные объекты; установить локализацию паразитов в пораженных клетках организма.
Электронная микроскопия. При электронной микроскопии вместо света используется поток электронов в безвоздушной среде, на пути которых находится анод. Источником электронов является электронная пушка (вольфрамовая проволока, разогреваемая до 2500–2900 °C). Оптические линзы заменены электромагнитами. Между вольфрамовой нитью и анодом возникает электрическое поле в 30 000 -50 000 В, что сообщает электронам большую скорость, и они, проходя через отверстие в аноде, попадают в первую электромагнитную линзу (конденсор).
Электронные лучи по выходе из конденсора собираются в плоскости исследуемого объекта. Они отклоняются под разными углами за счет различной толщины и плотности препарата и попадают в объективную электромагнитную линзу, снабженную диафрагмой.
Электроны, мало отклонившиеся при встрече с объектом, проходят через диафрагму, а отклонившиеся под большим углом, задерживаются, благодаря чему обеспечивается контрастность изображения.
Линза объектива дает промежуточное увеличение изображения, которое рассматривается через смотровое окно.
Проекционная линза может увеличивать изображение во много раз, оно проецируется на флюоресцирующий экран и фотографируется.
В зависимости от целей исследования используют мощность от 20 до 100 000 Вт. Разрешающая способность электронных микроскопов равна 3–4 ангстрема (10 Å = 1 нм). Для биологических объектов разрешение обычно составляет 1–2 нм.
В электронном микроскопе протисты и гельминты идентифицируют по тонким деталям их ультраструктуры: получают микрофотографии. Для этого содержащий их материал наносят на электронно-микроскопические сеточки, покрытые формваровой пленкой, и паразитов контрастируют 1 %-ным уранилацетатом и лимонно-кислым свинцом. Покрывая протистов и гельминты, эти вещества создают вокруг них темный фон, а проникая вглубь между структурными компонентами, способствуют выявлению деталей их структуры. Конфигурация паразитов отчетливо отпечатывается на матрицах-репликах высохших пленок пластмассы, раствором которых они заливаются.
Диагностика протозойных болезней основана, главным образом, на глубоком знании морфологической структуры патогенных протистов, способах приготовления, фиксации и окраски мазков-препаратов. Результаты микроскопии в значительной степени зависят от выбора патологического материала, его характера, времени взятия от начала заболевания, срока исследования от момента его получения.
Методики изготовления мазков-препаратов из материала (культур)
Мазки-препараты готовят из гноя, мокроты, фекалий больных, колоний или налета чистых культур протистов, выросших на питательных средах в чашках Петри или пробирках. Мазки делают на предметных стеклах, как правило, бактериальной петлей (диаметр 3x2 мм) из нихромовой проволоки, конец которой укрепляют зажимом в специальном петледержателе или впаивают в стеклянную палочку Кроме того, для изготовления мазков необходимы газовая горелка или спиртовка, ванночка с подставкой (мостик) для стекол, промывалка с водой, флакон с изотоническим раствором хлористого натрия, красители, фильтровальная бумага, банки с дезинфицирующим раствором для обезвреживания отработанных препаратов, пипеток, материалов и рабочего стола.
Этапы приготовления мазка. 1. Исследуемые материалы и культуры простейших берут бактериальной петлей, которую стерилизуют в пламени горелки. При ее введении в пробирки и колбы стерилизуют не только петлю, но также верхнюю часть петледержателя. При этом пробирку с культурой берут большим и указательным пальцами левой руки, а бактериальную петлю держат правой, как ручку. Ватную пробку зажимают мизинцем правой руки и извлекают из пробирки. Края горлышка пробирки стерилизуют в пламени горелки и почти одновременно обжигают петлю, которую быстро вводят внутрь пробирки, охлаждают и прикасаются к налету на скошенном питательном агаре или же погружают ее в жидкую питательную среду. Затем петлю извлекают, быстро обжигают край пробирки, закрывают пробкой, проведенной через пламя, и ставят в штатив.
2. Налет чистой культуры простейших или колонию эмульгируют в капле воды на предметном стекле и круговыми движениями петли равномерно распределяют на площади диаметром 1,0–1,5 см. Точно такого же размера готовят мазок из бульонной культуры, гноя, мокроты, других материалов, которые, естественно, не взвешиваются в воде. Хорошо приготовленные тонкие мазки имеют округлую форму, быстро высыхают при комнатной температуре, более толстые – высушивают в термостате или при подогревании над пламенем горелки, не допуская свертывания белка простейших и гельминтов, нарушающего их структуру.
3. Высушенные мазки фиксируют 5–6 с в пламени спиртовки, чтобы убить протистов для лучшего восприятия ими красителей, закрепить их на предметном стекле и предотвратить их смыв при ополаскивании мазка водой после окраски.
Для приготовления мазков из гноя и мокроты пользуются двумя предметными стеклами (рис. 1). На середину одного из них наносят небольшое количество материала, который покрывают вторым стеклом так, чтобы осталась свободной треть первого и второго стекол. Раздвигая стекла в стороны, получают два больших мазка одинаковой толщины.
Мазки из крови готовят следующим образом. Стерильной иглой для инъекций делают укол предварительно продезинфицированного безымянного пальца левой руки. Первую каплю крови удаляют ватой, а вторую наносят на край хорошо обезжиренного предметного стекла. Мазки делают узким шлифованным стеклом (рис. 2), установленным под углом 45°, продвигая его вдоль предметного стекла в сторону, не доходя до края (мазок имеет желтоватый цвет и просвечивается).
Препараты-отпечатки из внутренних органов трупов, мяса, колбасных изделий получают, прикасаясь предметным стеклом к поверхности разрезов, выполненных стерильным скальпелем.
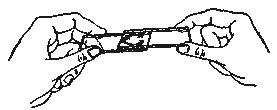
Рис. 1. Приготовление мазка из гноя и мокроты
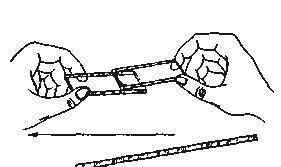
Рис. 2. Техника приготовления мазка из крови (стрелка показывает направление движения шлифованного
Приготовленные таким образом препараты из гноя, мокроты, крови, органов и тканей, деформирующихся при высокой температуре, обрабатывают метиловым спиртом -5 мин, этиловым спиртом -10-15 мин, смесью Никифорова (равные объемы этилового спирта и эфира) – 10–15 мин, ацетоном – 5 мин, парами осмиевой кислоты и формалина -10-20 с.
4. Фиксированные мазки окрашивают кислыми, щелочными и нейтральными анилиновыми красителями.
Приготовление красителей
Наиболее широко при простом (однократном) способе окраски мазков применяются водный фуксин Пфейффера, метиленовый синий Леффлера и генцианвиолет.
Водный фуксин готовится из концентрированного фенолового фуксина Циля (основной фуксин – 1 г; спирт 96 %-ный -10 мл; фенол кристаллический – 5 г; глицерин – несколько капель; вода дестиллированная – 100 мл), разводя его дестиллированной водой в соотношении 1:10. При этом насыщенный кристаллами фенола фуксин Циля растирают в ступке до гомогенной массы, добавляя малыми порциями спирт. Затем, не прекращая помешивания, постепенно доливают 9 частей дистиллированной воды. Через 48 ч выдерживания при комнатной температуре раствор фильтруют, после чего фуксин Пфейффера готов к употреблению.
Метиленовый синий Леффлера готовят путем прибавления к 30 мл насыщенного раствора метиленового синего (10 г метиленового синего в 100 мл 96 %-ного этилового спирта) 1 мл 1 %-ного натрия гидроксида или калия гидроксида и 100 мл дестиллированной воды; везу вин – растворяя 2 г порошка в смеси 60 мл 96 %-ного спирта и 40 мл дистиллированной воды при нагревании до кипения, с последующей фильтрацией.
Для приготовления генцианвиолета берут 1 г красителя и растворяют его в феноловом растворе – 100 мл дестиллированной воды, 2 г кристаллического фенола и 10 мл 96 %-ного этанола.
После окрашивания красители сливают, препарат промывают водой и высушивают между листами фильтровальной бумаги. На сухой мазок наносят каплю масла и микроскопируют с использованием иммерсионного объектива оптического микроскопа.
При сложных методах окраски мазков применяют два-три различных по цвету красителя, что позволяет дифференцировать протистов и выявлять некоторые нюансы в деталях их строения. К таким методам относят окраску по Цилю – Нельсену, Романовскому – Гимзе и некоторые другие.
Мазок для люминесцентной микроскопии готовят обычным образом, фиксируют в ацетоне 5-10 мин и наносят на него флюорохром на 20–30 мин. В качестве флюорохромов используют аурамин, акридин желтый, флюоресцеинизотиоцианат. Готовый препарат 15–20 мин промывают проточной водой, покрывают покровным стеклом и микро скопируют.
Для электронной микроскопии вместо предметных стекол применяются очень тонкие пленки-подложки, незначительно поглощающие электроны. Они крепятся на опорные сетки. Материалом для приготовления пленок служит коллодий, оксид алюминия и кварц. Исследуемый материал, тщательно очищенный от различных примесей, наносят на пленку, на которой после испарения жидкости остается тончайший слой. Высушенный препарат устанавливают для микроскопирования. Контрастирование препаратов осуществляется с помощью электроноплотных (задерживающих электроны) веществ: напыление тяжелыми металлами, обработка препаратов фосфорно-вольфрамовой кислотой и уранилацетатом.

