
Полная версия
Репликация ДНК: учебное пособие

Спивак Ирина Михайловна
Репликация ДНК
Введение
Генетическая программа всех живых организмов, за исключением РНК-содержащих вирусов, записана в нуклеотидной последовательности ДНК. Следовательно, для сохранения уникальных свойств организма необходимо точное воспроизведение этой последовательности в каждом последующем поколении. Е. соli, например, должна дуплицировать практически без ошибок полный геном размером 4·106 нуклеотидных пар при образовании каждого последующего поколения; точно так же должны быть скопированы почти 4·109 пар оснований в 23 парах хромосом человека при каждом акте деления клеток. Основным свойством ДНК является то, что она служит матрицей и определяет порядок, в котором нуклеотиды выстраиваются в новые полинуклеотидные нити.
Собственно репликация ДНК в широком смысле – очень важный для делящейся клетки процесс. В него входит также подготовка хроматина к репликации и недопущение повторного митоза. Это обеспечивает однократную дупликацию ДНК в течение одного клеточного цикла, поддерживая таким образом стабильность генома.
Генетическая стабильность живых организмов в значительной степени определяется функционированием комплекса белков, осуществляющих репликацию ДНК. Очевидно, что репликация ДНК регулируется множеством белок-белковых и ДНК-белковых взаимодействий, механизм которых остается неизвестным. Кроме того, комплекс репликации ДНК работает взаимосогласованно с комплексами белков, осуществляющих репарацию повреждений ДНК. Одновременно процесс передачи информации от родителькского организма к дочернему сопровождается рекомбинацией молекул ДНК для создания большего наследственного разнообразия. Процесс ДНК-рекомбинации подробно описан при мейотическом кроссингвере в процессе образования половых клеток, при V(D)J-рекомбинации – процессе формирования разнообразных генов иммуноглобулинов и иммуноглобулиновых рецепторов, при действии некоторых систем репарации ДНК. Учитывая все многообразие и согласованность процессов ДНК-метаболизма, можно предположить еще большее разнообразие и сложное взаимодействие белковых комплексов, осуществляющих стабильное воспроизведение наследственного материала в поколениях.
Важно осознавать, что в ДНК закодирована информация о механизме ее собственного удвоения: одни гены кодируют ферменты, синтезирующие нуклеотидные предшественники ДНК, другие – белки, осуществляющие сборку активированных нуклеотидов в полинуклеотидные цепочки. Есть гены, координирующие процесс репликации с другими клеточными событиями, а также гены, кодирующие белки, которые упаковывают ДНК в хроматин.
Понимание регуляции и динамики этих систем является ключевой задачей молекулярной биологии XXI века.
Глава 1. Репликация – полимеразная реакция
Обнародуя свою модель структуры ДНК в 1953 г., Джеймс Уотсон и Фрэнсис Крик писали: «Мы не могли не осознавать, что специфическое спаривание оснований, постулированное нами, подразумевает наличие какого-то механизма копирования теистического материала». Они первыми заметили: «Если известен точный порядок оснований в одной из цепей, то можно записать и порядок оснований в другой, поскольку спаривание оснований специфично. Таким образом, одна цепь является комплементом другой; именно это свойство наводит на мысль, что ДНК может удваивать саму себя».
Уотсон и Крик предположили, что для удвоения ДНК должны произойти разрыв водородных связей, удерживающих вместе спиральный дуплекс, и расхождение нитей. Они также высказали мысль, что каждая нить дуплекса служит матрицей при синтезе комплементарной нити, и в результате образуются две пары нитей, в каждой из которых только одна является родительской. Таков механизм точного воспроизведения последовательности нуклеотидных пар в двойной спирали ДНК. Уотсон и Крик полагали, что репликация ДНК осуществляется спонтанно, без участия ферментов, но это оказалось неверно. Тем не менее, идея о том, что удвоение ДНК происходит путем последовательного соединения нуклеотидов в соответствии с правилом комплементарности, заданным каждой нитью спирали, разрешила концептуальную проблему точного воспроизведения генов.
Согласно общепринятой модели, репликация всех двунитевых ДНК полуконсервативна. Существуют ли в природе альтернативные способы репликации двунитевой ДНК (например, консервагивный или дисперсный) – неизвестно. Таким образом, после каждого события репликации одна нить в обеих дочерних молекулах является родительской, консервативной, а другая – новосинтезированной, дочерней. Именно такой механизм копирования и называется полуконсервативным. Если геном представлен однонитевой ДНК (как у некоторых вирусов), то эта единственная нить служит матрицей для образования комплементарной нити, с которой она образует дуплекс, а затем на этом дуплексе синтезируются либо дочерние дуплексы, либо однонитевые копии одной из матричных нитей.
Уотсон и Крик уже во второй своей работе 1953 г. предположили возможный механизм копирования наследственного материала. Легко представить, что цепи молекулы ДНК расходятся и каждая из них становится матрицей, на которой синтезируется новая комплементарная цепь. В результате образуются две дочерние двуспиральные молекулы ДНК, не отличимые от родительской молекулы.
В 1957 г. А. Корнберг обнаружил у бактерии Е. соli фермент, катализирующий процесс полимеризации ДНК из нуклеотидов – ДНК-полимеразу 1. В 1959 г. Артуру Корнбергу (А. Kornberg) была присуждена Нобелевская премия за открытие механизма биосинтеза ДНК. Он показал, что в основе удвоения молекул ДНК лежат обычные биохимические реакции.
В общем виде реакцию присоединения 5'-дезоксинуклеотидной группы к З'-ОН-группе концевого нуклеотида праймерной цепи можно представить следующим образом:
[dNMP]n + dNTP ↔ [dNMP]n+1 + РРi
где dNMP– любой из четырех обычных нуклеотидов. За один акт репликации нить, содержащая 3’-конец, удлиняется на один нуклеотидный остаток, при этом одновременно происходит удаление пирофосфата. Реакция присоединения нуклеотида обратима, но так как неорганический фосфат в клетках быстро разрушается, то реакция активно направлена в сторону синтеза. Репликация ДНК всегда идет от 5’– конца нити ДНК (то есть содержащего 5’-дезоксинуклеотидную группу) к 3’-концу (то содержащему свободную 3-ОН-группу) и нуждается в наличии ранее синтезированного фрагмета нити ДНК в качестве затравки для реакции полимеризации. Такой ДНК-фрагмент, имеющий свободный 3’-конец, называется праймером. Ферменты, катализирующие праймер-зависимую, детерминируемую ДНК-матрицей реакцию присоединения дезоксинуклеотидов, называются ДНК-полимеразами. К настоящему времени выделены и охарактеризованы несколько различных классов ДНК-полимераз, детально описаны свойства этих ферментов и реакции, которые они катализируют. Об их строении и индивидуальных особенностях мы подробно поговорим в следующих главах.
1.1. Вилка репликации
Процесс репликации происходит в специальных структурах, названных вилками репликации. Схематическое устройство репликативной вилки E.coli представлено на рис. 1. То, что две нити молекулы ДНК расположены антипараллельно друг другу, создает ряд проблем для их олдновременной разнонаправленной репликации.
По мере движения вилки одновременно должны синтезироваться две дочерние цепи. Вилка движется в направлении от 5' к 3’ на одной цепи и от 3’ к 5' – на другой. Однако нуклеиновые кислоты синтезируются только от 5'– к 3'-концу. Проблема решается таким образом, что на одной из родительских нитей новая нить синтезируется непрерывно в направлении 5'-3', что совпадает с движением вилки репликации. Это называется лидирующей или ведущей. Другая нить называется отстающей или запаздывающей, так как синтез на ней идет с некоторой задержкой по сравнению с лидирующей нитью. Это связано с тем, что ДНК на этой нити синтезируется также от 5' к 3', но в направлении, противоположном движению вилки, и короткими фрагментами. Благодаря этому разнонаправленный синтез ДНК может осуществляться в рамках одной структуры – репликативной вилки.

Рис. 1. Схема репликативной вилки.
Длина таких коротких фрагментов у прокариот составляет 1000–2000 пн. По имени открывшего их ученого они были названы «фрагментами Оказаки». По мере движения репликативной вилки концы соседних фрагментов Оказаки соединяются с образованием непрерывной отстающей нити. Для того, чтобы процесс на обеих нитях шел синхронно, полимеразные комплексы лидирующей и отстающей нити связаны между собой, образуя сложную трехмерную структуру (рис. 1, б)
Вилка репликации может двигаться как в одну сторону от точки начала репликации, так и в обе стороны. В зависимости от этого процесс называется однонаправленной или двунаправленной репликацией. Как это выглядит схематически, показано на рис. 2. У эукариот репликация обычно двунапраленная. Также и у E.coli.
Механизмы инициации репликации в точке начала репликации и при образовании фрагментов Оказаки в отстающей цепи в принципе аналогичны, хотя имеются некоторые тонкие различия. В обоих случаях происходит образование коротких РНК-затравок (праймеров), комплементарных матричной ДНК, в виде продолжения которых синтезируется новая цепь ДНК. В дальнейшем короткие вставки РНК замещаются сегментами ДНК, отдельные фрагменты Оказаки затем объединяются с образованием непрерывной отстающей нити.
Все живые организмы на Земле обычно делят на прокариот и эукариот (от греч. карион – ядро). Главной особенностью прокариот является отсутствие у них в отличие от эукариот полноценного клеточного ядра, покрытого оболочкой. Генетический материал прокариот расположен в нуклеоиде – примитивном эквиваленте ядра эукариот. Клетки прокариот имеют очень небольшие размеры – около 1 мкм. Объем эукариотических клеток в 800-1000 раз больше объема клеток прокариот. К прокариотам относятся бактерии и археи (или архебактерии), предки которых возникли около 4 млрд лет назад. Эукариоты могут быть как одноклеточными, так и многоклеточными. Они появились на Земле примерно через 500 млн лет после прокариот.
По современным представлениям ДНК-метаболизм у прокариот имеет некоторые отличия от такового у эукариот. Описывая процессы репликации и рекомбинации, мы будем каждый раз подчеркивать эти отличия.
Глава 2. Начало репликации
Репликация ДНК начинается не в любой случайной точке молекулы, а в специфических местах, называемых точками начала репликации или олриджинами. Процесс копирования продолжается через образование репликативных вилок в одном или обоих направлениях до тех пор, пока ДНК полностью не удвоится. В замкнутых кольцевых молекулах ДНК новосинтезированные цепи ковалентно соединяются в местах встречи увеличивающихся в размере репликативных вилок или в том месте, где единственная вилка возвращается к точке начала репликации. Дочерние молекулы, как правило, расходятся еще до начала нового раунда репликации.
Такие различающиеся по размеру геномы, как геном вируса SV40 (5,2тпн), бактериофага λ (48,5тпн) и Е. соli (4-103тпн), воспроизводятся в результате одного инициирующего события, происходящего в определенной точке.

Рис. 2. Возможное движение репликативной вилки.
У про– и эукариот можно встретить различные вариации на эту тему. Так, каждая из цепей родительской спирали митохондриальной ДНК животных (15тпн) имеет свою точку начала репликации. Синтез комплементарной цепи некоторых небольших однонитевых фаговых геномов начинается вблизи одной специфической последовательности, а репликация полученного дуплекса может инициироваться совсем в другой точке. Репликация линейных двунитевых ДНК также инициируется в особых сайтах. Например, ДНК бактериофага Т7 (40тпн) реплицируется в двух противоположных направлениях к разным концам молекулы, начиная от одной точки, а каждая из двух цепей ДНК аденовируса человека (30–38 тпн) реплицируется последовательно всегда от З'-конца.
Для геномов эукариотических клеток характерно наличие множественных точек начала репликации, разбросанных по хромосоме на расстоянии около 20тпн. После инициации репликация продолжается в двух направлениях от каждой точки до тех пор, пока репликативные вилки двух соседних точек начала репликации не сольются. Полноразмерные ДНК каждой дочерней хромосомы получаются путем соединения более коротких, независимо инициированных новосинтезированных нитей.
2.1. Понятие о репликоне и ориджине репликации
Участок ДНК, на котором синтезируется отдельный фрагмент лидирующей нити, называется репликоном. У многих прокариот их геном содержит только одну точку инициации репликации, то есть у них в ДНК только один репликон. Эукариотические геномы полирепликонны.
Место начала репликона, в котором происходит инициация репликации, носит название ориджина репликации. Именно ориджин распознается специальными белковыми комплексами и на нем начинается формирование вилки репликации.
В некоторых случаях место начала репликации имеет такую нуклеотидную последовательность, что дуплекс принимает необычную конфигурацию, которую распознают белки, участвующие в инициации. Природа взаимодействия между точкой начала репликации и белками и механизм инициации в целом исследованы недостаточно, однако можно сказать, что, по-видимому, они в разных случаях различны.
2.2. Ориждин репликации E.coIi oriC
Наиболее подробно изучены ориджины у Е. соli и Bacillus subtilis. Область начала репликации хромосомы, оriС (origin of chromosome), включает в себя участки со специфическими последовательностями, так называемыми ДНК-боксами, и расположенными между ними короткими последовательностями. ДНК-боксы со специфическим «мотивом» нуклеотидов, преимущественно в 9пн, перемежаются фрагментами в 12-1Зпн с высоким содержанием АТ. Сами девятичленные последовательности могут располагаться как в прямом, так и в инвертированном положении по отношению друг к другу. Например, у В. subtilis имеется один фрагмент ТТАТССАСА и два других девятичленных бокса, ориентированных в противоположном направлении, с заменой одной из пар нуклеотидов. Всего у В. subtilis на оriС расположено 15 ДНК-боксов. Область оriС очень консервативна: ДНК-боксы сходного состава имеются в соответствующем месте хромосомы у других бактерий (только у Mycoplаsma genitalium, несмотря на наличие общих для всех бактерий ферментов репликации, ДНК-боксов найдено не было). Сами ДНК-боксы не кодируют белок или РНК, хотя между ними располагаются отдельные гены. Продукты этих генов также большей частью вовлечены в «обслуживание» процесса репликации ДНК.
Порядок расположения ДНК-боксов, промежуточных областей и их количество позволяют думать, что эволюционная дивергенция oriС шла главным образом за счет дупликаций и трипликаций. Схема абстрактного «минимального ориджина» прокариот представлена на рис. 3.

Рис. 3. Организация минимального ориджина прокариот
Схема минимального ориджина прокариот.
2.3. Ориджины других организмов
Коровая часть ориджина репликации у вируса SV40 состоит из элемента опознания (ORE – origin recognition element), необходимого для связывания особого белка Т-антигена (Т-аg), элемента для связывания белка, расплетающего ДНК (DUE – DNA unwinding element), и элемента, обогащенного АТ-нуклеотидами. Участок, с которого вилка репликации начинает двигаться в противоположных направлениях, называется началом двунаправленной репликации (OBR – origin bidirectional replication).
Вспомогательные элементы (Aux) связывают димеры Т-антигена (Аux-1) и фактор транскрипции Sp1 (Аuх-2). Расстояние между этими элементами и их ориентация играют важную роль в процессе инициации репликации. Схема ориджина вируса SV40 представлена на рис. 4.
У эукариот гомологами ориджинов репликации являются автономно реплицирующиеся последовательности, или ARS (autonomously replicating sequences), открытые в 1980 г. Р. Дэйвисом и Дж. Карбоном.
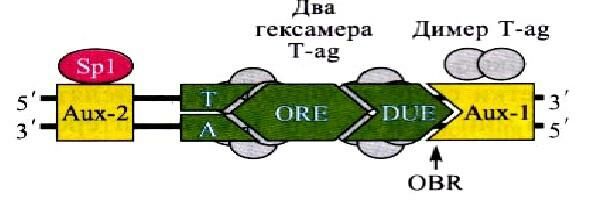
Рис. 4. Схема ориджина вируса SV40.
У дрожжей Saccharomyces cerevisiae особые последовательности, способные обеспечивать репликацию фрагментов ДНК в дрожжевой клетке были выделены раньше, чем у других эукариот. Позднее такие последовательности были найдены и у многих других организмов. У S.cerevisiae АRS занимает 100—200пн и содержит специфическую консенсусную последовательность (АСS – ARS consensus sequence), размером в 11пн, необходимую для связывания с белком-инициатором, а также дополнительные элементы (В-элементы), усиливающие функцию ориджина. Например, АRS1 – первый подробно охарактеризованный ориджин – содержит три таких элемента – В1, В2, ВЗ. Последовательности АCS и В1 занимают приблизительно 50пн и представляют собой наименьшую функциональную область любого ориджина, которая требуется для связывания с белком-инициатором.
Элемент В2 обычно содержит генетически охарактеризованный участок DUE. Вспомогательный элемент ВЗ связывает фактор транскрипции Abf-1. Общая длина ARS-элемента составляет 100-200пн. Строение ориждина S.cerevisiae представлено на рис. 5.
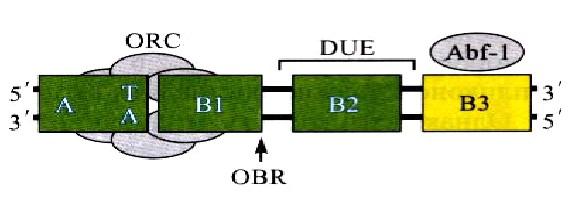
Рис. 5. Схема ориджина Saccharomyces cereiseae
У другого вида дрожжей, Shizosaccharomyces pombe, ориджины состоят по крайней мере из одной ARS, которая значительно длиннее, чем у S. cerevisiae. В некоторых случаях несколько ARS-элементов формируют зону инициации репликации. (Рис. 6.)

Рис. 6. Схема ориджина Shizosaccharomyces pombe
У млекопитающих ориджины детально не охарактеризованы, некоторые из них располагаются в межгенных промежутках, имеют сайты связывания для транскрипционных факторов, часто содержат только районы инициации двунаправленной репликации – OBR.
2.4. Скорость репликации
Скорость репликации генома регулируется в основном частотой инициирующих событий. Так, у Е. соli скорость копирования в каждой репликативной вилке постоянна и равна примерно 1500пн в секунду: следовательно, полный геном длиной 4·106пн реплицируется примерно за 40 мин. Если хромосома реплицируется быстрее, это значит, что увеличивается частота актов инициации в той же самой точке начала репликации при прежней скорости копирования. Клетки Е. соli делятся каждые 20 мин; это означает, что репликация ДНК инициируется в хромосомах, еще не закончивших предыдущий раунд репликации. Скорость движения репликативной вилки в эукариотических клетках значительно меньше (10-100пн в секунду), но завершение репликации хромосомы в разумное время обеспечивается одновременной инициацией во множестве точек. Итак, скорость репликации хромосом контролируется числом и расположением точек начала репликации. Например, в ранних эмбрионах дрозофилы репликация отдельной хромосомы осуществляется каждые 3 мин, благодаря почти одновременной инициации событий в точках, отстоящих друг от друга на 7000-8000пн. В тоже время известно, что у дрозофилы в ходе раннего эмбрионального развития, как скорость репликации, так и размеры и число репликонов тканеспецифичны. В культуре же соматических клеток той же дрозофилы скорость удвоения хромосом значительно более медленная, так как репликация начинается в гораздо меньшем числе точек, находящихся друг от друга на расстоянии 40000пн, при этом продолжительность S-фазы составляет 600 мин. Следовательно, при фиксированной скорости синтеза ДНК множественная инициация повышает скорость процесса репликации в целом и таким образом уменьшает время, необходимое для удвоения всего набора хромосом. Данные о числе репликонов и скорости репликации приведены в табл.1.
Различия в продолжительности S-фазы найдены и у других организмов. Например, у тритона S-фаза длится 1 ч в ядрах бластулы и 200 ч в предмейотической S-фазе сперматоцитов. Вероятно, длительность S-фазы определяется не скоростью синтеза ДНК, а числом задействованных ориджинов репликации. В ДНК клеток нейрулы тритона они находятся на расстоянии около 40 мкм друг от друга, а в соматических клетках – около 100 мкм.
Таблица 1
Число и длина репликонов у разных организмов.


В соответствии с современными представлениями репликоны у эукариот распределены в геноме не случайно, они расположены группами (replicon foci). В этих группах, или фокусах, собираются ферменты репликации, которые удлиняют вилки репликации одновременно 10-100 соседних репликонов длиной примерно по 100тпн каждый. Репликация в них завершается за 45–60 мин. Кроме этого существуют очень длинные репликоны (более 1000тпн) – столь большие, что репликация в них продолжается по нескольку часов.
Активация ориджинов репликации происходит на протяжении всей S-фазы. Например, АRS1 S.cerevisiae активируется в ранней, а АRS501 – в поздней S-фазе. Большинство ориджинов активируется в середине S-фазы. Интересно отметить, что участки хромосом S.cerevisiae, реплицирующиеся в ранней или поздней S-фазе, располагаются мозаично, то есть перемешаны. У S.cerevisiae было обнаружено, что центральная область хромосомы IV реплицируется в ранней, а теломеры – в поздней S-фазе. Участок ДНК размером 67тпн, прилежащий к теломере на правом конце хромосомы V и содержащий АRS501, реплицируется в поздней S-фазе. По-видимому, поздняя репликация этого участка хромосомы является следствием его соседства с теломерой. Кроме того, известно, что в конце S-фазы реплицируются "молчащие" гены, например неэкспрессирующиеся в определенных типах клеток локусы НМL и НМR, которые локализованы в субтеломерных областях. Активно экспрессирующиеся гены, например локус МАТ, напротив, реплицируются в первой половине S-фазы.
Глава 3. Инициация репликации
Ориджины репликации являются местом, с которого начинает свое движение репликативная вилка. Но ДНК-полимеразы не могут начать процесс репликации без помощи других белков. Белки, участвующие в распознавании ориджина и спсобствующие привлечению к нему праймазы – РНК-полимеразы, синтезирующей праймер, «затравку» для синтеза ДНК – и ДНК-полимеразы, образуют комплекс инициации репликации.
3.1 Инициация репликации у E.coli
Инициация репликации в оriС в системе in vitro начинается с формирования комплекса, в состав которого входят шесть белков: DnaА, DnaВ, DnaС, НU, Girase и SSВ. Сначала с девятичленной последовательностью связывается мономер DnaА, затем 20–40 мономеров этого белка формируют большой агрегат. ДНК ориджина опоясывает его, и цепи ДНК разъединяются в области трех тринадцатичленных последовательностей. На следующем этапе димер DnaВ/DпаС присоединяется к комплексу oriС/DnaА, формируя агрегат размером около 480 кДа, соответствующий сфере с радиусом 6 нм. В результате формируется вилка репликации.
3.2. Инициация репликации у эукариот
Инициация репликации ДНК эукариот начинается с образования комплекса ориджина репликации и белка-инициатора репликации. Этот комплекс называется пострепликативным (роst.-RС). Он служит платформой для сборки структур более высокого порядка, которые переводят хроматин в состояние, компетентное для репликации. Последовательные стадии образования комплексов инициации репликации показаны на рис. 7.
Белком-инициатором репликации ДНК в клетках эукариот является ОRС (origin recognition complex), который впервые был описан у S.cerevisiae. Впоследствии ORC-подобные белки были обнаружены и изучены и у других представителей эукариот, а также у млекопитающих и человека. У всех эукариот ОRС образован шестью субъединицами – Огс1-Огсб (120-50 кДа). Для жизнедеятельности S. cerevisiae существенны все шесть субъединиц комплекса. Две разные группы субъединиц ОRС участвуют в распознавании последовательностей ориджина при его связывании с ориджином репликации. Огс1, Огс2 и Огс4 взаимодействуют с АСS, остальные три субъединицы распознают B1– подобные элементы. Возможно, что связь с нуклеотидными последовательностями В1 осуществляет только Огс5. ОRС специфически связывается с ДНК только в присутствии АТР и обладает АТР-азной активностью, которая регулируется координированным взаимодействием белка с АТР и элементами АRS. АТР связывается с субъединицей Огс1 и играет роль кофактора, необходимого для присоединения ОRС к ориджину. Специфическая последовательность ориджина, связавшегося с ОRС, ингибирует АТРазную активность Огс1, в то время как однонитевые участки ДНК, появляющиеся в S-фазе, ее снова активируют. При этом меняется конформация ОRС – с вытянутой (ехtended) на изогнутую (bеnt). Возможно, связывание и гидролиз АТР субъединицей Огс1 участвуют в контролировании функций ОRС в клеточном цикле.


