
Полная версия
Коллоидная химия. Шпаргалка
1) малой концентрации дисперсной системы;
2) малом размере частиц (отношение длины волны падающего света formula к радиусу частицы r не менее 10);
3) изометричной форме частиц.
8. Поглощение света дисперсными системами, уравнение Бугера-Ламберта-Бера. Определение размеров коллоидных частиц
Уравнение Рэлея справедливо для монодисперсных разбавленных коллоидных растворов при размерах частиц дисперсной фазы r < 40–70 нм. Более общие выводы о рассеянии света, справедливые для систем всех степеней дисперсности, сформулированы в теории Г. Ми. В данной теории учитывается, что при больших размерах частиц картина рассеяния света осложняется возникающими электрическими и магнитными полями. Максимум рассеяния согласно Г. Ми имеет место при размерах частиц около 0,25λ, где λ – длина волны видимой части спектра.
Явления рассеяния и поглощения света связаны также с такими свойствами, как окраска растворов, концентрация растворенного вещества. Поглощение света имеет избирательный характер. Поглощение света для молекулярных растворов определяется по уравнению Бугера-Ламберта-Бера:
I = I0 e — kcδ,
где I и I0 – интенсивность падающего света и света, прошедшего через раствор; k – коэффициент поглощения, зависящий от природы растворенного вещества и длины волны; c – концентрация поглощенного вещества; d – толщина слоя раствора.
Из данного уравнения можно вывести соответствующие уравнения для определения относительной прозрачности и относительного поглощения:
I / I0= e — kcδ;
(I0 – I) / I0 = 1 – e — kcδ.
Для коллоидных растворов в уравнение Бугера-Ламберта-Бера вносят поправку, которая необходима для учета рассеяния света. Количество рассеянного света эквивалентно дополнительному количеству поглощенного света. В связи с этим приведем модифицированную формулу, в которой учитывается явление светорассеяния:

где v – объем коллоидной частицы.
Из последнего уравнения можно вывести формулу для расчета размеров коллоидной частицы. Предположим, что частица имеет правильную сферическую форму.
Тогда радиус этой частицы будет определяться так:
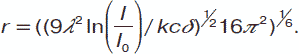
Эмпирически радиус частицы в жидком растворе можно определить методом ультрамикроскопии. Для этого при помощи микрометрической окулярной шкалы выделяют определенный объем коллоидного раствора, в котором визуально подсчитывают количество коллоидных частиц. Если известна масса частицы, то, учитывая плотность диспергированного вещества, можно определить объем и размеры частицы.
Поскольку ультрамикроскоп позволяет косвенно судить о форме коллоидных частиц, то необходимо принять во внимание две формулы. Если форма частицы представляет собой куб, то справедливо, что

если частица представляет собой сферу, то
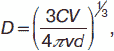
где С – массовая концентрация коллоидного раствора; V – выделенный оптический объем; v – число частиц в объеме V; L – ребро куба; D – диаметр сферы.
9. Поверхностные явления. Роль поверхностных явлений в процессах, протекающих в дисперсных системах
Своеобразие дисперсных систем определяется большой удельной поверхностью дисперсной фазы и физико-химическим взаимодействием дисперсной фазы и дисперсионной среды на границе раздела фаз. C повышением дисперсности вещества все большее значение имеют его свойства, определяемые поверхностными явлениями, т. е. совокупностью процессов, происходящих в межфазовой поверхности. Эти свойства обусловлены избытком свободной энергии поверхностного слоя, особенностями его структуры и состава.
Поверхностные явления могут иметь физический характер или сопровождаться химическими превращениями; они протекают на жидких (легкоподвижных) и твердых межфазных границах. Поверхностные явления, связанные с действием поверхностного натяжения и вызываемые искривлением жидких поверхностей раздела, называются также капиллярными явлениями. К ним относятся:
1) капиллярное всасывание жидкостей в пористые тела;
2) капиллярная конденсация, установление равновесной формы капель;
3) установление газовых пузырей;
4) установление менисков.
Свойства поверхности контакта двух твердых тел или твердого тела с жидкой и газовой средами определяют условия таких явлений, как адгезия, смачивание, трение.
Молекулярная природа и свойства поверхности могут коренным образом изменяться в результате образования поверхностных мономолекулярных слоев или фазовых (полимолекулярных) пленок. Такие изменения часто происходят вследствие физических процессов (адсорбции, поверхностной диффузии, растекания жидкости) или химического взаимодействия компонентов соприкасающихся фаз. Любое «модифицирование» поверхностного (межфазного) слоя обычно приводит к усилению или ослаблению молекулярного взаимодействия между контактирующими фазами. Физические или химические превращения в поверхностных слоях сильно влияют на характер и скорость гетерогенных процессов – коррозионных, каталитических, мембранных и др. Поверхностные явления отражаются и на типично объемных свойствах тел. Так, уменьшение свободной поверхностной энергии твердых тел под действием адсорбционно-активной среды вызывает понижение их прочности (эффект Ребиндера).
Особую группу составляют поверхностные явления, обусловленные наличием в поверхностном слое электрических зарядов:
1) электроадгезионные явления;
2) электрокапиллярные явления;
3) электродные процессы.
Поверхностные явления имеют место в любой гетерогенной системе, состоящей из двух или нескольких фаз, поэтому их роль в природных и технологических процессах чрезвычайно велика. Во взаимосвязи броуновского движения и поверхностных явлений протекают все процессы, приводящие к изменению размеров частиц высокодисперсной фазы (коагуляция, коалесценция, пептизация, эмульгирование). В грубодисперсных и макрогетерогенных системах на первый план выступает конкуренция поверхностных сил и внешних механических воздействий. Поверхностные явления, влияя на величину свободной поверхностной энергии и строение поверхностного слоя, регулируют зарождение и рост частиц новой фазы в пересыщенных парах, растворах и расплавах, взаимодействие коллоидных частиц при формировании разного рода дисперсных структур. На глубину и направление процессов, обусловленных поверхностными явлениями, часто решающим образом влияют ПАВ, меняющие в результате адсорбции структуру и свойства межфазных поверхностей.
10. Поверхность раздела фаз. Свободная поверхностная энергия. Поверхностное натяжение. Адсорбция
Свойства участка фазы, примыкающего к поверхности раздела фаз, отличаются от свойств фазы в объеме: частицы на поверхности каждой фазы образуют особую поверхностную фазу, свойства которой отличаются от свойств внутренних областей фазы. Частицы на поверхности находятся в другом окружении по сравнению с частицами, находящимися в объеме фазы, т. е. взаимодействуют как с однородными частицами, так и с частицами другого рода. Поэтому средняя энергия gs частицы на поверхности раздела фаз отличается от средней энергии такой же частицы в объеме фазы gv (причем энергия частицы на поверхности может быть как больше, так и меньше энергии частицы в объеме). Характеристикой поверхностной фазы является поверхностная энергия Gs – разность средней энергии частицы, находящейся на поверхности, и частицы, находящейся в объеме фазы, умноженная на число частиц на поверхности Ns:
Gs = N (gs – gv).
Очевидно, что общая величина поверхностной энергии фазы будет определяться величиной ее поверхности S. Поэтому для характеристики поверхности раздела, отделяющей данную фазу от другой вводится понятие поверхностного натяжения δ – отношение поверхностной энергии к площади поверхности раздела фаз:

Как и поверхностная энергия фазы, поверхностное натяжение может иметь положительное или отрицательное значение. Оно положительно, если находящиеся на поверхности частицы взаимодействуют с частицами этой же фазы сильнее, чем с частицами другой фазы (и, следовательно, gs > gv). Согласно принципу минимума свободной энергии любая фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию, поэтому в случае положительного поверхностного натяжения (δ > 0) фаза стремится уменьшить свою поверхность. Если δ < 0, поверхностная энергия фазы будет уменьшаться при увеличении площади поверхности. Влияние поверхностного слоя фазы на ее свойства определяется долей частиц, находящихся на поверхности, от общего числа составляющих данную фазу частиц, т. е. величиной удельной поверхности фазы S/V (поверхности, приходящейся на единицу объема). Свободную энергию фазы G можно представить как сумму поверхностной Gs и объемной Gv энергий, пропорциональных площади поверхности и объему фазы:
G = Gs + Gv = δS + KV.
Разделив это выражение на объем фазы, получаем:

Из последнего уравнения следует, что при неизменном объеме фазы вклад поверхностной энергии в общую энергию фазы возрастает с увеличением удельной поверхности или степени дисперсности фазы. Если степень дисперсности фазы невелика, вкладом поверхностной энергии в полную энергию фазы обычно пренебрегают. Вклад поверхностного слоя в свойства фазы и системы учитывают при изучении дисперсных систем – гетерогенных систем, одна из фаз которых является сплошной (дисперсионная среда), а другая – раздробленной (дисперсная фаза).
На границе конденсированной фазы с газом поверхностное натяжение всегда положительно, поскольку частицы конденсированной фазы взаимодействуют друг с другом сильнее, чем с молекулами газа. Конденсированная фаза будет стремиться уменьшить свою поверхностную энергию, уменьшая либо площадь поверхности фазы (поэтому капля жидкости в невесомости принимает форму сферы), либо поверхностное натяжение. Процесс самопроизвольного изменения концентрации вещества у поверхности раздела двух фаз называется адсорбцией.
11. Термодинамическое описание разделяющей поверхности
Разделяющая поверхность – это геометрическая поверхность, которая воспроизводит форму поверхности разрыва и располагается параллельно последней. Если представить идеализированную систему в которой каждая из интенсивных величин имеет характерные для данной объемной фазы значения, и сравнить ее с реальной системой, то получим, что разности соответствующих экстенсивных параметров в данных системах представляют собой поверхностные избытки. Например, состав поверхностного слоя определяется избыточным числом молей компонентов nis.
Для нахождения последнего необходимо рассмотреть изменение концентрации компонента системы вдоль нормали, направленной из одной фазы в другую. В реальных системах данное изменение выражается функцией С (x), которая представляет собой кривую и имеет постоянные величины в глубине фаз. В идеализированной системе данная функция представлена двумя прямыми, доходящими до разделяющей поверхности. Состав поверхностного слоя будет выражен формулой:

где nis – избыток количества вещества в поверхностном слое; xb и xa – объемы разделяемых фаз;
Cb и Ca – концентрация вещества в реальной и идеализированной системах; s – площадь поверхности раздела.
Итак, параметр nis выражает избыток компонента, связанный со «сгущением» интенсивного параметра в области поверхностного слоя, – концентрации С. Аналогично в виде избытков выражаются все термодинамические функции поверхностного слоя. Так, энергия поверхностного слоя определяется как разность ее значений в реальной и идеализированной системах:
Us = U – (Uα + Uβ)
или
U = Us + Uα + Uβ.
Члены правой части этих выражений различаются тем, что Uα и Uβ являются полными количествами энергии в двух объемных фазах, а Us представляет собой поверхностный избыток.
Аналогичные выражения записывают для других термодинамических функций: энтальпии, энтропии свободных энергий Гельмгольца и Гиббса.
Достоинством данного метода описания поверхностного слоя является отсутствие необходимости уточнения его границ. Функции, выражающие избытки, являются инвариантными в отношении толщины поверхностного слоя, однако они зависят от положения разделяющей поверхности.
Поверхностный слой может подвергаться воздействию изменений температуры и состава. Поэтому необходимо принять во внимание в качестве переменных поверхностные энтропию Ss и состав ns, в результате будет получено фундаментальное уравнение для энергии разделяющей поверхности:
dU s = T sdSs + σds + Σμs dns,
где dUs – внутренняя энергия поверхностного слоя Ts – температура разделяющей поверхности;
Ss – энтропия поверхностного слоя; s – коэффициент пропорциональности, численно равный поверхностному натяжению; s – площадь поверхностного слоя; ms – химический потенциал поверхностного слоя; ns – состав поверхностного слоя.
Данное уравнение находят путем вычитания уравнений для двух объемных фаз из выражения для внутренней энергии U всей системы. Согласно теории Гиббса для плоского поверхностного слоя последнее уравнение справедливо при любом положении разделяющей поверхности; для искривленной поверхности к нему добавляются члены, связанные с кривизной.
12. Адсорбция. Площадь, приходящаяся на одну молекулу в адсорбционном слое
Адсорбция (от лат. ad – «на, при» и sorbeo – «поглощаю») – это поглощение вещества из газообразной среды или раствора поверхностным слоем жидкости или твердого тела, следствием которого является самопроизвольное концентрирование веществ вблизи поверхности раздела фаз. Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а поглощаемое из объемной фазы вещество – адсорбатом. После адсорбции внутреннее притяжение частично компенсируется притяжением со стороны адсорбционного слоя, и поверхностное натяжение уменьшается. Слой жидкости, который прилегает к поверхности и равен по толщине радиусу сферы молекулярного взаимодействия, называется поверхностным слоем. Молекулы жидкости в поверхностном слое находятся под действием сил притяжения соседних молекул. Равнодействующая этих сил притяжения направлена в глубь жидкости, передвижение молекул из глубины жидкости в поверхностный слой требует затрат работы на преодоление сил межмолекулярного сцепления (когезии). Работа, выполняемая для увеличения поверхности жидкости на единицу, называется поверхностным натяжением. Поверхностное натяжение можно рассматривать как силу, которая действует на единицу длины контура, который ограничивает поверхность и пытается ее сократить по нормали к касательной к поверхности. Поверхностное натяжение измеряется в Дж/м2 или Н/м. Работа по образованию новой поверхности, которая происходит в условиях изотермического или обратимого процесса (максимальная работа), осуществляется за счет изменения изохорно-изотермического потенциала.
Для единицы поверхности (S):
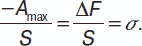
Поверхностное натяжение представляет собой свободную энергию единицы поверхности. Запас свободной поверхностной энергии гетерогенной системы с межфазной поверхностью раздела S: F = σ х s. Самопроизвольное стремление к уменьшению F системы может быть реализовано или путем уменьшения межфазной поверхности (например, при коагуляции), или за счет уменьшения поверхностного натяжения раствора. Если растворенное вещество способно уменьшать поверхностное натяжение раствора, то оно будет концентрироваться (адсорбироваться) на поверхностном слое. Эти вещества называют поверхностно-активными веществами (ПАВ). Связь между адсорбцией и поверхностным натяжением выражается уравнением Гиббса:

где Г – удельная адсорбция растворенного вещества в моль/м2, т. е. избыточная концентрация растворенного вещества в поверхностном слое раствора в сравнении с его объемной концентрацией с; s – поверхностное натяжение раствора, Дж/м2; R – универсальная газовая постоянная; Т – температура, К.
Производная (изменение поверхностного натяжения с концентрацией) называется поверхностной активностью растворенного вещества. Такие вещества называются поверхностно-инактивными веществами (ПИАВ). Изменение поверхностного натяжения по сравнению с поверхностным натяжением растворителя описывается эмпирическим уравнением Шишковского:
σ0 – σ = B ln(1 + Ac) < 0, где А и В – эмпирические константы. Продифференцировав, имеем:
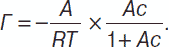
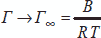
S = 1 / Г∞N.
13. Хроматографический адсорбционный анализ
Явление адсорбции получило широкое применение. Одним из способов использования данного явления является хроматография. Хроматографический адсорбционный анализ был разработан русским ученым М. С. Цветом. Сущность метода заключается в следующем: через слой адсорбента пропускают раствор, содержащий несколько веществ. Отдельные вещества в растворе обладают различной способностью к адсорбции, поэтому они располагаются в разных частях адсорбционного слоя. Вещества, которые обладают большим сродством к адсорбенту, задерживаются в верхней части слоя, вещества с меньшей адсорбируемостью располагаются ниже. В результате происходит разделение сложной смеси на отдельные составные компоненты.
Методом хроматографического адсорбционного анализа впервые был разделен пигмент растительного листа. Пигмент образуют хлорофилл, ксантофилл и каротин. Путем повторной хроматографии хлорофилл был также разделен на хлорофилл а и хлорофилл б. Зеленый пигмент был извлечен низкокипящим бензином, полученный элюат был отфильтрован измельченным углекислым кальцием. После фильтрации в колонке наблюдалось образование различно окрашенных слоев, которые называются хроматограммой. Слои могут перекрывать друг друга или быть отделенными.
В адсорбционной хроматографии принято различать два ее основных вида: молекулярную хроматографию и ионообменную хроматографию. В первом случае имеет место различная адсорбируемость молекул различных веществ, во втором – неодинаковая адсорбируемость различных ионов.
Ионообменная хроматография основана на способности сорбентов не только поглощать, но и обменивать поглощенные ими компоненты на другие, которые находятся в жидкой среде. К таким сорбентам следует отнести гидросиликаты (цеолиты и пермутиты), а также ионообменные смолы, или иониты. Иониты обладают ограниченной набухаемостью, практически нерастворимы в воде. Частицы ионообменных смол состоят из неподвижного аниона (катиона) и подвижного катиона (аниона). Последние способны обмениваться на другие подвижные ионы. Обмен ионов сорбента и раствора происходит в эквивалентных соотношениях. Если подвижные ионы являются катионами, то ионит называют катионитом, если, наоборот, подвижностью обладают анионы, то ионит является анионитом. Существуют также биполярные иониты, или амфолиты, они проявляют свойства катионитов и анионитов. Метод ионной хроматографии может применяться для изучения сложных природных объектов, составными частями которых являются вещества, находящиеся в коллоидном состоянии. Одним из таких объектов является почва. Как правило, почвенные коллоидные частицы заряжены отрицательно, поэтому имеет место катионный обмен. При движении почвенной влаги наблюдается разделение катионов, встречающихся в почве. Анализируя почвенные хроматограммы, удалось глубже понять сущность происходящих процессов. Так, например, при образовании подзолистых почв имеет место закрепление ионов водорода в верхних частях, а катионы щелочно-земельных металлов проникают в нижние слои почвы. Таким образом, верхние слои почвы закисляются. Достоинство метода хроматографии является возможность разделять сложные смеси, не меняя химический состав компонентов. Это важно при исследовании биологических жидкостей, содержащих малоустойчивые органические соединения, состав и строение которых зависят от незначительного изменения температуры, кислотности и других факторов. Хроматографический анализ применяется для выделения из растворов веществ, концентрация которых очень мала: гормонов, интерферонов, витаминов и др. Этот метод позволяет разделить сходные по своим свойствам вещества, разделение которых химическими методами представляет собой большие трудности (аминокислоты, редкоземельные металлы).
Конец ознакомительного фрагмента.
Текст предоставлен ООО «ЛитРес».
Прочитайте эту книгу целиком, купив полную легальную версию на ЛитРес.
Безопасно оплатить книгу можно банковской картой Visa, MasterCard, Maestro, со счета мобильного телефона, с платежного терминала, в салоне МТС или Связной, через PayPal, WebMoney, Яндекс.Деньги, QIWI Кошелек, бонусными картами или другим удобным Вам способом.

