
Полная версия
Основы химии: атомы, молекулы, связи, реакции… Кратко, точно, научно и доходчиво

Основы химии: атомы, молекулы, связи, реакции…
Кратко, точно, научно и доходчиво
Игорь Владиславович Казаринов
© Игорь Владиславович Казаринов, 2024
ISBN 978-5-4498-6040-8
Создано в интеллектуальной издательской системе Ridero
Самый краткий теоретический курс химии
Это книга для тех, кто хочет понять основы химии для использования в обычной жизни, для твёрдого понимания и усвоения основных понятий и законов химии, а также для уверенной и спокойной учёбы в школе.
Книгу можно использовать как очень простой и понятный справочник по основным химическим словам и понятиям. Для лучшего понимания заходите на мой постоянно пополняемый видеоканал «Понятное и достойное образование. Математика, физика, химия» на Яндекс Дзен с доходчивыми видео и статьями по проблемам обучения вообще и с объяснениями разных понятий и законов точных наук – химии, физики, математики.
Основная трудность при обычном изучении химии
Школьные учебники написаны часто по средневековому принципу – сначала много рассказывается о свойствах конкретных веществ, а потом начинают вводить теорию, из которой есть какие-то исключения и именно на них фиксируют внимание школьника. Второй момент – очень много внимания уделяется технике безопасности, которая не особо нужна обычному человеку. К примеру – почему нельзя приливать воду к серной кислоте…
В результате у учеников нет идеи, что химия – это точная наука, основанная на точных законах, которые изучаются в физике. И нет системного закономерного подхода к химии, а есть идея, что надо много зубрить и запоминать.
В этой книге я хочу дать кратко научные основы химии, взятые из точных формул и законов физики. Чтобы читатели понимали теорию и могли как-то предсказывать некоторые явления на основе точных законов. А разные исключения, для которых обычно давно есть точное «оправдание», можно оставить для профессионалов-химиков, которые будут со всем этим работать на практике и которым надо всегда получать результаты.
Для примера: что происходит, когда мы роняем ключи? Мы их ищем на полу, и никто не поднимает глаза к потолку. Потому что с рождения привыкли, что всё падает вниз. Но когда ребёнку впервые дают шарик с гелием, и тот летит вверх, то удивлению нет предела. Хотя, зная хорошо законы физики, этот случай легко объяснить.
Граница между физикой и химией
Слово «физика» по-гречески означает «природа». Это была первая наука, которая изучала природу. Химия тоже изучает разные явления вокруг нас. И тоже изучает вещества. В чём же разница? Например, воду изучает и физика, и химия. Если мы нагреем воду, она закипит и превратится в пар, когда пар остынет, он опять станет водой. Такой же, какая была до нагрева.
Такие превращения веществ изучает физика, они называются физическими.
Если же мы возьмём сырое яйцо и нагреем его, то оно перестанет растекаться, а его белок станет из прозрачного белым. И после охлаждения таким и останется. И никакими средствами у вас не получится превратить его опять в жидкое яйцо. Это пример химического превращения.
То есть, физика изучает легко обратимые превращения, когда вещество меняет вид или форму, но не меняет своего состава, а химия изучает превращения, когда из одного вещества получается совсем другое, у которого свойства отличаются.
На чем построена современная химия. Основные понятия простым языком со ссылками на видео
Химия началась с изучения изменений разных веществ вокруг нас – с горения веществ – одни горят, другие нет – почему? Одни съедобны, другие ядовиты; одни надо варить, другие лучше жарить, некоторые солить, сушить, а некоторые можно есть и пить без обработки. Молоко превращается в кефир, сыр и т. п. – это химия, из песка получается стекло – это химия, из минералов выплавляют железо – это химия.
Вокруг нас очень много химии и пока не были открыты законы строения и взаимодействия веществ, изучение химии было строго экспериментальным – люди смешивали, нагревали, плавили и растворяли самые разные вещества и смотрели – что получается. За века накопилось огромное количество таких наблюдений. Сейчас, например, известно более 6 миллионов различных веществ. У каждого – свои особенности, некоторые похожи друг на друга, некоторые очень сильно отличаются.
Но несмотря на несхожесть, все вещества подчиняются физическим и химическим законам и ведут себя в соответствии с ними. Далее вы узнаете о самых основных законах, которые объясняют поведение и свойства веществ. О некоторых исключениях, про которые говорится в школьных учебниках, я кратко упомяну, но не буду подробно объяснять – для желающих в учебниках есть все объяснения.
В школе изучают неорганическую химию и органическую – это исторические названия. Опыты средневековых химиков показывали, что некоторые вещества получаются только при переработке растительных или животных организмов – такие вещества назвали органическими и науку, которая изучала их свойства, назвали органической химией.
А другие вещества можно было получить из камней, воды и воздуха, то есть из неживой природы – такие вещества назвали неорганическими. Соответственно, их изучает неорганическая химия.
Вещество
Из вещества состоят все предметы вокруг нас – столы, мороженное, вода, воздух. Всё что мы можем видеть и ощущать. Вещества бывают разными: жидкими, твёрдыми или газообразными. Вещества имеют разный цвет, вкус и запах и другие различные свойства.
Есть ли в них что-то общее? Как сильно можно измельчать вещество? Например, мука мельче песка. А можно ли измельчить частичку муки?
Смотрели ли вы в микроскоп когда-нибудь? У микроскопов бывают разные увеличения, но даже в самый сильный микроскоп нельзя увидеть – из чего состоит вода, какая самая маленькая частица воды. В обычных микроскопах можно увидеть бактерии, но бактерии состоят из атомов, как дома состоят из кирпичей и разница в размерах примерно такая же.
Есть ли предел измельчению?
Ещё в Древней Греции и Индии несколько тысяч лет назад появилась идея, что вещество состоит из очень маленьких неделимых частиц. По-гречески такую частицу назвали «атом». По-гречески «а-» отрицательная приставка, корень «том» – означает «резать, делить», то есть слово атом переводится как «неделимый».
Но обнаружить самими атомы и узнать их строение учёные смогли всего около 100 лет назад.
Таблица Менделеева. Атом. Химический элемент
Дмитрий Иванович Менделеев открыл периодический закон, не зная устройства атомов. В дальнейшем физики открыли формулы, по которым строятся атомы, которые полностью подтвердили периодическую систему элементов. Возможно даже, что учёные-физики пользовались таблицей Менделеева как подсказкой для исследований.
Кстати, слово «элемент» имеет несколько различных значений, которые лучше выяснить в хорошем толковом словаре. В химии «элементами» называют виды атомов.
В современном виде таблица Менделеева включает много данных об устройстве элементов и их электронных оболочек, свойствах атомов и данных о их часто применяемых соединений – оксидах и гидридах. Не говоря уже об атомной массе элементов! Поэтому очень полезно понять – как и что можно найти в этой таблице и как можно её использовать в жизни и на уроках химии.
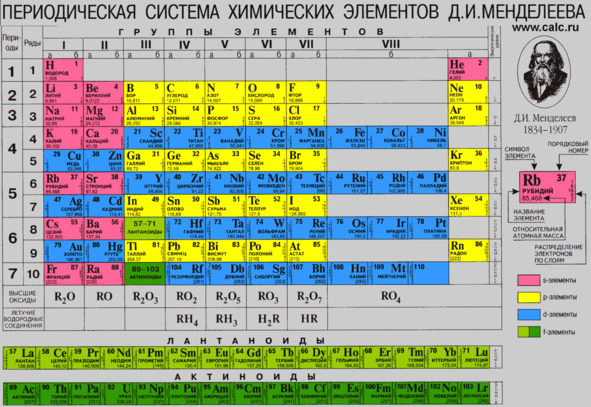
Обычно в правом верхнем углу таблицы напечатана отдельная клетка таблицы (чаще всего это клеточка с водородом, на этом рисунке – с рубидием). Вокруг этой клетки написаны краткие расшифровки разных чисел и надписей со стрелками, показывающими на отдельные части клетки. Я расскажу об этом подробнее:
1) Порядковый номер элемента. Он стоит в левом или правом верхнем углу. Начинается таблица с самого лёгкого элемента – водорода под номером 1. Дальше номера увеличиваются на единицу без пропусков и дробных номеров между ними. Когда Менделеев обнародовал первый вариант таблицы, он оставил в ней пустые места – несколько элементов ещё не были обнаружены. Учёный предсказал свойства неоткрытых элементов, и когда их открыли, предсказания подвердились!
Позднее выяснилось, что порядковый номер равен числу протонов в ядре соответствующего элемента. Про протоны и ядра будет рассказано чуть позже.
2) Символ элемента – сокращённое до одной или до двух латинских букв название элемента. Символы элементов и их названия в формулах едины во всём мире, что позволяет всем химикам легко понимать друг друга. (Но не касается обычных названий элементов в жизни! Они могут сильно отличаться: например, название «ртуть» – русское, по-английски mercury, а в формулах произносится всеми химиками «гидраргирум» – это латинское название из средневековых книг. Кстати, переводится как «жидкое серебро». )
Поэтому для успешного изучения химии надо выучить символы основных (самых часто используемых) элементов и то, как они читаются в формулах. Это пригодится и в жизни, так как в школьном учебнике химии в основном изучаются самые часто применяемые в жизни элементы – около 25 из более чем 100 в таблице Менделеева.
3) Русское название элемента.
4) Относительная атомная масса – число, которое показывает, во сколько раз атом элемента тяжелее атома водорода. Надо понимать, что эта масса не в граммах или килограммах, а можно сказать – в атомах водорода.
5) В этой таблице также указано распределение электронов в атоме по слоям. Про слои электронов будет рассказано позже. Эти числа могут помочь при решении некоторых задач, но они печатаются не во всех таблицах химических элементов.
6) Ещё один вид данных даётся в цвете, которым напечатана клетка элемента. Здесь разными цветами показано, какой вид электрона (4 возможных вида электронов обозначаются маленькими латинскими буквами s, p, d, f) последним добавлялся в атом. Об этом тоже будет подробнее рассказано позже.
Вообще, таблица Менделеева – очень важный и полезный справочник, в котором есть и другие данные, кроме указанных. Вы можете видеть также обозначения групп и периодов, и две строчки внизу таблицы «Высшие оксиды» и «Летучие водородные соединения» – эти данные тоже помогают при решении некоторых задач.
Строение атома. Три «кита», на которых строится атом – протон, нейтрон и электрон
Протон по-гречески означает «первый» и это основная частица химического элемента. Заряд протона равен +1 и его масса равна 1 (можно сказать, что масса протона принята за единицу). Если в атоме изменяется число протонов (что происходит чрезвычайно редко – только в ядерных реакциях, которые изучает ядерная физика, а химия ими не занимается), то автоматически меняется порядковый номер элемента и мы получаем уже другой элемент с другим названием и другими химическими свойствами. Но в огромном большинстве атомов такого не происходит и они остаются неизменными практически бесконечное время. Так что зная, что у кислорода порядковый номер 8, можно уверенно сказать, что в атоме кислорода 8 протонов, у которых суммарный заряд +8 и масса 8 единиц.
Раз я упомянул протон, то надо рассказать и ещё о двух частицах, из которых состоят все атомы, а значит и всё вещество вокруг нас! Это электрон и нейтрон. Нейтрон означает по-гречески «ни тот, ни другой», потому что нейтрон не имеет заряда. Его заряд равен 0. Масса нейтрона равна 1, то есть массе протона (на самом деле их массы отличаются, но совсем немного, и для химии их считают равными 1, а малюсенькое различие используют физики в своих вычислениях).
Протоны и нейтроны вместе образуют ядро атома, которое имеет размеры примерно в 10000 раз меньше, чем величина самого атома. Это примерно такая же разница, как между размером стадиона типа Лужников и футбольным мячом. То есть почти вся масса атома находится в «футбольном мяче», а легкие электроны создают объём «стадиона».
Ядро имеет положительный заряд, равный сумме зарядов протонов (или что тоже самое – числу протонов в ядре), и массу, равную числу протонов и нейтронов, так как масса каждого считается равной 1.
Электрон по-гречески означает «янтарь». Это потому, что ещё пару тысяч лет назад древние греки обнаружили, что если янтарь потереть шерстяной тканью, то он начинает притягивать разные мелкие предметы – волосинки, пылинки, кусочки бумаги. В конце концов физики полностью изучили это явление, которое получило от янтаря название «электричество», а одному и носителей электричества дали название «электрон». Заряд у электрона противоположен заряду протона и равен -1. В природе не существует заряда меньше, чем у протона и электрона. (Опять-таки, у физиков есть теория, что такие частицы существуют, и физики уже многие годы пытаются такие частицы обнаружить, но пока безуспешно. И даже если такие частицы найдут, они будут только в отдельных лабораториях и даже скорее всего только в виде снимков.)
У электрона есть масса, но она примерно в 2000 раз меньше массы протона и поэтому не учитывается в химии.
У меня есть видео на Яндекс-Дзен о строении атома. Ссылка на него и другие наглядные и полезные видео есть в конце книги в главе «ДЛЯ ТЕХ, КОМУ ИНТЕРЕСНО БОЛЕЕ ДЕТАЛЬНОЕ ИЗУЧЕНИЕ ХИМИИ».
Опыт для определения заряда окружающих нас предметов
Как известно из курса физики, электрические заряды разных знаков притягиваются, а одинаковых знаков отталкиваются.
Для начала сделаем опыт с пластмассовой расчёской: возьмите листок бумаги и оторвите от него несколько мелких кусочков шириной 2—3 мм. Затем возьмите расчёску (не металлическую!) и поднесите её к бумажным обрывкам.
Обратите внимание, что бумажки не притягиваются к расчёске.
Теперь несколько раз проведите расчёской по своим волосам. Снова поднесите расчёску к бумажкам – они притянутся к расчёске и прилипнут к ней. Через некоторое время они упадут вниз.
Можно снова провести расчёской по волосам и она опять будет притягивать бумажки…
Что произошло? Разные вещества с разной силой притягивают электроны. Когда вы прикасались расчёской к волосам, часть электронов перешла от волос на расчёску и зарядила её отрицательно. Волосы при этом зарядились положительно.
Заряженная расчёска вызывает изменение распределения зарядов в бумажках и они притягиваются из-за взаимодействия электрических зарядов. Через некоторое время избыточный заряд расчёски переходит на молекулы воздуха, сила притяжения уменьшается и бумажки опять падают.
Этот опыт очень простой, безопасный и наглядный. Можно самому убедиться, что притяжение, вызванное электрическими силами больше, чем гравитационное притяжение Земли.
Вы также могли видеть, как легкие ткани могут притягиваться друг к другу – это тоже электрическое притяжение.
Теперь вторая часть опыта: внимательно посмотрите вокруг и поищите – что ещё так же сильно притягивается друг к другу, как бумажки к наэлектризованной расчёске? Или отталкивается, как одинаковые электрические заряды?
Скорее всего вы увидите, что все предметы спокойно стоят и никакого сильного и заметного притяжения не наблюдается.
Какой же вывод можно сделать из этого наблюдения? Каков заряд окружающих нас предметов?
Вывод такой: так как они не притягиваются и не отталкиваются друг от друга, то их заряд равен НУЛЮ!
Это очень важный вывод для физики и химии —
в обычном состоянии окружающие нас предметы, которые состоят из молекул и атомов, имеют нулевой суммарный заряд, хотя они и состоят из огромного количества протонов и электронов.
Размеры атомов. зависимость размера атома от его места в таблице Менделеева
Размеры атомов на первый взгляд ведут себя странно: в одном периоде слева направо с увеличением массы и заряда атома их размер уменьшается. Самый большой по диаметру атом находится в первой группе, а самый маленький – в последней (восьмой).
При этом при движении сверху вниз по группам логика просматривается – чем ниже, тем больше и заряд, и масса, и диаметр атома.
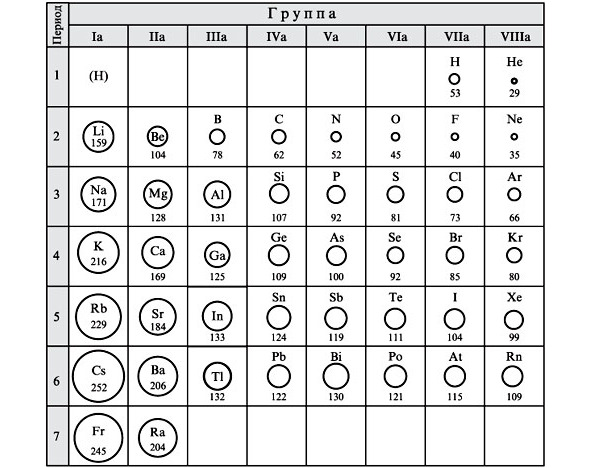
Почему такое происходит?
Дело в том, что электроны в атомах не летают в беспорядке вокруг ядра. Они организованы и занимают строго определённые положения.
Как выяснили физики уже после появления таблицы Менделеева, электроны создают вокруг ядра слои из электронов. И каждый следующий слой имеет больший радиус и больший объём, соответственно в нем может разместиться больше электронов.
Каждый слой соответствует периоду в таблице химических элементов.
Самый первый – имеет самый маленький радиус и объём и может вмещать только 2 электрона. Поэтому первый период самый маленький и включает всего два элемента – водород и гелий.
Конец ознакомительного фрагмента.
Текст предоставлен ООО «Литрес».
Прочитайте эту книгу целиком, купив полную легальную версию на Литрес.
Безопасно оплатить книгу можно банковской картой Visa, MasterCard, Maestro, со счета мобильного телефона, с платежного терминала, в салоне МТС или Связной, через PayPal, WebMoney, Яндекс.Деньги, QIWI Кошелек, бонусными картами или другим удобным Вам способом.







